小麦麸皮淀粉的分离制备与特征分析
赵瑞昌,田益华,姜 东*,戴廷波,荆 奇,曹卫星
(南京农业大学 江苏省信息农业高技术研究重点实验室,农业部南方作物生理生态重点开放实验室, 江苏 南京 210095)
小麦麸皮淀粉的分离制备与特征分析
赵瑞昌,田益华,姜 东*,戴廷波,荆 奇,曹卫星
(南京农业大学 江苏省信息农业高技术研究重点实验室,农业部南方作物生理生态重点开放实验室, 江苏 南京 210095)
利用中性蛋白酶制备小麦麸皮淀粉条件的基础上,进一步分析所制备小麦麸皮淀粉的形态及理化特性。结果表明:中性蛋白酶法制备小麦麸皮淀粉的最佳条件为中性蛋白酶质量浓度3g/L、反应温度45℃、反应时间90min,在此条件下,100g麸皮的淀粉产量为14.86g、蛋白含量为0.25%;麸皮淀粉中蛋白含量和破损淀粉含量均较低,小淀粉粒体积分数为58.4%;与面粉淀粉相比,麸皮淀粉中直链淀粉含量和糊化值较低,膨胀势较高,淀粉粒的相对结晶度较小。
小麦;麸皮;淀粉;中性蛋白酶
谷物淀粉不仅是人类主要的食物来源,也是一种工业原材料,广泛应用于食品、石油、造纸、纺织、医药等行业[1-2]。随着社会发展和人民生活水平的提高,人们对小麦淀粉品质也提出了更高的要求[3]。特定的应用目的对淀粉结构有特定的要求[4],因此,拓宽淀粉来源具有重要的现实意义。
小麦麸皮是小麦加工的副产品,麸皮中含有较丰富的淀粉(15%~20%)、蛋白质、维生素、矿物质及抗氧化物质等营养成分[5-7],因此也是重要的淀粉源。但有关小麦麸皮淀粉分离制备的研究较少,目前已有文献报道的小麦麸皮淀粉提取方法是湿磨法[8],即采用高温振荡和甲苯提取;但高温改变了淀粉的原始形态和理化性质,使小麦麸皮淀粉的应用受到限制,因此需改善小麦麸皮淀粉的分离制备方法。蛋白酶可分解麸皮蛋白质,使淀粉与纤维的结合松弛,而且分离成多肽的蛋白更利于人体的吸收利用,同时超声波具有空穴效应、热效应等有效机制[9-11],可以进一步促进淀粉与纤维的分离,从而更有效的分离制备小麦麸皮淀粉。本实验采用中性蛋白酶溶液,结合超声波处理,研究小麦麸皮淀粉的分离制备方法,并分析比较小麦麸皮与面粉提取淀粉的理化特性,以期为进一步开发利用小麦麸皮淀粉提供参考。
1 材料与方法
1.1 材料、试剂与仪器
小麦麸皮(含水量11.9%、淀粉含量17.2%、蛋白质含量16.9%)、面粉 南京海富食品厂;面粉淀粉由本实验室纯化。
中性蛋白酶(酶活力2万IU/mL) 上海如吉生物有限公司;其他药品均为分析纯。
Saturn Digisizer 5200激光衍射粒度分析仪 美国麦克科技仪器公司;Super3快速黏度仪 澳大利亚Newport公司;Dmax-B型X-射线衍射仪 日本理学电机株式会社。
1.2 试验设计
在预试验的基础上[12-13],确定了影响淀粉产量和蛋白质含量的3个主要因素:中性蛋白酶浓度、反应温度、反应时间,每个因素三个水平,进行三因素三水平正交试验设计。
称取100g小麦麸皮加入Tris-HCl (pH7.0)溶液中,固液比为1:10(g/mL)。根据试验设计加入中性蛋白酶2、3、4g/L,分别在40、45、50℃温度条件下,振荡反应60、30、90min,超声波处理10min;过325目金属筛,去离子水冲洗筛上物3次,2500r/min离心淀粉浆液10min,去掉上清液;加入100mL酒精,振荡30min,2500r/min离心10min,重复3次,干燥即得淀粉。
1.3 测定项目与方法
1.3.1 总淀粉含量测定
总淀粉含量测定采用旋光法;直链淀粉含量测定采用碘-碘化钾比色法[14];破损淀粉测定[15-16]参照AACC 2000(76-30);蛋白质含量测定采用凯氏定氮法,氮含量乘5.7即为蛋白质含量。
1.3.2 淀粉粒级分布测定
以水为分散剂(每个样品取500~600mL),添加辅助试剂为偏六磷酸钠(sodium meta-phosphate),其与分散剂的比值为1:2000(g/mL);分散剂水的参数设置:折射率1.331、密度0.996g/cm3、黏度0.798mPa·s,样品淀粉的参数设置:折射率1.530、0.200(实部、虚部),密度3.880g/cm3;采用激光衍射粒度分析仪测定样品中淀粉粒度。
1.3.3 淀粉粒膨胀势测定
参考McCormick[17]等方法,略有改变。称取0.2g淀粉,置于离心管中,加入5mL蒸馏水,混匀10s,60℃水浴10min后再100℃水浴5min,冷却,2000r/min离心4min,去除上清液,收集沉淀物。

采用Super3快速黏度仪,参照AACC 76-21标准方法2和标准分析方法2测定淀粉粒糊化值,3.0g淀粉样品与25mL蒸馏水混合于样品钵内,搅拌均匀后测定黏度;先以960r/min的速度搅拌10s,之后整个过程速度维持在160r/min。温度控制如下:50℃维持1min,以6℃/min的步幅升至95℃,保持5min,然后以相同步幅冷却至50℃,并保持3min。使用软件分析糊化参数。
淀粉结晶度的测定参考Fujita[18]方法略有改动:采用X-射线衍射仪,衍射角2θ的旋转范围为4~35℃,测得淀粉的X-衍射图谱,相对结晶度按照以下公式计算:

式中:Ia为X-射线衍射图谱中非结晶区的面积;Ic是结晶区的面积。
1.4 数据分析
采用Statistica 7.0软件进行数据分析,所有数据均3次重复,取平均值。
2 结果与分析
2.1 分离条件的确定
2.1.1 分离条件对淀粉产量的影响
正交试验结果和极差分析分别见表1和表2。由淀粉产量的极差分析可知,影响因素大小依次为A>C>B,优化方案为A3B2C3,即中性蛋白酶质量浓度4g/L、反应温度45℃、反应时间90min。该方案在9个试样中都没有出现,从试验结果分析,试样8(A3B2C1)的产量最高达15.51g/100g麸皮。
摘 要:《窗边的小豆豆》里的巴学园是孩子的天堂。无数次,我幻想着能给孩子们一座梦寐以求的“巴学园”,但直到遇到他,我才真正意识到,作为老师要用自己的真情换取学生的真情,用老师的爱换取学生的信赖与努力,因材施教、扬长补短,让他们争取做最好的自己。只有这样才能达到我们的教育目的,真正的给予每一个学生一座心中的“巴学园”。

表1 正交试验方案及各处理淀粉产量与蛋白质含量Table 1 Orthogonal array design matrix and experimental values of starch yield and protein content in the prepared starch
2.1.2 分离条件对淀粉中蛋白质含量的影响
试样产量高不一定纯度也高,试样6的产量为
15.43g,但其蛋白质含量为0.44%,所以单从产量的角度分析探讨最佳水平的组合不太合适。从表2可以看出,因素A(中性蛋白酶质量浓度)是影响蛋白质含量最主要的因素,随着中性蛋白酶质量浓度的升高,麸皮淀粉中蛋白质含量呈“V”字形变化,质量浓度过高或过低时,蛋白质含量均较高;其次为因素B(反应温度)和因素C(反应时间);根据极差分析得到优化方案为A2B2C3,即当中性蛋白酶浓度为3g/L时,在45℃条件下反应90min,麸皮淀粉中蛋白质含量最低为0.25%。

表2 淀粉产量和蛋白质含量的极差分析Table 2 Range analysis for starch yield and protein content in the prepared starch with various hydrolysis conditions
2.1.3 综合分析
综合麸皮淀粉产量和其蛋白含量的正交分析结果,当蛋白酶质量浓度从3g/L增加到4g/L时,麸皮淀粉产量增加幅度较小,而相应的蛋白质含量增加幅度则较大,为获得较纯麸皮淀粉,取蛋白酶质量浓度为3g/L较佳;反应温度处于45℃时,麸皮淀粉的产量最高,且麸皮淀粉中蛋白含量最低;随着反应时间的延长,麸皮淀粉产量呈增加的趋势,而蛋白质含量呈减少的趋势,得出试验的优化方案为A2B2C3,即中性蛋白酶质量浓度为3g/L,在45℃反应90min时,麸皮淀粉产量为14.86g/100g麸皮,蛋白质含量为0.25%。为确定其有效性,作4次重复,结果为淀粉产量(14.86±0.1)g/ 100g麸皮,蛋白质含量(0.25±0.03)%。
2.2 麸皮淀粉与面粉淀粉理化特性比较
2.2.1 蛋白质和淀粉含量
由表3可知,麸皮淀粉中蛋白质含量为0.25%,显著低于面粉淀粉中蛋白质含量(0.85%);与面粉淀粉相比,麸皮淀粉中的破损淀粉率较低,且差异达显著水平,这可能是因为磨制面粉过程中的物理剪切作用所致[19];麸皮淀粉中小淀粉粒的体积分数为58.4%,显著高于面粉淀粉中的22%。
2.2.2 淀粉组分和膨胀势
由表3可知,麸皮淀粉中直链淀粉含量为22.3%,低于面粉淀粉含量26.05%,差异显著;麸皮淀粉中支链淀粉含量与直链淀粉含量的比值显著高于面粉淀粉的比值,为3.48;膨胀特性反映淀粉悬浮液在糊化过程中的吸水特性和在一定条件下离心后的持水能力;麸皮淀粉的膨胀势与面粉淀粉相比,差异显著,这是因为淀粉的膨胀势与淀粉中的支链淀粉、直链淀粉以及支链淀粉含量与直链淀粉含量的比值有关。
2.2.3 粒度分布
小麦淀粉颗粒呈圆形或椭圆形,少数无规则形状;按直径划分,小麦淀粉包含A型淀粉粒(大于10μm)、B型淀粉粒(1.5μm<B<10μm)和C型淀粉粒(小于1.5μm),通常将B型淀粉粒和C型淀粉粒统称为B型淀粉粒(小于10μm),淀粉粒大小分布是影响淀粉特性的一个重要因素。从图1可以看出,面粉淀粉中A型淀粉粒含量大于B型淀粉粒含量,在10μm处有一个明显的低谷,峰值出现在22μm处。麸皮淀粉中B型淀粉粒含量明显增多,A型淀粉粒减少,峰值前移,出现在14μm处;10μm处无明显低谷,低谷出现在1.5μm处,直径小于1.5μm的淀粉粒明显增多。
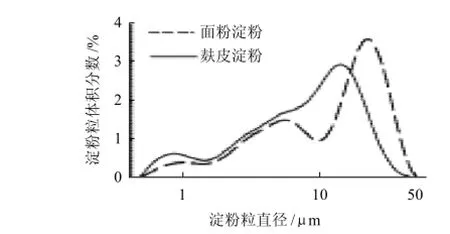
图1 小麦麸皮淀粉的粒级分布Fig.1 Particle size distribution of wheat bran starch

表3 小麦麸皮与面粉淀粉部分理化特性比较Table 3 Comparison of physico-chemical traits between wheat bran starch and wheat flour
2.2.4 糊化特性

表4 小麦麸皮淀粉的糊化值Table 4 Comparison of pasting properties of wheat bran starch and wheat starch
由表4可知,麸皮淀粉与面粉淀粉相比,糊化温度较高达86.9℃,峰值黏度、低谷黏度、崩解值、最终黏度以及回升值均较低,差异均显著。
2.2.5 晶体特性
X-射线衍射图谱是淀粉粒内部晶体结构状况的“指纹”,根据X-射线衍射特征谱线,可将淀粉的晶体结构分为4种类型——A、B、C和V,其中A、B、C型为天然淀粉的晶体结构,V型为直链淀粉与脂类物质形成复合体的晶型[20]。从图2可以看出,对麸皮淀粉和面粉淀粉粒的X-射线衍射图谱分析发现,面粉淀粉粒晶体结构均呈现出典型的A型特征,具体表现为:在衍射角和18°位置分别有一单峰,在2θ为20°位置有一弱峰,且在2θ为17°和18°附近出现了相连的双峰,淀粉麸皮除在2θ为17°附近的一单峰外,其余点的峰并不明显。由表7可知,比较麸皮淀粉和面粉淀粉淀粉粒在不同2θ位置的尖峰强度,可以发现,淀粉粒在2θ=23°左右的尖峰强度相对较高,其次是2θ=17°左右的尖峰强度,而2θ=21°左右的尖峰强度相对较低。面粉淀粉淀粉粒在不同2θ位置的尖峰强度都强于麸皮淀粉淀粉粒;麸皮淀粉淀粉粒的相对结晶度明显小于面粉淀粉淀粉粒的相对结晶度。

图2 麸皮淀粉和面粉淀粉的X-射线衍射图Fig.2 X-ray powder diffraction patterns of wheat bran starch and wheat starch granules

表5 小麦麸皮和面粉淀粉X射线衍射图谱的主要特征参数Table 5 X-ray powder diffraction data of wheat bran starch and wheat starch granules
3 讨 论
目前,关于从小麦麸皮中分离制备淀粉的工艺较少。Verwimp等[12]和张国权等[21]采用蛋白酶分别制备了裸麦和荞麦淀粉,并对所得淀粉特性进行了分析,结果表明采用蛋白酶能够很好的制备淀粉。本实验研究了利用中性蛋白酶分离制备小麦麸皮淀粉的条件。正交试验结果表明,中性蛋白酶法制备小麦麸皮淀粉的最佳条件为中性蛋白酶质量浓度3g/L、反应温度45℃、反应时间90min。此条件下,麸皮淀粉产量为14.86g/100g麸皮,蛋白含量为0.25%。
研究结果表明,麸皮淀粉与面粉淀粉相比有明显不同的特征。麸皮淀粉中小淀粉粒的体积分数为58.4%,显著高于面粉的22%,麸皮淀粉中抗性淀粉含量亦高于胚乳淀粉。破损淀粉含量与峰值黏度、低谷黏度、最终黏度、回升值、峰值时间、糊化温度呈显著负相关,说明破损淀粉含量的高低影响着淀粉黏度和食品加工品质。这与李春燕等[22]研究结论相反,原因有待于进一步研究。
研究发现,麸皮淀粉的膨胀势(12.28)显著高于面粉淀粉(8.90)。麸皮淀粉淀粉粒的相对结晶度明显小于面粉淀粉淀粉粒的相对结晶度。说明麸皮淀粉与面粉淀粉淀粉结晶区的晶胞结构或微晶排列存在差别。麸皮淀粉淀粉粒内部的结晶区所占比例较小,淀粉粒的结构较为疏松。面粉淀粉的峰值黏度、终值黏度回升值等均高于麸皮淀粉;峰值黏度与B型淀粉粒的含量有显著负相关性,这与Xie等[8]的研究结果相似;B型淀粉粒含量和支链淀粉含量与直链淀粉含量的比值呈正相关性。
[1]于淑娟, 周广慧. 直链淀粉的应用[J]. 现代化农业, 1994(6): 33-34.
[2]邹弈星, 潘志芬, 邓光兵, 等. 谷物籽粒淀粉研究进展[J]. 西北植物学报, 2007(10): 2128-2139.
[3]梁灵, 魏益民, 师俊玲. 小麦淀粉研究概况[J]. 西部粮油科技, 2003 (3): 21-25.
[4]张海艳, 董树亭, 高荣岐. 植物淀粉研究进展[J]. 中国粮油学报, 2006 (1): 41-46.
[5]陈凤莲. 小麦麸皮中低聚木糖的生物制备技术研究[D]. 哈尔滨: 东北林业大学, 2006.
[6]张海波. 小麦麸皮制备低聚木糖的研究[D]. 无锡: 江南大学, 2008.
[7]李昌文, 欧阳韶晖. 小麦麸皮的综合利用[J]. 粮油加工与食品机械, 2003(7): 55-56.
[8]XIE X J, CUI S W, LI W, et al. Isolation and characterization of wheat bran starch[J]. Food Research International, 2008, 41(9): 882-887.
[9]李光, 张雅利, 梁花香. 豆渣异黄酮超声提取工艺的响应曲面法优化[J]. 食品科技, 2008, 33(2): 144-148.
[10]张泽生, 于卫涛. 超声波法提取米糠中植物甾醇的工艺研究[J]. 食品研究与开发, 2007(1): 43-46.
[11]李东锐, 苏明华, 汪海波. 超声波及匀浆技术在米糠多糖和米糠蛋白提取中的应用研究[J]. 粮油加工, 2007(11): 92-95.
[12]VERWIMP T, VANDEPUTTE G E, MARRANT K, et al. Isolation and characterisation of rye starch[J]. Journal of Cereal Science, 2004, 39 (1): 85-90.
[13]LI Yue, SHOEMAKER C F, MA Jianguo, et al. Effects of alcalase/ protease N treatments on rice starch isolation and their effects on its properties[J]. Food Chemistry, 2009. 114(3): 821-828.
[14]上海植物生理学会. 现代植物生理学实验指南[M]. 北京: 科学出版
社, 1999: 131-134.
[15]WANG L, WANG Y J. Rice starch isolation by neutral protease and high-intensity ultrasound[J]. Journal of Cereal Science, 2004, 39(2): 291-296.
[16]MAHADEVAMMA, THARANATHAN R N. Resistant starch in wheatbased products: Isolation and characterisation[J]. Journal of Cereal Science, 2001, 34(1): 73-84.
[17]MCCORMICK K M, PANOZZO J F, HONG S H. A swelling power test for selecting potential noodle quality wheats[J]. Aus J Agri Res, 1991, 42: 317-323.
[18]FUJITA S, YAMAMOTO H, SUGIMOTO Y, et al. Thermal and crystalline properties of waxy wheat (Triticum aestivum L.) starch[J]. Journal of Cereal Science, 1998, 27(1): 1-5.
[19]van der BORGHT A, GOESAERT H, VERAVERBEKE W S, et al. Fractionation of wheat and wheat flour into starch and gluten: overview of the main processes and the factors involved[J]. Journal of Cereal Science, 2005, 41(3): 221-237.
[20]韦存虚, 张翔宇, 张军, 等. 不同类型小麦品种大、小淀粉粒的分离和特性[J]. 麦类作物学报, 2007(2): 255-260.
[21]张国权, 石书奎, 欧阳韶晖, 等. 荞麦淀粉制备新工艺研究[J]. 西北农林科技大学学报: 自然科学版, 2008(7): 165-172.
[22]李春燕, 封超年, 王亚雷, 等. 不同小麦品种籽粒淀粉理化特性的差异及其相关[J]. 作物学报, 2007(7): 1129-1134.
Enzymatic Preparation and Physico-chemical Characterization of Wheat Bran Starch
ZHAO Rui-chang,TIAN Yi-hua,JIANG Dong*,DAI Ting-bo,JING Qi,CAO Wei-xing
(Key Laboratory of Crop Physiology and Ecology in Southern China, Ministry of Agriculture, Hi-Tech Key Laboratory of Information Agriculture of Jiangsu Province, Nanjing Agricultural University, Nanjing 210095, China)
Optimal neutrase hydrolysis of wheat bran for starch preparation was investigated using orthogonal array design. Along with this, the prepared starch was characterized physicochemically. Results showed that the neutrase hydrolysis reaction for 90 min at 45 ℃ and an enzyme dosage of 3 g/L resulted in an optimal compromise between high starch yield and low protein content in the prepared starch, which reached up to 14.86 g/100 g wheat bran and 0.25%, respectively. The prepared starch contained lower contents of both protein and damaged starch and small starch granules with a volume fraction of 58.4%. Compared with wheat starch, this starch exhibited lower amylose content, pasting value and degree of crystallinity and higher swelling power.
wheat;bran;starch;neutrase
TS234.2
A
1002-6630(2010)10-0001-05
2009-07-20
国家自然科学基金项目(30671216;30700483;30971734);江苏省自然科学基金项目(BK2008329);教育部新世纪优秀人才资助计划项目(06-0493);国家现代农业产业技术体系建设专项(nycytx-03);江苏省粮丰工程项目(BE2009426)
赵瑞昌(1983—),男,硕士,主要从事小麦深加工研究。E-mail:zruichang@163.com
*通信作者:姜东(1970—),男,教授,博士,主要从事小麦品质生理生态与深加工研究。E-mail:jiangd@njau.edu.cn

