响应面法优化Aspergillus niger X-6发酵生产菊粉酶工艺的研究
罗登林,袁海丽,曾小宇,刘建学
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
响应面法优化Aspergillus niger X-6发酵生产菊粉酶工艺的研究
罗登林,袁海丽,曾小宇,刘建学
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
为提高Aspergillus niger X-6发酵生产菊粉酶的产率,运用Plackett-Burmen方法对麸皮、菊粉、蛋白胨、酵母膏添加量和发酵时间、温度、pH值、接种量8个影响因素进行考察,筛选出麸皮添加量、发酵时间和pH值为3个显著影响因素,然后采用Box-Behnken中心组合和响应面法对上述3个因素进行产酶条件的进一步优化,建立菊粉酶产率的二次多项式数学模型,并分析模型的有效性与因子间的交互作用。结果表明:黑曲霉发酵产菊粉酶的优化工艺参数为:麸皮添加量4.64%、发酵时间81.5h、pH6.0。在此条件下,产酶活力达20.42U/mL,与优化前相比提高了30.81%。
菊粉酶;Aspergillus niger X-6;发酵;响应面法
菊粉酶(inulinase),学名β-2,1-D-果聚糖酶,是一类能够水解菊粉的酶的总称[1]。利用菊粉酶水解菊粉可生产功能性低聚果糖和超高果糖浆,它们具有低热量、抗龋性、调控血糖等多种生理功能;同时该方法生产工艺简单,产物得率高[2-6]。在上世纪70年代初,国外就开始选育高产菊粉酶的微生物来水解菊粉生产超高果糖浆,目前相关核心技术被比利时RAFTI和WARCOING及荷兰COSUN三家公司所垄断[7-8]。我国对菊粉酶的研究起于上世纪90年代,由于重视程度不够,相关研究进展比较缓慢[9-10]。近年来随着人们生活水平的提高和健康意识的增强,以及我国有着广泛种植可用于生产菊粉的原料——菊芋(俗名洋姜)的优势,因此,关于如何提高菊粉酶产率的研究正日益受到人们的重视。
本实验以从菊芋生长的根际土壤中经过初筛、分离纯化、复筛和微波诱变后得到的一株Aspergillus niger X-6为菌种,运用Plackett-Burmen方法对影响产菊粉酶的因素进行分析,然后采用Box-Behnken中心组合和响
应面法对相关显著因素进行进一步的优化,以期获得Aspergillus niger X-6发酵生产菊粉酶的优化工艺,提高菊粉酶的产率。

表1 Plackett-Burman试验因素水平及编码Table 1 Factors and levels in Plackett-Burman design
1 材料与方法
1.1 菌种
从菊芋生长的根际土壤中经过初筛、分离纯化和复筛后,鉴定为Aspergillus niger,然后对复筛所得的菌株进行微波诱变,得到一株高产菊粉酶的菌株,定义为Aspergillus niger X-6。
1.2 菊粉
粗制菊粉,用于培养基的配制;精制菊粉(菊粉含量>92%,用于测酶活力的底物)由昆山拓丰贸易有限公司提供;其他试剂均为分析纯。
1.3 粗制菊粉的制备
用超声波辅助水溶液提取菊粉,具体工艺参数为:总提取时间10min、超声辐照方式15s/6s、超声功率750W、超声频率20kHz、料液比1:30.15、提取温度40℃,然后对所得提取液依次进行抽滤、真空浓缩、热风干燥(50℃)和粉碎,得到粗制菊粉(含水量5.63%)。
1.4 培养基
液体发酵培养基:麸皮质量分数4%、蛋白胨4%、粗制菊粉2%、酵母膏0.4%、NaCl 0.5%、K2HPO4· 3H2O 0.3%,初始pH6.5,接种量5%。
1.5 菊粉酶活力的测定
取0.5mL适当稀释的酶液,加入4mL、2%的精制菊粉溶液(0.1mol/L、pH4.5的醋酸-醋酸钠缓冲液配制)中,54℃保温10min,沸水浴10min灭活终止反应(在完全相同的条件下灭活酶底物对照),快速冷却后,测定还原糖产量[11-12]。菊粉酶活力定义为在上述条件下每分钟产生1μmol还原糖的酶量为1个菊粉酶活力单位(μmol/ (min·mL))。
1.6 Plackett-Burmen试验
选用N=12的Plackett-Burman试验设计,对麸皮添加量、粗制菊粉添加量、蛋白胨添加量、酵母膏添加量、发酵时间、温度、p H值、接种量8个影响菊粉酶活力的相关因素进行研究[13]。每个因素取两个水平:低水平“-1”和高水平“1”,“1”为“-1”的1.5~2倍,另设两个空白项对应表中的X3和X9,以考察试验误差。评价指标为菌株发酵后的酶活力(U/mL)。 Plackett-Burman试验设计因素水平及编码见表1。
1.7 显著因素的中心点试验
根据Plackett-Burman试验结果,确定麸皮添加量、发酵时间、起始pH值为影响评价指标的显著因素。分别对这3个因素进行单因素试验,获得每个因素的最佳产酶水平。
1.8 响应面优化
根据Plackett-Burman试验和单因素试验结果,选取麸皮添加量(X1)、发酵时间(X2)和初始pH值(X3)3个因素与菌株发酵产菊粉酶活力进行响应面试验。采用Box-Benhnken的中心组合实验设计并运用SAS9.0统计软件对试验数据进行回归分析,预测菌株发酵产酶的最优工艺参数并进行验证。Box-Benhnken试验设计因素水平及编码见表2。

表2 Box-Benhnken试验因素水平及编码Table 2 Factors and levels in Box-Benhnken design
2 结果与分析
2.1 Plackett-Burman试验结果

表3 Plackett-Burman试验设计及结果Table 3 Plackett-Burman design layout and experimental results
Plackett-Burman试验结果见表3,表中1~12分别
代表12组实验,按照设计好的方案进行发酵实验并最终测得其菊粉酶活力,每组试验重复3次。运用SAS9.0统计软件对表3进行方差分析,其结果见表4。

表4 Plackett-Burman试验方差分析Table 4 Variance analysis for Plackett-Burman experimental results
采用SAS软件对表3的酶活力数据进行逐步回归分析,得到酶活力为响应值的最优多元次回归方程:
Y=9.220833-1.165833X1-0.444167X2+0.495833X3+ 0.5975X4+1.080833X5+0.3625X6-0.559167X7+2.620833X8-0.1075X9-0.300833X10
由表4方差分析结果表明,所得的回归方程达到显著(P=0.038172),决定系数R2=0.9998,说明99.98%的试验数据的变异性可以用此回归模型来解释。在试验设计的水平范围内X1、X5和X8对菊粉酶活力均有显著影响(P<0.05),它们对菊粉酶活力的影响水平可以达到98%左右,其他因素在所考察的水平范围内对酶活力的影响不显著。因此,对黑曲霉X-6发酵生产菊粉酶最主要的影响因子为麸皮添加量(X1)、发酵时间(X5)和初始pH值(X8),选取他们为研究对象,作进一步的优化试验。
2.2 响应面优化结果
2.2.1 响应面试验结果及方差分析
麸皮添加量、发酵时间、pH值的单因素试验结果表明,选择麸皮添加量4%、发酵时间84h、pH6.0作为试验的中心点。采用Box-Behnken试验设计对3个显著因素进行优化试验。根据表2的因素和水平,以X1、X2、X3为自变量,将影响不显著的因素固定在上述试验中的低水平,以最终测得的酶活力为响应值(Y),试验方案及结果见表5。表5中1~15分别代表15组实验,其中13~15为中心点试验,重复3次,用以估计实验误差。

表5 响应面分析试验设计及结果Table 5 Box-Benhnken design layout and experimental results
通过SAS9.0统计软件对表5的试验结果进行多元回归拟合,获得菊粉酶活力(Y)对自变量麸皮添加量X1、发酵时间X2、初始pH值X3的二次多项回归模型方程如下:
Y=20.08333+0.4475X1-0.63875X2+1.63125X3-0.355417X12-0.195X1X2-0.295X1X3-2.137917X22-0.8775X2X3-6.957917X32
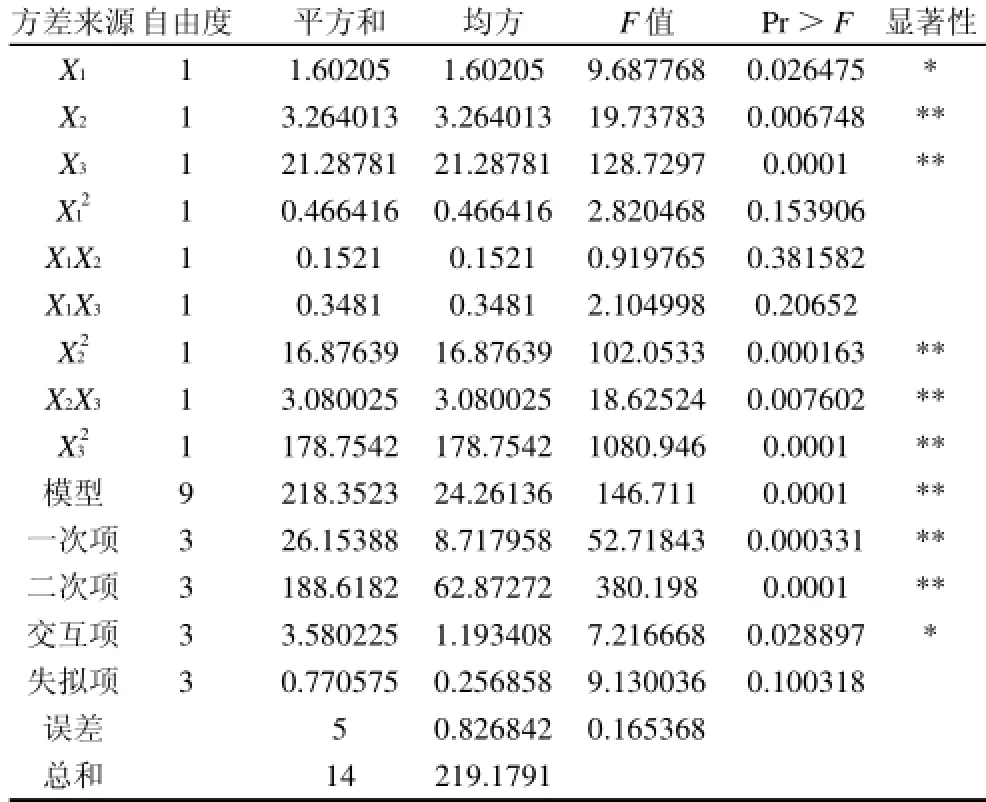
表6 方差分析表Table 6 Variance analysis for Box-Benhnken experimental results
由表6可知,方程失拟项不显著(P=0.100318>0.05),说明方程不失拟。方程模型极显著(P=0.0001<0.01),说明方程能够很好的拟和试验结果。同时,软件分析得到模型的决定系数R2=0.9962,说明菌种发酵产菊粉酶活力所考察的3个因素中,仅有0.38%试验数据
的变异性不能由该模型来解释,表明该模型能够很好地反映试验的真实情况。由二次多项回归模型方程得知,方程应变量与全体自变量之间线性关系明显,回归方程的一次项、二次项的均方差和系数都较大,而交互项系数较小,说明响应面分析所选的3个因素之间的交互效应较小。从方差分析表还可以看出,方程的一次项极显著,其中X1项显著,X2、X3项极显著;方程的二次项X22、X32项极显著;方程的交互项显著,其中X2X3项极显著,说明发酵时间(X2)与初始pH值(X3)对菌株发酵产酶有明显的交互作用。
2.2.2 最优响应值分析
运用SAS9.0软件对回归模型进行规范性分析,寻找最优响应区。回归模型存在稳定点,Y的最大估计值为20.38,稳定点(X1,X2,X3)为(0.63671,-0.20233,0.011648)。这说明:X1(麸皮添加量)的最佳范围在4.64%左右,X2(发酵时间)的最佳范围在81.57h左右,X3(pH值)的最佳范围在6.01左右。
2.2.3 验证实验
根据响应面分析得到菌种发酵产酶的最佳工艺参数为:麸皮添加量4.64%、发酵时间81.57h、起始pH6.01。在此条件下,菌种产菊粉酶活力达20.38U/mL。为了验证响应面分析的可靠性,结合实际试验条件,选定麸皮添加量4.64%、发酵时间81.5h、初始pH6.0,其他不显著因子条件不变,进行验证实验,经过3次平行试验,测得菌种发酵产菊粉酶实际酶活力的平均值为20.42U/mL,与理论预测值20.38U/mL接近,相对误差为0.196%,说明该回归模型预测准确性很高。
3 结 论
利用P la ck e tt-B u r man试验设计,考察影响Aspergillus niger X-6发酵生产菊粉酶的8个相关因素,包括:麸皮添加量、菊粉添加量、蛋白胨添加量、酵母膏添加量、发酵时间、温度、初始pH值和接种量,从中筛选出麸皮添加量、发酵时间、pH值3个对菌种发酵产酶具有显著影响的因素(P<0.05)。
在Plackett-Burman试验的基础上,通过Box-Behnken试验设计,对麸皮添加量、发酵时间、初始pH值3个显著因素进行响应面优化,建立了菊粉酶产率的二次多项式数学模型,分析了模型的有效性与因子间的交互作用,得到了Aspergillus niger X-6发酵生产菊粉酶的优化工艺参数为:麸皮添加量4.64%、发酵时间81.5h、pH6.0。在此条件下,菌种产菊粉酶活力达20.42U/mL,与优化前相比提高了30.81%。
[1]GARYO B, SUKAN S, VASSILEV N. Production and properties of inulinase from Aspergillus niger[J]. Biotechnology Letters, 1994, 16 (3): 275-280.
[2]CHEN Hanqing, CHEN Xiaoming, LI Yin, et al. Purification and characterisation of exo- and endo-inulinase from Aspergillus ficuum JNSP5-06[J]. Food Chemistry, 2009, 115: 1206-1212.
[3]HARAGUCHI K, YAMANAKA T, OHTSUBO K. Purification and properties of a heat stable inulin fructotransferase (DFA Ⅲ-producing) from Arthrobacter pascens T13-2[J]. Carbohydrate Polymers, 2002, 50: 117-121.
[4]ZHANG Linghua, ZHAO Changxin, ZHU Daochen, et al. Purification and characterization of inulinase from Aspergillus niger AF10 expressed in Pichia pastoris[J]. Protein Expression and Purication, 2004, 35: 272-275.
[5]谭晓琼, 董全, 丁红梅. 功能保健食品菊糖的研究进展与发展前景[J]. 中国食物与营养, 2007(1): 22-24.
[6]SHENG Jun, CHI Zhenming, LI Jing, et al. Inulinase production by the marine yeast Cryptococcus aureus G7a and inulin hydrolysis by the crude inulinase[J]. Process Biochemistry, 2007, 42: 805-811.
[7]SERGIO D G, GORDON G B, SNEHA A P, et al. Studies on the physiochemical properties of inulin and inulin oligomers[J]. Food Chemistry, 2000, 68: 179-183.
[8]CATANA R, FERREIRA B S, CABRAL J M S, et al. Immobilization of inulinase for sucrose hydrolysis[J]. Food Chemistry, 2005, 91: 517-520.
[9]苏豫梅, 李清清, 李秉超. 不同固定化菊粉酶方法的比较及条件优化[J]. 现代食品科技, 2008, 24(12): 1296-1299.
[10]邓建珍, 韦红群, 陈燕珍. 黑曲霉(Aspergillus niger)产菊粉酶菌株的筛选及培养条件的研究[J]. 生物学杂志, 2007, 24(6): 62-65.
[11]SPIRO R G. Analysis of sugars found in glycoproteins[J]. Methods in Enzymology, 1966, 8: 3-26.
[12]SINGH R S, BALWINDER S S, MUNISH P. Optimization of medium and process parameters for the production of inulinase from a newly isolated Kiuyveromyces marxianus YS-1[J]. Bioresource Technology, 2007, 98: 2518-2525.
[13]曾小宇. 产菊粉酶菌株的选育及其产酶条件的研究[D]. 洛阳: 河南科技大学, 2009: 40-41.
Optimization of Lnulinase Fermentation by Aspergillus niger X-6 Using Response Surface Methodology
LUO Deng-lin,YUAN Hai-li,ZENG Xiao-yu,LIU Jian-xue
(College of Food and Bioengineering, Henan University of Science and Technology, Luoyang 471003, China)
The objective of this study was to obtain the optimum conditions for Aspergillus niger X-6 fermentation to improve inulinase yield. The effects of the amounts of wheat bran, inulin, peptone and yeast extract in the fermentation medium, fermentation time and temperature, pH, and inoculum size on inulinase yield were evaluated using Plackett-Burmen design. Inulinase yield was significantly influenced by the amount of wheat bran addition, fermentation time and pH. Subsequently, the optimization of the three factors was conducted using Box-Behnken experimental design and response surface methodology, in which, a quadratic polynomial model for inulinase yield was established. The optimal fermentation conditions for inulinase prodtion were determined to be: the amount of wheat bran addition, 4.64%; fermentation time, 81.5 h; and initial mdedim pH 6.0. Under these conditions, the yield of inulinase reached 20.42 U/mL, 30.81% higher than that before optimization.
inulinase;Aspergillus niger X-6;fermentation;response surface methodology
TS201.2
A
1002-6630(2010)23-0138-04
2010-03-30
河南省教育厅科技攻关项目(2008B550002);河南科技大学SRTP项目(154)
罗登林(1976—),男,副教授,博士,研究方向为农产品深加工及生物化工技术。E-mail:luodenglin@sohu.com

