薏苡仁多糖的提取及分离纯化
肖小年,曾海龙,易 醒,熊 华,*
(1.南昌大学 食品科学与技术国家重点实验室,中德联合研究院,江西 南昌 330047;2.江西中德食品工程中心,江西 南昌 330047)
薏苡仁多糖的提取及分离纯化
肖小年1,曾海龙1,易 醒2,熊 华1,*
(1.南昌大学 食品科学与技术国家重点实验室,中德联合研究院,江西 南昌 330047;2.江西中德食品工程中心,江西 南昌 330047)
在单因素试验基础上,选取料液比、提取温度和提取时间3项为考察因素,通过正交试验L9(33)优化薏苡仁多糖提取的最佳工艺条件;对薏苡仁多糖进行分离纯化,考察薏苡仁多糖的SephadexG-75凝胶柱层析特性以及纯度鉴定。结果表明:料液比1:15(g/mL)、提取温度100℃、提取时间150min为最佳提取条件,在最佳条件下薏苡仁多糖得率为5.53%;紫外扫描结果显示薏苡仁多糖中不含核酸和蛋白质。
薏苡仁多糖;正交试验;提取;分离纯化
薏苡仁(Semen Coicis),英文名Coix Seed,为禾本科植物薏苡(Coix Lacryma-jobi L.var.ma-yuen(Roman.) Stapf的干燥成熟种仁,又名薏米、苡仁,俗称“药王米”、“回回米”、“六谷米”等[1]。《本草纲目》中提及薏苡仁“健脾益胃、补肺清热、祛风胜温、强筋骨”[2]。薏苡在我国大部分地区均有种植,主要产于福建、河北、辽宁等地。国内对薏苡仁的开发利用极为重视,我国主要对薏苡仁酯做了大量研究工作[3-6],并且已经被康莱特公司研制成抗肿瘤的注射液[7]等产品,在临床上以得到广泛应用,提取薏苡仁油以后的残渣常弃之不用或用作饲料。薏苡仁中含有较多的多糖,目前对薏苡仁多糖提取分离纯化研究较少且多糖的得率不高[8-9]。其多糖已被证实具有降血糖[10]、提高免疫力[11]等作用。本实验以提油后的薏苡仁渣为原料进行多糖的提取和分离纯化的初步研究,一方面旨在提高薏苡仁的综合利用,另一方面为薏苡仁多糖的进一步研究开发提供更多的参考数据。
1 材料与方法
1.1 材料与试剂
薏苡仁(产地:浙江) 南昌汇仁集团有限公司。
石油醚(60~90℃)、丙酮、乙醚、95%乙醇、苯酚、浓硫酸、葡萄糖、氯仿、正丁醇、30%双氧水、N a O H、浓H C l、淀粉酶、糖化酶、D E A E-5 2、
SephadexG-75等(均为分析纯)。
1.2 仪器与设备
B-260恒温水浴锅 上海亚龙生化仪器厂;电子天平 上海良平仪器仪表有限公司; KQ5200超声波清洗器昆山市超声仪器有限公司;SHZ-D(Ⅲ)循环水式真空泵巩义市予华仪器有限责任有限公司;RE52CS-1旋转蒸发仪 上海亚龙生化仪器厂;GZX-DH-40X-45S电热恒温干燥箱 上海跃进医疗器械厂;T6新世纪紫外分光光度计 北京普析通用仪器有限责任公司;JB-3磁力搅拌器上海电磁新泾仪器有限公司。
1.3 薏苡仁多糖提取工艺的优化
1.3.1 薏苡仁多糖提取工艺流程
薏苡仁→筛选→粉碎→脱脂→热水提取→离心→上清液→浓缩→醇沉→干燥→薏苡仁粗多糖
1.3.2 提取方法
挑选籽粒饱满、色泽洁白、无虫蛀、无霉斑的薏苡仁充分干燥后置于超微粉碎机中,粉碎过筛。每份称取5g,用石油醚脱脂后,置于三角瓶中,加蒸馏水调节pH5.2,于100℃水浴锅中提取。按20IU/g加淀粉酶到提取液中,直到碘检不变色;接着按18IU/g加糖化酶,水浴温度50~60℃,pH6.5处理1h,以去除淀粉。100℃水浴条件下灭酶10min,然后在3000r/min下离心1 0 m i n,上清液经减压浓缩,加入4倍浓缩液体积的9 5%乙醇醇沉过夜,干燥沉淀得薏苡仁粗多糖。
1.3.3 薏苡仁多糖含量的测定(改进的苯酚-硫酸法[12])
1.3.3.15 %苯酚溶液的配制
取苯酚100g,加铝片0.1g和碳酸氢钠0.05g,常压蒸馏,收集182℃馏分。称取该馏分5g,置100mL容量瓶中,加蒸馏水至刻度,摇匀后,置棕色试剂瓶中,冰箱中冷藏储存备用。
1.3.3.2 葡萄糖标准曲线的制作
精密称取80℃干燥至质量恒定的葡萄糖10mg于100mL容量瓶中,加水至刻度,摇匀即为质量浓度为0.1mg/mL的葡萄糖标准工作液。精密量取葡萄糖对照品溶液(0.1mg/mL)0.10、0.20、0.30、0.40、0.50mL分别置于干燥试管中,各加水至1.00mL,再分别加苯酚试剂0.50mL,摇匀,在冷水浴中迅速滴加硫酸2.50mL,即刻摇匀后放置10min,然后放置沸水浴加热10min,迅速冷却到室温。以1.0mL蒸馏水按同样显色操作为空白,于488nm波长处测定A值,以横坐标为葡萄糖质量、纵坐标为吸光度,绘制标准曲线。
1.3.3.3 换算因子测定[13]
精确称取60℃干燥至质量恒定的实验室精制薏苡仁多糖10mg,水溶解后定容到100mL容量瓶中,摇匀,作为多糖储备液。精确量取多糖储备液1mL,定容至l0mL,取0.5mL加水至1mL,按测定标准曲线同样的方法测其吸光度。按下式计算换算因子:

式中:m为多糖质量/mg;C为多糖液中葡萄糖的质量浓度/(mg/mL);D为多糖的稀释因子。
1.3.3.4 薏苡仁多糖得率的计算
提取液按上述操作显色,测得吸光度,由葡萄糖标准曲线查得多糖质量,并换算多糖得率。

1.3.4 正交试验设计
在全面考察提取温度、时间、pH值、提取次数、料液比、原料粉碎度的基础上,选择提取时间、提取温度、料液比3项为考察因素,各取3个水平,正交因素水平表(表1),进行L9(33)正交试验设计[14-16]。

表1 正交试验因素水平表Table1 Factors and levels in orthogonal array design
1.4 薏苡仁多糖的分离纯化
1.4.1 纯化工艺流程
薏苡仁粗多糖→脱脂→Sevag法脱蛋白→H2O2脱色→透析→DEAE-52柱层析→SephadexG-75凝胶柱层析→精制薏苡仁多糖
1.4.2 脱脂
精确称取粗多糖5g,溶于30mL蒸馏水中配成粗多糖溶液,在粗多糖液中加入(4倍体积)120mL的无水石油醚,振荡后,静置1 h,溶液分为上下两层,除去上层石油醚层,下层水溶液按上述步骤重复3次,最后得到脱脂的薏苡仁多糖液。
1.4.3 Sevag法脱蛋白[17]
在粗多糖液中加入1/5体积的Sevag试剂(氯仿:正丁醇=4:1),剧烈振荡30min,3000r/min离心20min取上清液,除去水与有机相间的变性蛋白层,上清液再按上述步骤重复处理5次,至氯仿与水层之间无白色胶状物
产生。最后得到脱蛋白的薏苡仁多糖液,减压浓缩至一定体积,加入4倍体积95%乙醇醇沉,静置澄清后倾去上清液,然后再加少量蒸馏水溶解,再醇沉,如此重复3次,以除去Sevag试剂。
1.4.4 脱色[18]
脱蛋白后的薏苡仁多糖水溶液以浓氨水(或NaOH溶液)调至pH8.0,滴加30% H2O2至浅黄色,于50℃水浴保温2 h。
1.4.5 透析
用截留相对分子质量为7000~14000的透析袋,流水透析2d,再以蒸馏水透析1d。单糖、双糖及无机盐等小分子物质可以透出膜外,而所要的薏苡仁多糖被截留在膜内,从而达到对多糖纯化的目的。将多糖溶液浓缩,并定容至25mL备用。
1.4.6 DEAE-52纤维素离子交换柱层析工艺流程[19]
DEAE-52纤维素粉→充分溶涨→漂洗3次→1mol/L NaOH溶液浸泡1h→蒸馏水洗至中性→1mol/L HCl溶液浸泡1h→蒸馏水洗至中性→1mol/L NaOH溶液浸泡1h→蒸馏水洗至中性→装柱→平衡→加样1mL→以蒸馏水洗脱(5mL/管,收集30管)→苯酚-硫酸法检测得洗脱曲线
1.4.7 SephadexG-75凝胶柱层析工艺流程[19-20]
SephadexG-75粉→充分溶涨→漂洗3次→1mol/L NaOH溶液浸泡1h→蒸馏水洗至中性→装柱→平衡→加样1mL→分别以蒸馏水、0.1mol/L NaCl溶液、0.3mol/L NaCl溶液为洗脱液洗脱(5mL/管,收集30管)→苯酚-硫酸法检测,得到三条洗脱曲线→分别合并高峰部分备用
1.5 紫外分光光度法鉴定纯度[21]
分别取5mL上述纯化后的薏苡仁多糖溶液,于200~400nm区间进行紫外光谱扫描,观察在260、280nm处是否有吸收。
2 结果与分析
2.1 葡萄糖溶液标准曲线
经实验得标准曲线方程为Y= 0.0177X-0.0151(相关系数R2=0.9993)。回归分析表明,在10~50μg/mL范围内葡萄糖的质量与吸光度呈良好线性关系。将薏苡仁粗多糖样品溶解到水中,稀释至合适浓度,按此方法测定多糖含量。实验测得换算因子f=0.1236。
2.2 正交试验
如表2所示,试验中各影响因素的主次顺序如下:B(提取温度)>C(料液比)>A(提取时间)。正交试验所得最佳工艺为A3B3C1,按此工艺提取薏苡仁多糖,多糖得率为5.53%(n=3)。

表2 正交试验设计及结果Table2 Orthogonal array design layout and experimental results
2.3 薏苡仁多糖的分离纯化
2.3.1 DEAE-52柱层析分离
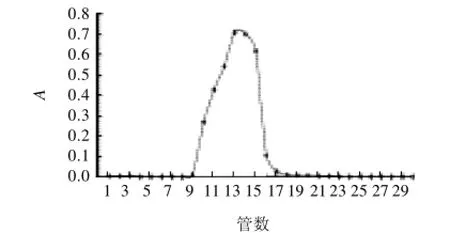
图1 薏苡仁多糖蒸馏水洗脱曲线Fig.1 DEAE-52 column separation of polysaccharides from adlay seeds eluted with distilled water
以蒸馏水为洗脱液,得薏苡仁多糖的DEAE-52柱层析洗脱曲线,如图1所示,只有一个单一的主峰。经DEAE-52柱层析,既可以进一步除去色素,又能除去其他杂质,干燥得到的薏苡仁多糖为白色固体。
2.3.2 SephadexG-75凝胶柱层析分离

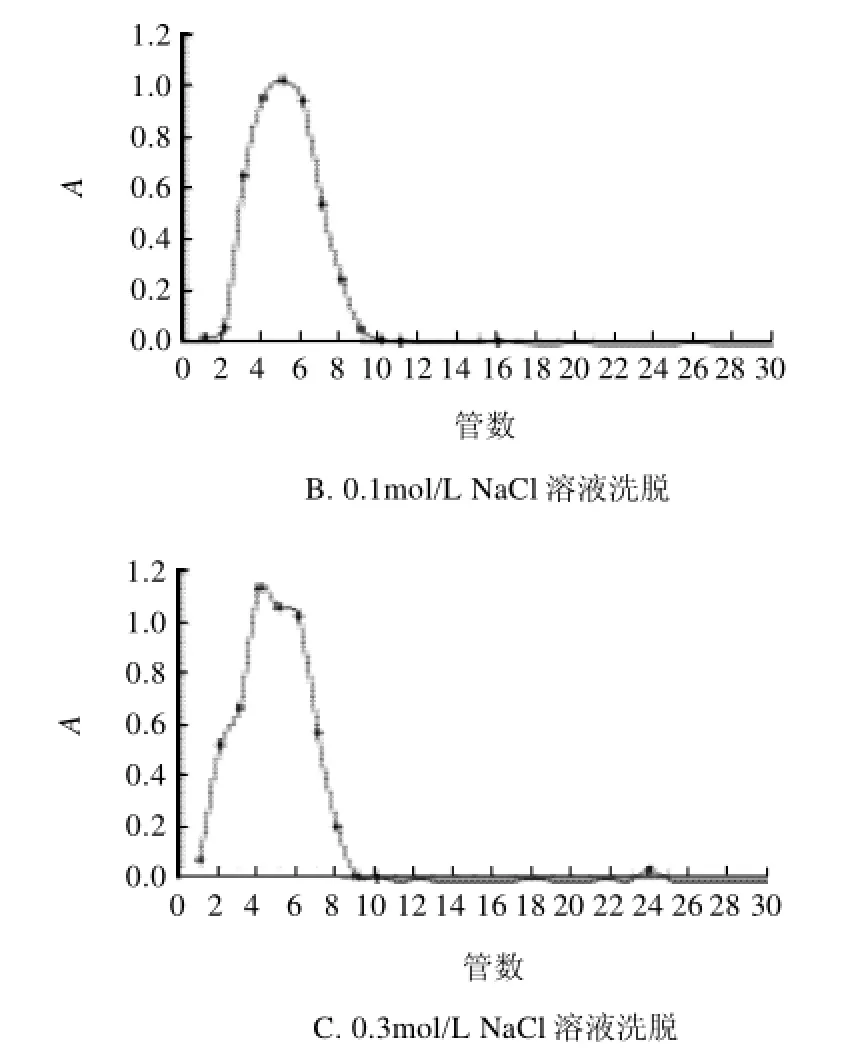
图2 薏苡仁多糖的不同洗脱剂洗脱曲线Fig.2 Sephadex G-75 column separation of polysaccharides from adlay seeds eluted with different solvents
薏苡仁多糖的SephadexG-75凝胶柱层析特性的考察,分别以蒸馏水、0.1mol/L NaCl溶液、0.3mol/L NaCl溶液为洗脱液洗脱(5mL/管,收集30管),苯酚-硫酸法检测,得到以上3条洗脱曲线,结果如图2所示。3个峰形图大致相同,以0.1mol/L NaCl溶液作为洗脱液的洗脱效果最佳。该洗脱曲线型特征为薏苡仁多糖研究提供了初步质量指标之一。
2.4 紫外光谱检测
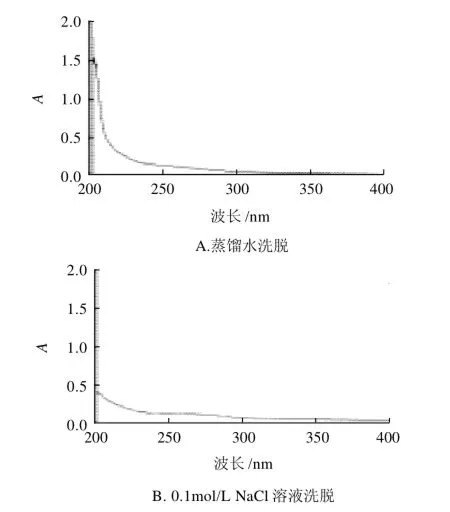

图3 不同洗脱剂洗脱薏苡仁多糖的紫外光谱扫描图Fig.3 UV scanning spectra of polysaccharides from adlay seeds eluted on Sephadex G-75 column with different solvents
由不同洗脱液得到的薏苡仁多糖的紫外光谱扫描结果(图3)可以看出,在260nm和280nm处均无吸收峰,证明纯化后的薏苡仁多糖中不含核酸和蛋白质。
3 结 论
3.1 薏苡仁多糖提取工艺优化结果表明,其最佳工艺条件为料液比1:15、提取温度100℃、提取时间150min。提取温度是影响多糖得率的最主要因素,薏苡仁多糖主要存在于胚乳细胞的细胞壁中,在一定的温度范围内,较高的提取温度利于胚乳细胞壁破碎而使多糖溶出。随着温度的提高,多糖得率也逐渐增加,温度100℃时多糖得率最高。料液比影响次之,提取时间在3个因素中对多糖得率影响最小,故在工业化生产中,考虑成本及工序问题,可适当缩短提取时间。在最佳条件下多糖得率为5.53%,与以往的报道相比条件适宜且多糖的得率有所提高[8-9]。
3.2 经粉碎之后的薏苡仁粉在高温蒸煮下易糊化黏稠,给提取液的分离带来不便,因此本研究在提取过程中加入了淀粉酶和糖化酶,以去除淀粉、降低黏度,使提取液澄清,易于分离。
3.3 SephadexG-75凝胶柱层析结果表明,以0.1mol/L NaCl溶液作为洗脱液的洗脱效果最佳,该洗脱曲线型特征为薏苡仁多糖研究提供了初步质量指标之一。
3.4 紫外光谱扫描结果表明,纯化后的薏苡仁多糖中不含核酸和蛋白质。
[1]张健. 薏米活性多糖提取研究[J]. 粮食与油脂, 2004(10): 24-25.
[2]高建华, 宁正祥. 苡仁营养成分的研究[J]. 食品研究与开发, 2006, 27(7): 174-176.
[3]李毓, 胡笑克. 薏苡仁酯对人鼻咽癌细胞裸鼠移植瘤的放射增敏作用[J]. 华夏医学, 2005, 18(2): 147-148.
[4]张凤清. 薏苡仁油的提取工艺研究[J]. 长春工业大学学报: 自然科学版, 2010, 31(1): 70-73.
[5]王敏, 姜藻. 薏苡仁酯对胃癌BGC-823细胞侵袭迁移能力的影响及其机制[J]. 东南大学学报: 医学版, 2010, 25(3): 284-287.
[6]金宏, 朱庆书, 赵文英, 等. 微波法提取薏苡仁油的研究[J]. 化学与生物工程, 2009, 26(7): 52-54.
[7]李大鹏. 康莱特注射液抗癌作用机理研究进展[J]. 中药新药与临床药理, 2001, 12(2): 122-124.
[8]庄玮婧. 薏米多糖结构与理化性质的研究[D]. 福州: 福建农林大学, 2008: 16.
[9]邢真. 薏米中生物活性物质的提取及应用研究[D]. 济南: 山东轻工业学院, 2009: 24.
[10]TAKAHASHI M, KONNO C, HIKINO H. Isolation and hypoglycemic of coixan A, B and C, glycans of Coix lachrymal-jobi var, ma-yuen seeds [J]. Planta medica, 1986, 53(2): 64-65.
[11]苗明三. 薏苡仁多糖对环磷酰胺致免疫抑制小鼠免疫功能的影响[J].中医药学报, 2002, 30(5): 49-50.
[12]朱彩云, 张声华. 枸杞子水提物中多糖含量的测定[J]. 食品与发酵工业, 2005, 31(2): 111-113.
[13]孟宪军, 李冬男, 汪艳群, 等. 响应曲面法优化五味子多糖的提取工艺[J]. 食品科学, 2010, 31(4): 111-115.
[14]王明艳, 王芳, 杨树平. 超声波技术用于薏米根多糖的提取[J]. 中国粮油学报, 2006, 21(6): 59-61.
[15]吕峰. 我国薏苡仁资源主要品质及薏苡仁活性多糖的研究[D]. 福州:福建农林大学, 2008: 45-51.
[16]姜波, 孙静, 刘春, 等. 五味子水溶性多糖提取及纯化工艺的优化[J].时珍国医国药, 2009, 20(10): 2164-2166.
[17]张惟杰. 复合多糖生化研究技术[M]. 上海: 上海科学技术出版社, 1987.
[18]杨娟, 吴谋成, 张声华. 香菇子实体多糖Le-Ⅲ的提取、分离及纯度鉴定[J]. 食品工业科技, 1999, 20(3): 16-17.
[19]武忠伟, 刘明久, 窦艳萍, 等. 虫草多糖醇沉和DEAE-32纤维素柱层析特性研究[J]. 食品科学, 2008, 29(2): 86-90.
[20]徐梓辉, 周世文, 黄林清. 薏苡仁多糖的分离提取及其降血糖作用的研究[J]. 第三军医大学学报, 2000, 22(6): 578-581.
[21]韩春然, 唐娟, 马永强. 黑木耳多糖的酶法提取、纯化及性质研究[J]. 食品科学, 2007, 28(2): 53-55.
Isolation and Purification of Polysaccharides from Coix lachryma-jobi L. var. ma-yuen Stapf
XIAO Xiao-nian1,ZENG Hai-long1,YI Xing2,XIONG Hua1,*
(1. State Key Laboratory of Food Science and Technology, Sino-German Joint Research Institute, Nanchang University, Nanchang 330047, China;2. Jiangxi Sino-German Food Engineering Center, Nanchang 330047, China)
In order to maximize the extraction yield of polysaccharides from the seeds of adlay (Coix lachryma-jobi L. var. mayuen Stapf), an orthogonal array design L9(33) was applied to optimize the extraction conditions including raw material/ water as well as extraction temperature and duration, of which the effects on polysaccharide extraction yield were initially dealt with by single factor method. Finally, the extracted polysaccharides were purified on Sephadex G-75 gel column, and the chromatographic characteristics were investigated and purity identification was carried out. Material/water ratio of 1:15 (g/mL), extraction temperature of 100 ℃ and extraction time of 150 min were found optimal, and the extraction yield of polysaccharides was 5.53% under these optimal extraction conditions. The purified polysaccharides were analyzed by UV spectroscopy to contain neither protein nor nucleic acids.
coixan;orthogonal array design;extraction;isolation and purification
TS201.1
A
1002-6630(2010)22-0001-05
2010-06-28
国家“863”计划项目(2008AA10Z332);江西省科技厅2008年重点项目(2008S00594)
肖小年(1968—),女,教授,博士研究生,研究方向为天然产物与保键食品研发。E-mail:xiaonc@hotmail.com
*通信作者:熊华(1957—),男,教授,硕士,研究方向为天然产物与保健食品研发。E-mail:huaxiong100@hotmail.com

