Fe3O4-PSF磁性复合超滤膜分离麦冬多糖
谢慧明,李 超,潘 见,张仕发,伍志刚,朱莹莹
(合肥工业大学 农产品生物化工教育部工程研究中心,安徽 合肥 230009)
Fe3O4-PSF磁性复合超滤膜分离麦冬多糖
谢慧明,李 超,潘 见,张仕发,伍志刚,朱莹莹
(合肥工业大学 农产品生物化工教育部工程研究中心,安徽 合肥 230009)
以原位生成法制得Fe3O4-PSF(聚砜)磁性复合超滤膜。改变磁场强度和压力,以截留率为考察指标,确定膜截留分子质量为30000D和10000D时对应的值分别为0.1T、0.4MPa和0.8T、0.5MPa。对麦冬多糖提取液(含量为91.68%)进行连续性分离,并对分离后样品进行测定,GPC软件分析A、C、D 3样品结果:A样品Mw为32610D,分子质量30000D以上的麦冬多糖的含量85.6%;C样品Mw为24069,分子质量10000~30000D的麦冬多糖的含量达87.6%;D样品Mw为8664,分子质量1000~10000D的麦冬多糖含量达88.7%。
Fe3O4-PSF磁性复合超滤膜;麦冬多糖;连续性分离;超滤;高效凝胶液相色谱
麦冬多糖是从传统中药百合科植物麦冬中提取的一种活性多糖,药理作用主要集中在免疫活性、抗心肌缺血、降血糖、耐缺氧和抗过敏等方面[1],麦冬多糖的分子质量范围分布很广,不同分子质量大小和分子质量范围的麦冬多糖所具有的药理作用不同[2-4],例如,分子质量10000D以下的麦冬多糖可保护心肌细胞,同时有抑制心肌缺血造成的自由基生成增加和清除氧自由基的作用。因此,将麦冬多糖按分子质量大小分级分离,从麦冬提取液中得到不同分子质量范围的麦冬多糖,可以使其发挥自己本身的功效,提高麦冬多糖的经济价值。
超滤技术已广泛应用于食品、中药多糖分离等方面[3]。目前,在超滤膜的性能改进方面已做了大量的研究,其中合肥工业大学农产品生物化工教育部工程研究中心开发的Fe3O4-PSF磁性超滤膜[5]引起了人们广泛的兴趣,本实验拟采用自制的Fe3O4-PSF磁性复合超滤膜对麦冬多糖实现按分子质量大小连续性分离,并用高效凝胶液相色谱对分离结果进行测定。
1 材料与方法
1.1 材料、试剂与仪器
FeCl2·4H2O(AR) 上海山海工学团实验二厂;系列标准右旋糖酐对照品(Mw分别为5000、10000、20000、30000、40000D) 上海迅腾化学有限公司西南分公司;叠氮化钠、无水乙醇、氢氧化钠(均为分析纯)。
多功能膜分离设备、超滤系统 自制;UV1600紫外-可见分光光度计 北京瑞利分析仪器公司;1100型高效液相色谱仪、Shodex OHPak SB-803HQ凝胶色谱柱Agilent公司;聚砜(PSF)超滤膜(MW为40000D) 安得膜分离技术工程(北京)有限公司。
1.2 麦冬多糖提取液的制备
具体流程:麦冬粉碎,并用80%乙醇60℃回流提取6h,残渣烘干;将残渣用水提法提取,条件为料液比1:10(g/mL)、浸泡时间150min、提取温度90℃、提取180min;浓缩并过3层纱布,除去不溶性颗粒杂质,浓缩液用无水乙醇、丙酮、乙醚依次洗涤,除去蛋白和醇溶性杂质[6]。得麦冬多糖提取液。
1.3 Fe3O4-PSF磁性超滤膜的制备
采用原位生成法制备磁性复合膜[5]:以聚砜超滤膜(截留分子质量为40000D)为基体膜,将基体膜在无水乙醇溶液中浸润10min后置于自制的超滤膜制备装置中,反应器由聚砜超滤膜分隔为两部分,在膜两侧的容器中分别加入0.2mol/L的FeCl2乙醇溶液和2mol/L的NaOH水溶液(图1)。反应时,Fe2+和OH-沿聚砜超滤膜孔道相向扩散,在膜孔中反应生成Fe3O4磁性粒子,45min后停止反应,将复合膜取出,经洗涤、浸泡、干燥后即得Fe3O4-PSF磁性复合超滤膜,保存备用。

图1 Fe3O4-PSF磁性复合超滤膜的制备Fig.1 Schematic diagram for the reaction device used in this study for preparing Fe3O4-PSF magnetic composite ultrafiltration membrane
1.4 磁性复合膜截留分子质量的测定
由于生产的超滤膜总是有一个孔径分布,而且这个分布还相当宽,因此对任何标准分子质量基准物质的截留率都不可能达到100%,所以定义截留率为90%时能被膜截留的基准物质的分子质量为膜的截留分子质量[7]。本实验选择右旋糖酐作为基准物质,分子质量分别为5000、10000、20000、30000、40000D。
用自制的超滤膜对糖酐水溶液进行错流过滤,操作温度为25℃,压力0.15MPa。待流量稳定后,分别收集20mL的原液和滤液,采用紫外分光光度计在波长195nm处测定溶液的吸光度,然后据式(1)计算截留率[6]。

式中:R为截留率;C透为透过液浓度/(mol/L);C原为原料液浓度/(mol/L)。
根据朗伯-比尔定律A=abc(A为吸光度;a为摩尔吸光系数;b为液层厚度;c为溶液浓度),所以根据吸光度即可计算截留率,由此确定超滤膜的截留分子质量。
1.5 对应截留分子质量的压力、磁场强度值的确定
用超滤膜对右旋糖酐标准品(重均分子质量Mw分别为10000、30000D)水溶液进行错流过滤,改变压力大小和磁场强度两个因素,待流量稳定后,分别收集20mL原液和滤液,测定溶液的吸光度。然后据式(1)计算截留率。以对两个标准品的截留率为考察指标,确定膜截留分子质量在10000、30000D时对应的压力大小和磁场强度。
1.6 麦冬多糖的超滤分离
取按1.2节制备的麦冬多糖提取液1200mL,在25℃条件下,用磁性复合膜,改变压力、磁场强度将膜截留分子质量调至3 0 0 0 0 D,待稳定后进行反复超滤30min,分别截得截留液A和透过液B。将透过液B在同样的条件下,改变压力和磁场强度将膜截留分子质量调至10000D,待稳定后进行反复超滤30min。分别截得截留液C和透过液D。将截留液A、截留液C和透过液D进行减压浓缩,冷冻干燥,得3种分子质量分布范围的麦冬多糖产品。
1.7 分离后麦冬多糖分子质量的测定
1.7.1 标准曲线
色谱条件:色谱柱为Shodex OHPak SB-803HQ;流动相为质量分数0.71%硫酸钠溶液(内含质量分数0.02%叠氮钠);柱温35℃;流速0.5mL/min。
对照品溶液的制备[8-10]:取右旋糖酐标准品(重均分子质量Mw分别为5000、10000、20000、30000、40000D)适量,加流动相制成每1mL中约含10mg的溶液,振摇,室温放置过夜,作为供试品溶液,取系列对照品溶液分别进样,记录洗脱峰的保留时间,由GPC专用软件绘制标准曲线[11-13],以标准分子质量的对数值为纵坐标,以相应色谱峰的保留时间为横坐标进行线性回归,得标准曲线。
1.7.2 样品的测定
样品溶液的制备:取麦冬多糖适量,加流动相制成每1mL中约含10mg的溶液,振摇,室温放置过夜,作为供试样品溶液。进样,记录色谱图,根据供试品的保留时间,采用GPC专用软件计算样品各组分的重均
分子质量及其分子质量分布[14-16]。
2 结果与分析
2.1 麦冬多糖提取液的结果
苯酚-硫酸比色法[2]测定麦冬多糖提取液的浸膏中麦冬多糖的含量达91.68%。
2.2 Fe3O4-PSF磁性超滤膜的表征
按照参考文献[5]进行表征,按照1.4节对膜的截留分子质量进行测定,得出磁性复合膜的截留分子质量约为33000D。
2.3 对应截留分子质量的压力和磁场强度值的确定
2.3.1 膜截留分子质量为30000D对应压力和磁场强度的确定
2.3.1.1 压力对截留率的影响
采用单因素试验,选取磁场强度为0.1T,超滤压力分别为0.1、0.2、0.3、0.4、0.5、0.6MPa,考察磁性复合膜截留率的变化情况,结果如图2所示。当压力达到0.6MPa时,自制的的磁性复合膜出现破裂的现象。由图2可知,在0.1T条件下,随着压力的增加,截留率呈上升趋势,且在0.4MPa和0.5MPa条件下,膜的截留率为90.1%和91.2%,考虑到二者变化不是很大和磁性复合膜的耐压能力,故选取0.4MPa为膜截留分子质量30000D时的超滤压力。

图2 压力对截留率的影响Fig.2 Effect of ultrafiltration pressure on retention rate
2.3.1.2 磁场强度对截留率的影响
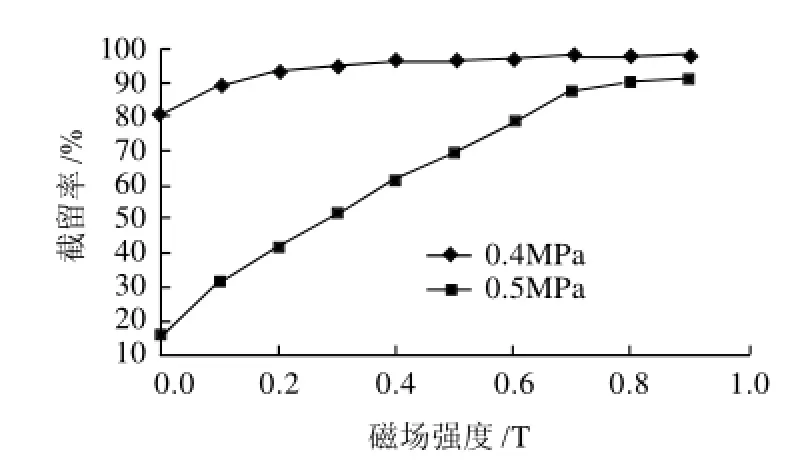
图3 磁场强度对截留率的影响Fig.3 Effect of magnetic intensity on retention rate
选择超滤压力为0.4MPa,在0~1.0T范围内改变磁场强度,考察磁性复合超滤膜截留率的变化,结果如图3所示。由图3可知,在0.4MPa条件下,由于膜孔径随着磁场的增大而减小[7],使其对30000D的基准物质的截留率逐渐增大,当磁场强度在0.1T时,截留率已经达到89.8%,所以选择0.1T为膜截留分子质量30000D时的磁场强度。
2.3.2 膜截留分子质量为10000D的压力、磁场强度的确定
2.3.2.1 压力对截留率的影响
采用单因素试验,选取磁场强度为0.7T,超滤压力分别为0.1、0.2、0.3、0.4、0.5MPa,考察磁性复合膜截留率的变化情况,结果如图2所示。由图2可知,在0.7T条件下,随着压力的增加,截留率呈上升趋势,且0.5MPa条件下,膜的截留率超过90%,故选取0.5MPa为膜截留分子质量10000D时的超滤压力。
2.3.2.2 磁场强度对截留率的影响
选择超滤压力为0.5MPa,在0~1.0T范围内改变磁场强度,考察磁性复合超滤膜截留率的变化,结果如图3所示。由图3可知:在0.5MPa条件下,随着磁场强度的增加,膜的截留率不断上升,当磁场强度增加到0.7T以后,上升幅度趋于平缓,且当在0.8T时为90.4%,所以选择0.8T为膜截留分子质量10000D时的磁场强度。
2.3.3 0.4MPa、0.1T和0.5MPa、0.8T条件下膜孔径的测定
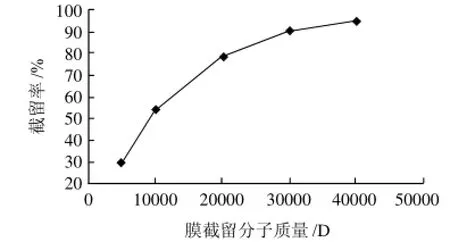
图4 在0.4MPa、0.1T条件下的膜截留分子质量测定Fig.4 Determination of membrane MWCO under the conditions of 0.4 MPa and 0.1 T
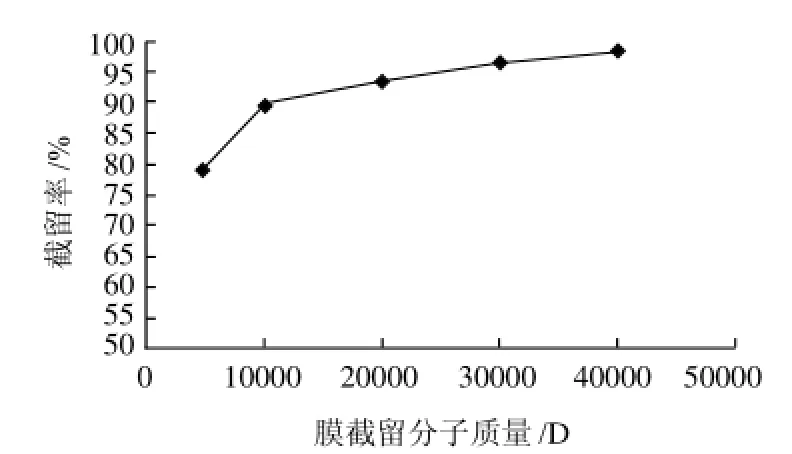
图5 在0.5MPa、0.8T条件下的膜截留分子质量测定Fig.5 Determination of membrane MWCO under the conditions of 0.5 MPa and 0.8 T
按照1.4节,分别在0.4MPa、0.1T和0.5MPa、0.8T条件下,对膜的截留分子质量进行测定结果如图4、5所示。
以截留率达到90%对应的分子质量定义为膜的截留分子质量。由图4可以看出,磁性复合膜的截留分子质量约为30000D,即膜截留分子质量为30000D时对应的压力和磁场强度分别为0.4MPa和0.1T。
同理,由图5可以看出,在0.5MPa、0.8T条件下,磁性复合膜的截留分子质量约为10000D,即膜截留分子质量为10000D时对应的压力和磁场强度分别约为0.5MPa和0.8T。
2.4 麦冬多糖的超滤分离结果
按1.6节操作,将压力和磁场强度调至0.4MPa、0.1T,对将1200mL(浸膏40g)原料液进行超滤分离后,得截留液A(浸膏14.12g)和透过液B(浸膏24.73g),将压力和磁场强度调至0.5MPa、0.8T,对B进行超滤分离后,得截留液C(浸膏5.50g)和透过液D(浸膏17.34g)。
2.5 分离产物分子质量的测定
2.5.1 标准曲线
以标准品的Mw的对数值为纵坐标,保留时间tR为横坐标,用GPC软件得到标准回归曲线:lg(Mw)= 6.9761-0.15tR,R=0.998。
2.5.2 样品的测定
采用高效凝胶色谱法测定超滤实验所得3种分离产物A、C和D的重均分子质量和分子质量累积分布曲线图。

表1 A、C、D 3样品的重均分子质量、数均分子质量和分布宽度测定结果Table1 Determination of Mw, Mn and Mw/Mn of three separated fractions
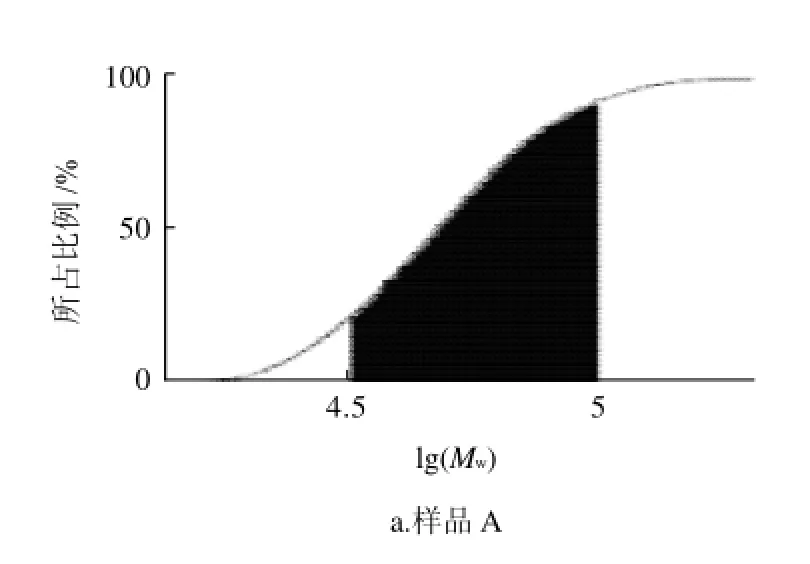

图6 各样品的分子质量累积分布曲线Fig.6 Cumulative weight distribution curve of fraction A, C and D
图6 显示:A样品中,重均分子质量平均值为32610D,分子质量分布宽度为1.52左右,从分子质量累积分布曲线可以得到,曲线与重均分子质量对数值在4.5~5下包含的面积(阴影部分)为85.6%,因此分子质量在30000~100000D之间的麦冬多糖的含量达85.6%。
C样品中,重均分子质量平均值为24069D,分子质量分布宽度为1.48,从分子质量累积分布曲线可以得到,重均分子质量对数值在4~4.5包含的面积(阴影部分)为87.2%,因此分子质量在10000~30000D之间的麦冬多糖的含量达到87.2%。
D样品中,重均分子质量平均值为8664D,分子质量分布宽度在1.42,重均分子质量对数值在3~4包含的面积(阴影部分)为88.7%,分子质量在1000~10000D之间的麦冬多糖含量达88.7%。
综上所述,应用一张磁性超滤膜,通过改变压力大小和磁场强度,可以较好的实现对麦冬多糖提取液按分子质量大小进行连续性分离。
3 结 论
以原位生成法制得磁性复合膜,对麦冬多糖进行超滤分离。以截留率为指标,通过改变磁场强度和超滤压力,确定了膜截留分子质量为30000D时对应的磁场强度为0.1T、超滤压力为0.4MPa;膜截留分子质量为10000D时对应的磁场强度为0.8T、超滤压力为0.5MPa。
对中药麦冬多糖溶液(纯度为91.68%)进行连续性分离,得到3种分离产物A、C和D。
采用高效凝胶色谱对样品进行测定,GPC分析结果得:A样品中,重均分子质量为32610D,分子质量在30000D以上的麦冬多糖的含量达85.6%;C样品中,重均分子质量为24069,分子质量在10000~30000D之间的麦冬多糖的含量达87.6%;D样品中,重均分子质量8664D,分子质量在1000~10000D之间的麦冬多糖含量达88.7%。
[1]齐建红, 陶贵荣, 郭新军, 等. 麦冬多糖的生物活性研究进展[J]. 西安文理学院学报: 自然科学版, 2008, 11(1): 44-46.
[2]李路军, 喻世涛, 李宇, 等. 超滤膜分离纯化山麦冬多糖的研究[J].湖北大学学报: 自然科学版, 2006, 28(3): 299-301.
[3]范俊, 张旭. 麦冬多糖药理研究进展[J]. 中医药学刊, 2006, 24(4): 626-627.
[4]韩凤梅, 刘春霞, 陈勇. 山麦冬多糖对免疫低下小鼠的保护作用[J].中国医药学报, 2004, 19(6): 347-348.
[5]潘见, 晋明会, 赵金龙, 等. Fe3O4/PSF磁性复合超滤膜的制备、表征及应用[J]. 膜科学与技术, 2009, 29(5): 39-43.
[6]王婷婷, 付超美, 罗维早. 麦冬粗多糖除蛋白工艺的优化研究[J]. 重庆中草药研究, 2007, 55(1): 14-17.
[7]PAN Jian, HE Yahui, Preparation of polysulfone-Fe3O4composite ultrafiltration membrane and its behavior in magnetic field[J]. Membrane Sci, 2006, 284: 9-16.
[8]TANSEL B, REGULA J, SHALEWITZ R. Treatment of fuel oil and crude oil contaminate waters by ultrafiltration membranes[J]. Desalination, 1995, 102: 301-311.
[9]张洪斌, 姚日生, 朱慧霞. 发酵法生产右旋糖酐的工艺研究[J]. 合肥工业大学学报, 2004, 27(7): 783-786.
[10]董晓蓉. 高效液相色谱法测定蔗糖铁注射液中蔗糖铁的分子量与分子量分布[J]. 药物鉴定, 2006, 15(4): 19-21.
[11]卢智玲, 林晓, 冯怡, 等. 高效凝胶色谱法测定大鼠血浆中麦冬多糖MDG-1的含量[J]. 中国药师, 2008, 11(7): 768-770.
[12]徐德生, 冯怡, 林晓, 等. 麦冬多糖MDG-1的分离纯化和结构分析[J]. 药学学报, 2005, 40(7): 636-639.
[13]徐晓霞, 李炎, 刘华, 等. 高效凝胶色谱法测定多花黄精多糖分子量与分子量分布[J]. 四川生理科学杂志, 2008, 30(3): 102-103.
[14]孙凌云, 范慧红. 高效凝胶渗透色谱法测定硫酸软骨素的分子量及其分布[J]. 中国生化药物杂志, 2001, 29(4): 195-196.
[15]耿安静, 陈健, 徐晓飞. GPC法测定香菇多糖的含量及相对分子质量[J]. 现代食品科技, 2009, 25(4): 458-460.
[16]姜素琴, 姜雄平. 高效凝胶色谱法测定云芝多糖的分子量及其分布[J]. 江苏药学与临床研究, 2002, 10(2): 17-19.
Using Fe3O4-PSF Magnetic Composite Ultrafiltration Membrane for the Separation of Ophiopogon japonicus Polysaccharides
XIE Hui-ming,LI Chao,PAN Jian,ZHANG Shi-fa,WU Zhi-gang,ZHU Ying-ying
(Engineering Research Center of Bio-process, Ministry of Education, Hefei University of Technology, Hefei 230009, China)
A Fe3O4-PSF magnetic composite ultrafiltration membrane with a molecular weight cutoff (MWCO) of 33000 D was obtained by in-situ generation method. The effects of magnetic intensity and ultrafiltration pressure on retention rate were dealt with under MWCOs of 30000 and 10000 D, and it was found that the optimal magnetic intensity and ultrafiltration pressure were 0.1 T and 0.4 MPa for 30000 D MWCO ultrafiltration and 0.8 T and 0.5 MPa for 10000 D MWCO ultrafiltration, respectively. The polysaccharide-rich extract from Ophiopogon japonicus prepared in this study was continuously separated using the two MWCOs, and the fractions (A, C and D) obtained were subjected to the determination of molecular weight based on the use of the GPC software. Fraction A exhibited a molecular weight of 32610 D, and contained 85.6% polysaccharides having a molecular weight exceeding 30000 D. The molecular weight of fraction C was 24069 D, and it contained as high as 87.6% polysaccharides having a molecular weight varying from 10000 to 30000 D. Fraction D had a molecular weight of 8664 D, and the content of polysaccharides having a molecular weight varying from 1000 to 10000 D in it was as high as 88.7%.
Fe3O4-PSF magnetic composite ultrafiltration membrane;Ophiopogon japonicus polysaccharide;continuous separation;utrafiltration;HPGPC
R284.2
A
1002-6630(2010)22-0041-05
2009-12-24
国家“863”计划项目(2007AA100404)
谢慧明(1955—),女,教授,硕士,研究方向为农产品加工及贮藏。E-mail:panxie@163.com

