脑出血水肿体积动态演变的探讨
闫乐卡 刘怀军 李剑颖 闫春明 曹会志 郎静芳
脑出血(intracerebral hemorrhage,ICH)的发病率、病死率和致残率都较高,是危害人类生命健康的主要疾病,其可引起多种继发病变,其中脑水肿是脑出血后二次损伤发生的关键性因素[1]。虽然影响脑出血结局的关键因素是血肿容积,然而脑水肿体积变化对脑出血患者的病情进展及预后的影响也不容忽视,本文就应用美国通用电器公司医疗系统集团公司设计的血肿体积测量软件对水肿体积的变化进行了动态评价。
1 资料与方法
1.1 一般资料 2007年2月至2008年7月河北医科大学第二医院收治的脑出血首诊患者201例,其中男110例,女91例;年龄39~92岁;平均年龄(57±12)岁。首次CT检查均于起病后6 h内进行。CT检查次数:3次107例,4次85例,5次及以上9例。脑出血部位在基底节区,均无血肿扩大发生。排除脑外伤、动脉瘤、动静脉畸形、肿瘤、抗凝治疗等出血原因。患者按首次出血量不同分为2组,A组112例,出血量为5~25 ml;B组89例,出血量为26~45 ml。
1.2 头颅CT检查 使用GE公司Lightspeed16排螺旋CT机,患者取仰卧位,头部固定,以OM线为基线,常规轴位平扫。扫描方式:螺旋扫描,转速 0.8 s/r,探测器 16 ×1.25,层厚:10 mm,电压 120 kV,电流 250 mA,螺距 0.938∶1,进床速度18.75 mm/r,准值宽度20 mm。使用GE16排螺旋CT机。
1.3 水肿体积测量 本研究使用由GE公司开发完成的血肿体积测量软件测量水肿的体积,该软件设计依据为由CT值阈值确定血肿或水肿范围并伪彩染色(图1、2)。
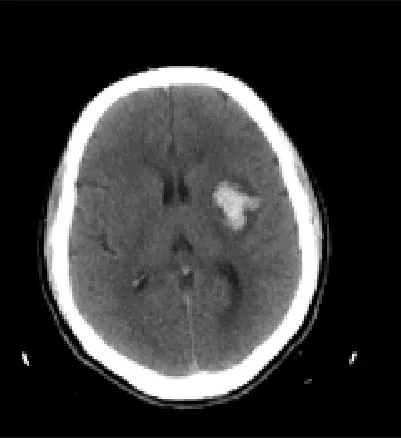
图1 左侧基底节脑出血
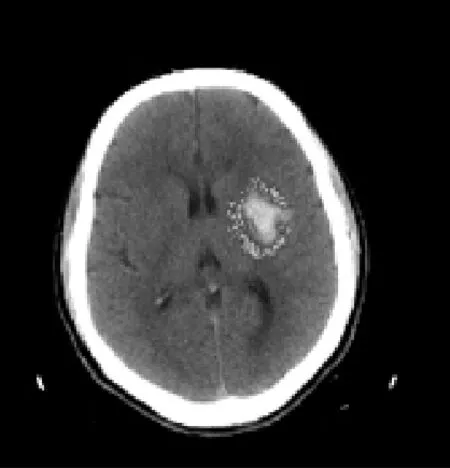
图2 脑出血水肿伪彩染色
血肿及水肿测量分为 Auto/Bi-Threshold/Manual三种可选择方法。适形性为本软件的突出特点,此外操作简单、快速,测量准确亦为其较其他水肿体积测量方法的优势所在,适于影像专业及临床对脑出血血肿及水肿体积的快速测量。使用该软件分别测量脑出血患者第1、3及7天脑出血水肿体积,计算第3天与第1天血肿体积差值及第7天与第3天血肿体积差值。
1.4 统计学分析应用SAS 8.0统计软件,计量资料以¯x±s表示,采用t检验,P<0.05为差异有统计学意义。
2 结果
脑出血水肿第1~3天增长率为67.50%,第3~7天增长率为25.64%。2组第3天与第1天血肿体积差值及第7天与第3天血肿体积差值差异有统计学意义(P<0.05),同组间比较水肿不同时期变化差异亦有统计学意义(P<0.05)。见表1。
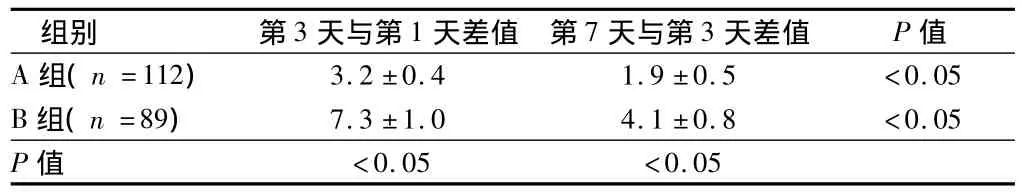
表1 2组水肿体积变化的比较ml,¯x±s
3 讨论
脑出血后水肿可导致脑组织结构改变和功能损伤,是脑出血患者病情恶化和死亡的主要原因。脑出血后水肿体积的测量方法报道较少,包括体视学法,多田公式测量法,然而这些方法或测量复杂,或对不规则水肿测量欠准确,这种情况下GE公司设计了血肿体积测量软件对水肿体积进行测量,该软件测量水肿体积是依据CT阈值来测量,适形性更是其突出的特点,测量更加准确。
脑出血后脑水肿的形成机制目前尚不十分明确,第1阶段是在超早期(6 h内)涉及到静水压和血块凝缩伴有血清挤出的阶段;第2阶段(出血后2 d内)是凝血反应的激活伴凝血酶的生成;终末阶段(3 d以后)是红细胞溶解伴血红蛋白诱导的神经损伤[2]。脑出血后脑水肿的形成参与因素复杂,包括:(1)占位效应;(2)缺血因素的影响;(3)凝血酶作用,,凝血酶不但可通过细胞毒作用直接损害神经细胞,还能破坏血脑屏障,在继发性脑水肿中,凝血酶可能起关键性作用[3];(4)血红蛋白、血浆蛋白6、炎性细胞因子和补体系统,炎性细胞因子可增加血脑屏障的通透性并引起脑水肿,补体系统参与了细胞分解和炎性反应等各种免疫反应[2]。其他因素还包括出血后细胞凋亡,血管活性物质的影响等。本文显示,血肿越大,脑出血灶周水肿体积增大越明显,此现象说明占位效应在早期脑水肿的形成中起一定的作用,但多数学者认为脑出血的物理压迫不是脑水肿的直接原因,而是通过局部脑血流的下降及局部组织压力的增加触发受损脑组织释放血管活性物质,破坏血脑屏障,引起水肿。血肿越大,引起局部缺血的作用越强,水肿也越明显。
关于脑水肿的变化规律,多数学者认为,脑出血3 h后出现脑水肿,12 h达中等程度,24 h达重度水肿,并在第2天达高峰[4],动物实验也证实这一结论[5]。本研究同组间比较发现1~3 d血肿体积增大较3~7 d快,这与文献报道相符。由于血肿压迫临近脑组织,所致局部组织压力的增加进一步减少血液循环,血管自身调节功能障碍,导致血肿周围脑组织水肿,局部坏死,进一步加重神经组织的继发性损伤[6]。同时脑血流量的减少、局部组织压力的增加都可以触发血管活性胺从受损的脑组织中释放,破坏血脑屏障,引起脑水肿。
本文通过对脑水肿体积的动态观察发现,水肿体积变化程度与初始出血量相关,出血量大则水肿增长快。脑水肿在出血后3 d内体积增大明显,临床医师在脑出血后临床监测中应注意这一点。
1 王涤.早期预测脑出血后继续出血的因素及早期治疗干预.河北医药,2010,32:169-170.
2 Xi G,Keep RF,Hoff JT.Mechanisms of brain injury after intracerebral haemorrhage.Lancel Neurol,2006,5:53-63.
3 江汉秋,刘群,刘瑾,等.凝血酶对大鼠脑内 MMP2-9、MMP2-2表达的影响.中风与神经疾病杂志,2006,23:75-77.
4 蒋辉华,包仕尧,邵国富,等.大鼠脑出血后脑水肿形成特点的研究.中国临床神经科学,2002,10:143-144.
5 Kvin R,Lee KR,Kawai N,et al.Mechanisms of edema formation after intracerebral hemorrhage:effets of thrombin on cerebral blood flow,blood brain barrier permeability and cell survival in rat model.Neurosurg,1997,86:272-278.
6 黄德玫,尹智.体温控制对高血压性脑出血术后患者预后的影响.中国全科医学,2009,12:1846-1848.

