胸腺切除术后应用免疫抑制剂治疗重症肌无力的分析研究
乞国艳 郑旭光 杨红 郄春菊 张太明 刘慈 顾姗姗
重症肌无力(myasthenia gravis,MG)是神经肌肉接头处传递功能障碍的疾病,是由乙酰胆碱受体抗体介导、T细胞依赖、补体参与的自身免疫性疾病,细胞免疫免疫调节异常是本病的重要的发病机制之一[1,2]。我们利用流式细胞仪检测2组MG患者的外周血T细胞亚群CD+4CD+25Tr细胞的百分率和乙酰胆碱受体抗体(AchR-Ab)浓度,动态观察2组在治疗前和治疗后6个月的变化,应用许氏临床评分法[3]观察MG患者病情严重程度和评价临床疗效,以探讨MG患者细胞免疫和免疫调节的变化及其与临床疗效的相互关系。
1 资料与方法
1.1 一般资料 选择2004年11月到2009年11月入住我院的MG患者69例,均根据典型的临床表现、新斯的明试验阳性和肌电图确诊MG;并进行有关检查排除了并发甲状腺功能亢进症等其他自身免疫性疾病。随机分为A、B 2组,A组34例,B组35例。2组患者一般情况差异无统计学意义(P>0.05)。见表1。
表1 2组一般情况比较¯x±s
1.2 方法
1.2.1 临床治疗方法:A组先行胸腺切除,切除后1个月左右应用甲基泼尼松龙(15~20 mg/kg)冲击治疗,逐渐递减方式,伍用硫唑嘌呤2 mg/kg和补中益气中药口服。B组胸腺切除术后未用免疫抑制剂,只给予抗胆碱酯酶剂和补中益气中药口服。应用许氏临床评分法[1]观察2组病情严重程度和评价临床疗效。
1.2.2 标本采集与方法
1.2.2.2 乙酰胆碱受体抗体检测定方法:酶联免疫吸附法①包被:用α-银环蛇毒素(1 mg/ml)10 μl+包被液 10 ml,每孔100μl,24 h 4℃保存,PBS-T洗3次,每次3 min。②加入乙酰胆碱受体:每支乙酰胆碱受体干粉加蒸馏水0.4 ml混匀。再1∶100稀释备用。10 μl(1∶10 R)+10 ml PBS-T混匀,每孔100μl,37℃ 1 h。PBS-T洗3次,每次3 min。③血清及乙酰胆碱受体抗体工作标准:患者血清或倍倍稀释的乙酰胆碱受体抗体工作标准夜,每孔100μl,37℃ 30 min,PBS液洗3次,每次3 min。④结合物:辣银过氧化物酶标记的羊抗人LgG结合物,每支溶于0.5 ml蒸馏水中。取其溶解物30μl结合物加15 ml PBS-T 混匀,每孔每孔100 μl,37℃ 30 min,PBS液洗3 次,每次3 min。⑤ 底物:邻苯二胺4 mg+底物缓冲液10 ml+3%过氧化氢15μl(用时现配每孔100μl,暗处37℃ 5 min。⑥终止2 mol/L H2SO4,每孔50μl。⑦测定OD值490 nm波长下测定OD值。
1.2.3 临床计分及疗效判定:分别在2组治疗前、后6个月应用绝对计分法记录MG患者受累肌群肌无力和易疲劳的严重程度,用临床相对计分法来做病情的比较和疗效判定。临床相对计分=(治疗前临床绝对计分-治疗后绝对积分)/治疗前临床绝对计分 ×100%[1]。痊愈:95% ~100%;基本痊愈:80% ~94%;显效:50% ~79%;好转:25% ~49%;无效:0。
1.3 统计学分析 应用SAS 8.0统计软件,经正态及方差齐性检验后,计量资料以¯x±s表示,采用独立样本的t检验,临床疗效比较采用秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 治疗后6个月2组CD+4CD+25Tr细胞百分率和AchR-Ab浓度比较差异有统计学意义(P<0.01)。见表2。
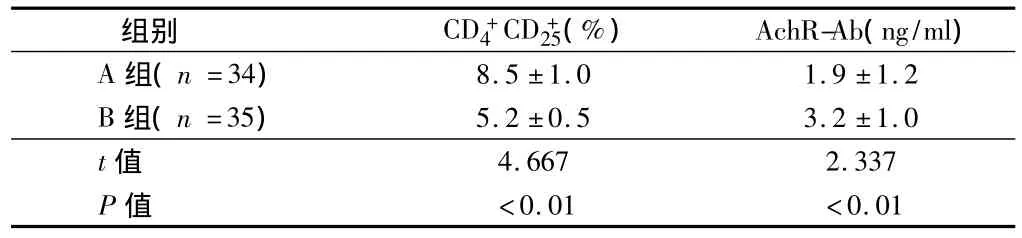
表2 2组免疫抑制剂治疗后6个月CD+4 CD+25 Tr细胞百分率和AchR-Ab浓度变化比较¯x±s
2.2 A组 相对积分在50%以上的患者32例,占总人数94.1%;50%以下的患者2例占5.9%。B组:相对积分在50%以上的患者20例,占总人数57.1%,50%以下的患者15例占42.9%。2组比较差异有统计学意义(P<0.05)。见表3。

表3 2组治疗后6个月临床疗效比较 例(%)
3 讨论
MG是一种影响神经肌肉接头传递的自身免疫性疾病,其确切的发病机制目前仍不明确,但是有关该病的研究还是很多的,其中,研究最多的是有关MG与胸腺的关系,以及乙酰胆碱受体抗体在MG中的作用,MG患者神经肌肉接头处突触后膜上的乙酰胆碱受体(AchR)数目减少,受体部位存在抗AchR抗体,且突触后膜上有IgG和C3复合物的沉积。并且证明,血清中的抗AchR抗体的增高和突触后膜上的沉积所引起的有效的AchR数目的减少,是MG发生的主要原因[1]。而胸腺是AchR抗体产生的主要场所,因此,MG的发生一般与胸腺有密切的关系。胸腺来源的调节性CD+4CD+25Tr(调节性)细胞数目或功能的异常是MG发生的扳机。几乎所有的MG患者有胸腺异常(>90%),而CD+4C+25T(Tr)细胞由胸腺产生后输出至外周,并通过主动调节(dominant regulation)的方式抑制存在于正常机体内潜在的自身反应性T细胞的活化与增殖,从而防止自身免疫性疾病的发生[3]。研究提示,CD+4C+25Tr细胞的数量减少或功能异常均有可能导致自身免疫病的发生[4]。本研究2组在治疗后6个月CD+4CD+25Tr细胞百分率、AchR-Ab浓度和临床缓解率差异有统计学意义(P<0.01),说明MG患者胸腺切除术后应用免疫抑制剂治疗6个月AchR-Ab浓度明显低于未用免疫抑制剂组,CD+4CD+25Tr细胞百分率和临床缓解率明显高于未用免疫抑制剂组。因此,当机体接受外来致病因子的侵袭时,抑制性CD+4CD+25Tr细胞和致病性CD+4CD-25Tr的比例将决定自身免疫反应的起始、程度和病程[5]。对于病情未能很好控制的MG患者来说,因其体内不能产生足够量的CD+4CD+25Tr细胞来抑制大量激活的自身反应性T细胞,AchR-Ab产生增多,疾病就迁延、加重、以至恶化;而当机体能产生足够量的CD+4CD+25Tr细胞来对抗自身反应性T细胞时,AchR-Ab产生减少,MG病情就趋于稳定或缓解[6]。
1 龚非力主编.医学免疫学.第1版.北京:科学出版社,2005.1-4,164-168.
2 乞国艳,张献波,郑旭光,等.重症肌无力胸腺切除术后复发放射治疗12 例.河北医药,2009,31:3282.
3 许贤豪主编.肌无力.第1版.北京:中国协和医科大学出版社,2003.24-120.
4 李吕力,李晓峰.重症肌无力的免疫发病机制及治疗进展.广西医学,2008,30:858-861.
5 Balandina A,lecart S,Dartevelle P,et al.Functional defect of regulatory CD4+CD25 Tcells In the thymus of patientswith aubinmune myasthenia gravis.Blood,2005,102:73-74.
6 Shere K,Bedlack RS,Simel DL.Does this patient have myasthenia gravis.JAMA,2005,293:1906-1914.

