哮喘患者检测痰中基质金属蛋白酶的临床意义
肖可为,辛晓峰,刘雪梅,何宏伟
支气管哮喘(哮喘)为慢性气道炎症性疾病,气道炎症导致气道的重塑。正常情况下细胞外基质(ECM)处于合成与降解的动态平衡之中。基质金属蛋白酶(MMP)是由20多种锌、钙离子依赖性蛋白内切酶所组成,能降解所有ECM蛋白成分。在炎症状态下炎性细胞和结构细胞表达MMP明显增强。基质金属蛋白酶抑制剂(TIMP)抑制MMP的活化,促进ECM沉积和抑制其降解。目前认为MMP/TIMP失衡可能是ECM合成增多、降解减少的主要原因。支气管哮喘上皮下胶原的大量沉积是气流受限的重要原因[1]。我们的研究主要探讨哮喘患者诱导痰中MMP-9和TIMP-1水平的变化是否与气道炎症和气道受限有关。
1 资料与方法
1.1 一般资料 哮喘组:缓解期哮喘患者16例,男10例,女6例,平均年龄(46±10)岁。诊断符合中华医学会呼吸病学分会2003年的哮喘诊断标准[2]。哮喘病程10 ~30年。所有哮喘患者均不吸烟,近1个月内无哮喘严重发作,近2个月内未吸入糖皮质激素(简称激素)或口服激素。茶碱在进入本研究前至少已停用48 h。健康对照组:12名,男9名,女3名,平均年龄(48±9)岁,均为门诊体检的健康志愿者,无呼吸道疾病史,近1个月内无呼吸道感染,均不吸烟,肺功能在正常范围内。
1.2 方法
1.2.1 痰液诱导和处理 患者早晨禁食,痰诱导前所有受试者均行第一秒用力呼气容积 (FEV1)、FEV1/FVC(用力肺活量)检查,然后吸入沙丁胺醇200 μg,10 min后通过压缩雾化吸入装置(BOY 037,德国百瑞公司)喷射雾化吸入3%氯化钠溶液20 min。在实验过程中鼓励患者咳嗽,间断中止吸入氯化钠液以便咳出痰液至50 m l无菌瓶中。若在上述过程中受试者出现喘息、严重咳嗽或呼吸困难,或FEV1下降>20%则随时停止痰液诱导。排痰前用生理盐水冲洗口腔,以减少唾液对痰液的污染。
确定所收集的痰液标本的体积,加入2倍体积的0.1%二硫苏糖醇(DTT)。然后轻轻将标本摇匀,放在37℃的水浴中孵育30 min,震荡15 min以便充分均匀,取少许(约50 μl)进行细胞计数。再加等体积的磷酸盐缓冲液(PPS)混匀,以800 r/min(离心半径15 cm)离心15 min,从细胞团中分离出上清液。将细胞团涂片,以瑞氏染色加等量PPS缓冲液3 ~5 min。用清水冲净晾干后镜检,光镜下分类计数。在油镜下每张涂片共计数400个非鳞状上皮细胞并进行炎性细胞的分类计数。吸出上清液以2000 r/min(离心半径15 cm)离心10 min后,弃沉淀留取上清液并冷冻于-20℃待检。
1.2.2 诱导痰上清液中IL-4、MMP-9、TIMP-1浓度测定 用酶联免疫吸附试验(ELISA)对诱导痰上清液中的IL-4、MMP-9、TIMP-1 浓度进行检测。IL-4试剂盒为深圳炬英公司进口分装 (批号:H0061801), MMP-9 和 TIMP-1 试剂盒购自美国R&D公司(批号分别为209622、231949),按照试剂盒的说明书进行操作。
1.3 统计学处理 采用SPSS11.0统计软件。实验数据以±s表示,行配对t检验,P<0.05则表示组间差异有统计学意义;用直线相关性分析两变量间的相关关系。
2 结 果
2.1 两组受试者肺功能测定和诱导痰中细胞总数、分类计数比较 见表1、表2。
表1 两组受试者肺功能比较±s)

表1 两组受试者肺功能比较±s)
注:与对照组比较, a P<0.05
组别 例数 平均(岁年)龄预F计E值V1 (占%)FEV(%1/F)VC哮喘组 16 46±10 68±10a 71±9a对照组 12 48±9 96±15 82±6
表2 两组受试者诱导痰中细胞总数、分类计数比较±s)
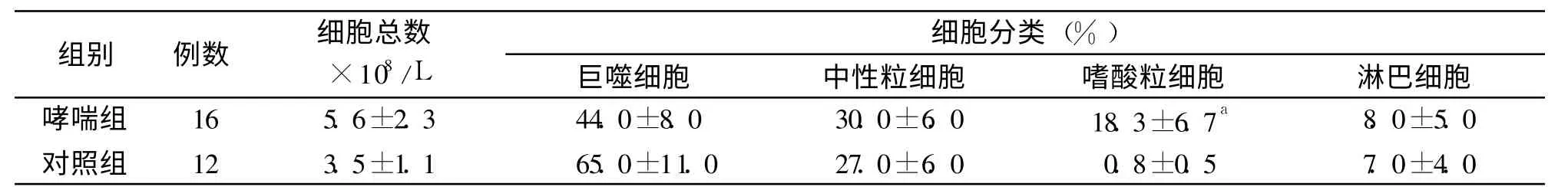
表2 两组受试者诱导痰中细胞总数、分类计数比较±s)
注:与对照组比较, a P<0.05
组别 例数 细×胞1总08/数L巨噬细胞 中性粒细细胞胞 分类(%嗜)酸粒细胞 淋巴细胞哮喘组 16 5.6±2.3 44.0±8.0 30.0±6.0 18.3±6.7a 8.0±5.0对照组 12 3.5±1.1 65.0±11.0 27.0±6.0 0.8±0.5 7.0±4.0
2.2 两组受试者诱导痰中MMP-9和TIMP-1浓度变化及其与肺功能关系 哮喘组诱导痰中MMP-9和 TIMP-1浓度与健康对照组比较,差异有统计学意义(见表 3)。其比值哮喘组与健康对照组比较,差异有统计学意义(P<0.05),且与FEV1占预计值呈正相关(r分别为 0.55、0.62,P均 <0.05)。
表3 两组受试者诱导痰中MMP-9和TIMP-1浓度比较±s)

表3 两组受试者诱导痰中MMP-9和TIMP-1浓度比较±s)
注:与对照组比较, a P<0.05
组别 例数 MMP-9(g/L)TIMP-1(g/L)MMP-9/TIMP-1哮喘组 16 15.8±6.0a 19.7±8.5a 0.9±0.7a对照组 12 1.9±1.2 1.3±0.8 1.6±0.5
3 讨 论
巨噬细胞、嗜酸粒细胞和中性粒细胞等炎性细胞是MMP-9 的主要来源, 作为MMP-9 特异性抑制物的TIMP-1, 也常由分泌 MMP-9 的炎症细胞分泌。本研究结果表明, 与健康对照组比较,未经治疗的哮喘患者诱导痰中MMP-9 和TIMP-1水平明显增加, 同时诱导痰中嗜酸粒细胞数也增加明显。研究表明, 哮喘患者诱导痰中增高的MMP-9浓度与嗜酸粒细胞数相关, 提示在哮喘患者嗜酸粒细胞是MMP-9的主要来源;也有研究资料显示MMP-9还可促进哮喘患者嗜酸粒细胞的浸润[3]。
气道重塑是机体对气道炎症损伤过程中的一种修复反应,但修复后的组织结构和功能均与正常组织不同。哮喘患者气道重塑时的结构变化主要是以ECM重塑为特征,不同于慢性阻塞性肺疾病(COPD)是由于胶原沉积,导致气道壁的增厚加剧气道的狭窄,对气流受限的功能性变化产生重要影响[4]。哮喘时胶原的沉积主要局限在上皮基底膜下,形成富含纤维胶原的致密层,在气道壁的过度沉积[1],从而形成气道重塑,进而导致肺功能下降。
此外,本组资料显示:哮喘患者中TIMP-1浓度和MMP-9/TIMP-1比值与气流受限间的相关性,提示MMP-9/TIMP-1间的失平衡对气流受限产生重要作用,且可能是由于胶原的沉积和气道壁的增厚所致。有研究资料表明,哮喘和 COPD患者痰液中MMP-9和TIMP-1间的失平衡与在高分辨率CT扫描下所测得的气管壁结构的改变有关[5]。这进一步说明了MMP-9和TIMP-1间的失平衡与气道重塑的关系。对于MMP-9 和TIMP-1与气流受限的关系,从目前的研究结果来看各有所不同。对经过变应原刺激后6 h哮喘患者测定肺功能与诱导痰中MMP-9和TIMP-1水平,发现MMP-9 与FEV1呈负相关[6]。Bosse等[7]和Bergeron等[8]发现哮喘患者血清中MMP-9/TIMP-1比值与口服激素后FEV1变异值呈正相关,但TIMP-1水平与FEV1变异值无相关性。本研究结果与其他研究结果的不相一致,可能与受试者病情存在差异及MMP-9和TIMP-1的来源、测定时间不同有关。
[1] Demedts IK, Brusselle GG, Bracke KR, et al.Matrixmetalloproteinases in asthma and COPD[J].Curr Opin Pharmacol, 2005,5(6):257-263.
[2] 中华医学会呼吸病学分会哮喘学组.支气管哮喘防治指南(支气管哮喘的定义、诊断、治疗及教育和管理方案)[J].中华结核和呼吸杂志,2003,26(2):132-138.
[3] Han Z, Jun X, Zhong N.Expression ofmatrixmetalloproteinases MMP-9 within the airways in asthma[J].Respir Med, 2003,97(9):563-567.
[4] 王秀丽,李淑兰.诱导痰与呼吸系统疾病[J].临床内科杂志,2008,25(8):574-576.
[5] Matsmoto H,Niimi A,Takemura M,et al.Relationship of airway wall thickening to an imbalance betweenmatrixmetalloproteinase-9 and its inhibitor in asthma[J].Thorax,2005,60(12):277-281.
[6] Lee KS, Jin SM, Lee H, et al.Imbalance betweenmatrixmetalloproteinase-9 and tissue inhibitor ofmetalloproteinase-1 in toluene diisocyanate-induced asthma[J].Clin Exp Allergy, 2004, 34(5):276-284.
[7] Bosse M, Chakir J, Rouabhia M, et al.Serum matrixmetalloproteinase-9:tissue inhibitor of metalloproteinase-1 ratio correlates with steroid responsiveness inmoderate to severe asthma[J].Am J Respir Crit Care Med,1999,159(6):596-602.
[8] Bergeron C, Page N, Barbeau B, et al.Interleukin-4 promotes airway remodeling in asthma:regulation of procollagen I(alpha1)gene by interleukin-4[J].Chest, 2003,123(3 Suppl):424S.

