耐三唑类杀菌剂木霉突变体TUV-13遗传稳定性的研究
安哲宇,梁志怀,魏 林,,罗秀娟,陈玉荣
(1.中南大学研究生院隆平分院,湖南 长沙 410125;2.湖南省植物保护研究所,湖南 长沙 410125)
木霉(Trichoderma.spp)作为多种植物病原菌的寄生菌和拮抗菌,是重要的生防因子之一。但野生木霉菌易受外界环境以及化学农药的影响,其生防效果不稳定。因此,选育对环境适性高,特别是对化学农药抗性高的优良菌株成为植病生防木霉菌在田间广泛应用需要解决的重要问题。20世纪80年代,诱变育种开始用于优良木霉菌选育,并获得了一些对化学杀菌剂具有一定抗性且仍保持高拮抗活性的木霉突变型菌株[1-2]。但田间防治是一个长期、动态的过程,保证木霉抗性性状的稳定对提高生防制剂防治效果,减少化学农药的使用量有重大意义。
试验利用紫外诱变这一简单有效的菌株改良技术,对拮抗性优良的野生木霉菌株T2-16进行遗传改造,选育出一株对三唑类杀菌剂具有一定耐药性的突变体TUV-13。相较于原始菌株,其对腈菌唑抗性提高10倍。测定该突变体多代的抗药性及其对病原菌的拮抗性,以确定其抗药性与病原菌拮抗性的遗传稳定性,以期为生防木霉菌的大田应用提供理论依据。
1 材料与方法
1.1 供试木霉菌菌株、植物病原菌和化学杀菌剂
供试菌株:哈茨木霉(T.harzianum)菌株T2-16,TUV-13均由实验室自行提供。供试水稻纹枯病菌(Rhizoctonia solani)、鱼腥草白绢病菌(Sclerotium rolfsii)、水稻恶苗病菌(Fusarium moniliforme)均分离自田间发病株。
供试水稻:杂交水稻金优402,由湖南隆平种业有限公司提供。挑选大小、饱满程度基本一致的种子进行试验。
供试药剂:95%腈菌唑原药,山东中农联合生物科技有限公司生产。将供试药剂用灭菌双蒸水溶解,配制成1%母液供试。
1.2 耐药性突变体TUV-13遗传稳定性测定
1.2.1 突变体的继代培养 将TUV-13菌株接种到PDA培养基上于25℃条件下培养,每隔7 d挑取菌落边缘成熟孢子转接一次,连续转接20次。分别取转接的第5次、第10次和第20次的培养物供试。
1.2.2 TUV-13各代菌株对腈菌唑抗性的测定采用菌丝生长速率法进行抗药性的测定[3-4]。用浓度梯度法测定供试药剂对培养的木霉突变体TUV-13及其继代的毒力。将供试药剂配制成浓度分别为10.0、20.0、40.0、80.0、160.0 mg/L 的含药平板。将木霉菌菌饼接种于含药平板正中,28℃下培养。木霉菌丝生长抑制率参照公式(1)进行计算。

设置T2-16菌株为对照组。记录其生长势的变化,并计算其EC50值。每组设置4个重复。
1.3 在水稻体内定殖后TUV-13抗药性的测定
对采用TUV-13菌株浸种处理组与无菌水浸种对照组的水稻幼苗进行内生菌分离[4]。供试野生木霉菌株对腈菌唑高度敏感,在腈菌唑浓度大于80.0mg/L的药剂浓度胁迫下完全不生长,因此以含腈菌唑浓度为100.0 mg/L的含药平板作为再分离木霉菌株培养基。从浸种处理组分离获得的木霉菌株培养性状与TUV-13完全相同,而对照组未分离获得内生木霉,可确定处理组分离获得的木霉菌株即为TUV-13菌株。将分离获得的TUV-13菌株转于不含药的PDA平板上纯培3 d,然后进行抗药性测定。
1.4 各代TUV-13菌株基因组RAPD分析
1.4.1 木霉菌DNA的提取 将各代TUV-13菌株与T2-16菌株的孢子分别接于PDS培养基,28℃150 r/min,振荡培养4 d。用真空泵抽滤发酵液,将获得的液培菌丝体以灭菌水反复清洗干净,45℃烘干后,采用改进的CTAB法提取总DNA[5]。获得的DNA沉淀用70%乙醇清洗两次,吹干后溶于50μL的TE(10mmol/L Tris-HCl,1 mmol/L EDTA,pH 8.0)中,并以0.8%琼脂糖凝胶电泳检测基因组DNA的完整性。
1.4.2 RAPD分析 RAPD实验参见吴海云等[6-8]的方法,在实验前,优化了扩增和电泳条件,并从50对随机引物(购自上海生工)中初步筛选出对全部DNA样品均有清晰、稳定扩增产物且重复性好的10条引物(参见表1),再根据扩增条带数量对引物作进一步筛选。PCR扩增反应总体积为25μL,包括 10×PCR 缓冲液 2.5 μL,10 mmol/L dNTP 2.0 μL,5 U/μL Tag酶 0.5 μL,10 μmol/L随机引物 1.0 μL,1.0 μL 模板 DNA(约为 50 ng),灭菌双蒸水补足25μL。反应程序为95℃预变性5min,94℃变性30 s,37℃退火30 s,72℃延伸60 s;35个循环,72℃延伸10min。扩增产物在1×TAE电泳缓冲液中用3%琼脂糖凝胶电泳,稳压80 V电泳2 h。紫外检测仪观察,记录条带数据。对于不同样本同一引物所扩增出的RAPD带,在同一电泳迁移位置上,有扩增条带的记为1,没有出现扩增条带的记为0。统计结果以NTSYS 2.10 e处理,构建聚类树。
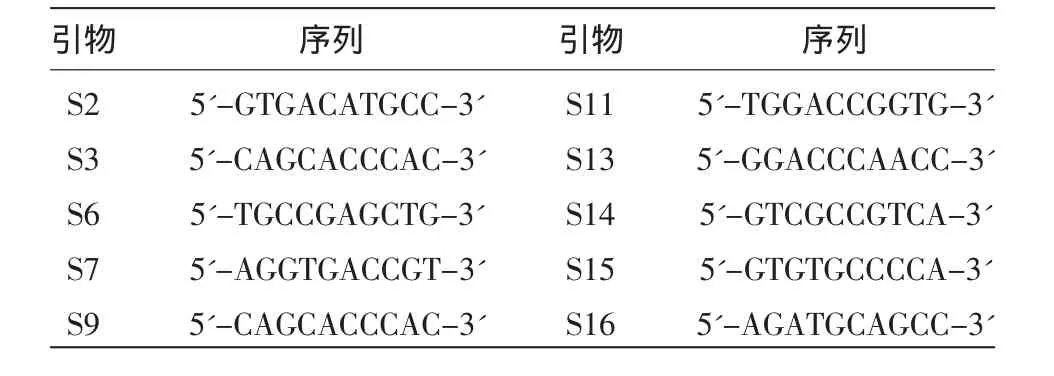
表1 随机引物及其序列
1.5 各代TUV-13菌株对病原菌的拮抗作用
采用对峙平板法测定各代菌株对水稻纹枯病(R.solani),鱼腥草白绢病(S.rolfsii),水稻恶苗病(F.moniliforme)的拮抗作用[9]。以水稻分离菌株和T2-16为对照。每组设置4个重复。
2 结果与分析
2.1 各代TUV-13菌株对腈菌唑抗性的测定
木霉菌株TUV-13各个转代对腈菌唑的耐药性见表2。结果显示,TUV-13菌株各个转代对三唑酮的抗药性均显著高于原始出发菌株T2-16,EC50是T2-16的10倍。且其抗药性在不同世代间的变化极小,总体保持稳定。结果表明,获得的木霉菌突变体对腈菌唑抗性并不随着世代交替而减弱或者消失。
2.2 TUV-13在水稻体内定殖后的抗药性测定
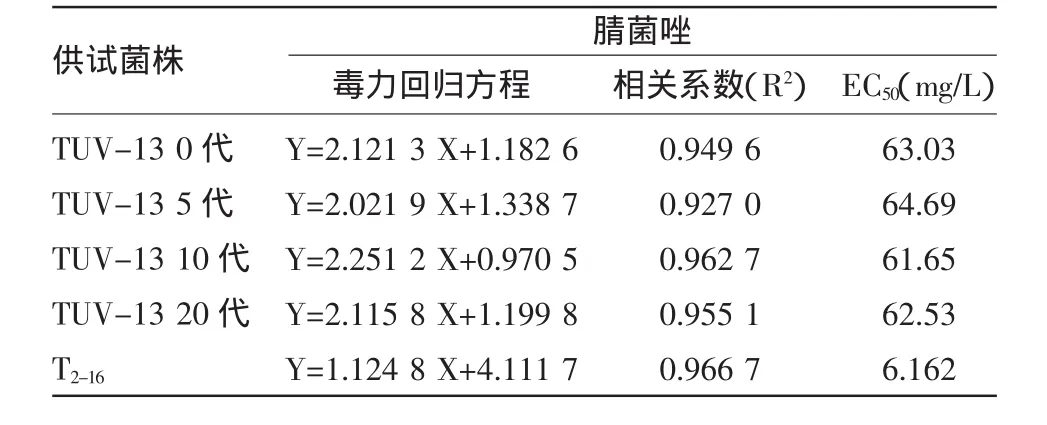
表2 各代诱变菌株TUV-13与原始菌株T2-16对腈菌唑的抗性比较
从水稻植株中分离到的木霉菌株TUV-13对腈菌唑的耐药性见表3。结果显示,从水稻植株分离得到的TUV-13菌株对腈菌唑的抗药性同样显著高于原始出发菌株T2-16,并与TUV-13的抗性保持一致。这表明,获得的木霉菌突变体对腈菌唑抗性并不因木霉在植物体内内生定殖而改变或者消失。

表3 水稻分离诱变菌株TUV-13与原始菌株T2-16对对腈菌唑的抗性比较
2.3 各代TUV-13菌株基因组RAPD分析
将原始菌株T2-16和TUV-13各世代菌株用对原始菌株多态性较好的4个引物S6,S11,S14,S16进行RAPD扩增。扩增出的DNA片段大小分布在100~750 bp之间,检测到条带位点数共53条,其中有5条为多态性带,占总数的9.43%。这表明供试木霉菌株间虽然亲缘关系极为接近,但仍存在着一定的遗传多态性,利用RAPD标记能从DNA水平上检测到这些差异(见图1)。
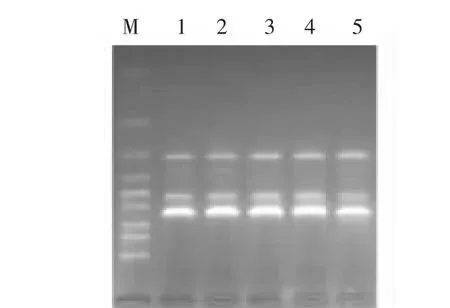
图1 木霉菌T2-16与TUV-13突变体各世代RAPD-PCR图谱比较(引物:S6)
对RAPD结果利用CHAN法进行聚类分析,结果如图2所示。所有样品之间的遗传距离介于0.00~0.09之间,表明经过诱变处理后,供试木霉菌株间遗传基因表现出一定改变。其中TUV-13的0代,5代,10代,20代三个世代(即图 1中的1,2,3,4泳道)菌株间并无差异,但与原始菌株 T2-16相比(图1中的5),表现出了微小的遗传差异性,遗传距离有0.09。这说明通过紫外诱变,木霉菌株保留了原始菌株的大部分基因性状,但变异菌株与原始菌株在基因组上仍存在差异性,且此差异性是能够稳定遗传的。结合菌株对腈菌唑抗性测定的结果,这个基因组上差异极有可能是导致突变株抗性提高且能够稳定遗传的原因。
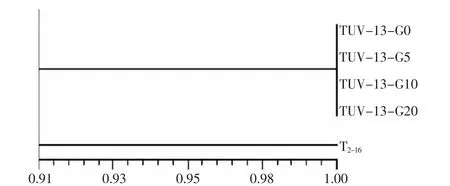
图2 木霉菌株突变体各世代与TUV-13出发菌T2-16RAPD聚类分析
2.4 各代TUV-13菌株对病原菌的拮抗作用
各代TUV-13菌株对供试病原菌的抑菌活性,与出发菌株相比,均未有显著变化。并且所有诱变木霉菌株和出发菌株对水稻纹枯病菌均表现出重寄生作用,其基质占领竞争力相对较差;而对其它两种病原菌则均主要表现为竞争占领优势。从水稻中分离出TUV-13菌株的抑菌活性略有下降,这可能是由于培养条件的剧烈改变而引起的暂时性现象。实验结果表明,诱变菌株TUV-13对植物病原菌的拮抗能力未由于诱变和多代培养而丧失。
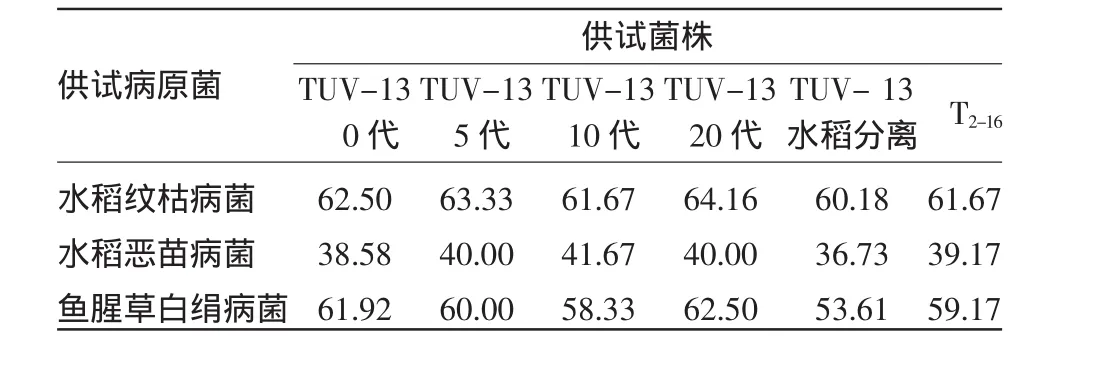
表4 各代TUV-13菌株对病原菌的抑制率 (%)
3 讨论
利用绿色生物农药进行田间防治是推动无公害农业生产发展的一种重要手段。木霉菌作为重要的生防因子,能够保持耐药性状的稳定性,对生物防治病原菌,减少化学农药在田间的施用,有着积极的意义。
根据梁志怀等的研究[4-10],木霉菌不仅对多种植物病害有较好的防治效果,而且对水稻种子萌发和苗期生长有良好的促进作用,定殖在水稻体内的木霉菌还能大幅度提高水稻抗病相关酶(PPO、PAL、POD)的活性。获得一株稳定的抗性标记菌株,对进一步研究木霉菌在水稻体内的定殖动态及其促生机理,从而强化木霉菌在大田应用,稳定其作用效果等有着至关重要的作用。
实验的对象是选育出的抗腈菌唑木霉菌突变体,作为一种对三唑类杀菌剂有着高耐受性的突变木霉菌株,TUV-13耐药性稳定持续,并不会随着世代的改变以及对田间作物的定殖而减退或者消失。目前有研究结果表明,真菌对三唑类杀菌剂的抗性通常是由微效多基因控制的[11-12]。结合前续实验与RAPD的结果分析,突变体的抗药性很可能是来源于其基因组上微效基因的累加突变。由于木霉菌在PDA平板的培养是无性繁殖,这种由微效多基因控制的抗性似能稳定地遗传。同时,突变木霉菌株对病原菌的抑制作用并未随着基因突变而消退,使其能够作为优秀的标记生防真菌在田间与定殖动态研究中实用化。
[1] 丁 中,刘 峰,慕立义.紫外光诱导哈茨木霉产生腐霉利抗性菌株的研究[J].中国生物防治,2002,18(2):75-78.
[2] 田连生,李贵香,高玉爽.紫外光诱导木霉产生对速克灵抗药性菌株的研究[J].中国植保导刊,2006,26(6):18-20.
[3] 王 勇,杨秀荣,刘水芳.拮抗木霉耐药性菌株的筛选及其与速克灵防治灰霉病的协同作用 [J].天津农学院学报,2002,9(4):19-22.
[4] 梁志怀,魏宝阳,魏 林,等.哈茨木霉在水稻体内的定殖及对水稻生理生化特性的影响[J].湖南农业科学,2008,(4):51~53.
[5] 柳李旺,汪隆植,龚义勤,等.几种茄属植物基因组DNA提取与 RAPD 分析[J].安徽农业科学,1997,(3):193-195.
[6]BULAT S A,LUBECK M,MIR0NENKO N V,et a1.UP-PCR analysis and ITS1 ribotyping of strains of Trichoderma and Gliocladium[J].Mycol Res,1998,(2):933-943.
[7] 吴海云,高增贵,赵世波,等.生防木霉菌123及其诱变体的RAPD 分析[J].植物保护,2007,33(3):26-29.
[8] 杨合同,肖性龙,徐砚珂,等.植病生防木霉菌的RAPD分析[J].山东科学,2004,17(3):17-21.
[9] 田连生.紫外光诱导哈茨木霉产生对多菌灵抗药性的菌株[J].农业环境科学学报,2007,26(1):318-321.
[10]梁志怀,魏 林,陈玉荣,等.哈茨木霉在水稻体内的定殖及其对水稻纹枯病抗性的影响 [J].中国生物防治,2009,25(2):143-147.
[11]袁善奎,周明国.植物病原菌抗药性遗传研究[J].植物病理学报,2004,34(4):289-295.
[12]于雪云,扈进冬,杨合同.木霉菌抗药性研究进展[J].山东农业科学,2007,(6):81-85.

