舒巴坦钠和EDTA使产ESBLs鸡大肠杆菌恢复对抗菌药物敏感性
刘保光,刘建华,吴华,陈玉霞,胡功政,徐利纳,陈燕杰,孟春萍
(河南农业大学 牧医工程学院,河南 郑州 450002)
产生超广谱 β-内酰胺酶(extended spectrum β-lactamases, ESBLs)是细菌对β-内酰胺类抗生素耐药最重要的机制[1].ESBLs主要由肠杆菌科细菌产生,大肠杆菌和肺炎克雷伯菌是其代表菌种,其他如沙门菌、枸橼酸杆菌等也可产生[2].ESBLs的特点是其能水解氧氨基头孢菌素和氨曲南,但能被β-内酰胺酶抑制剂所抑制[3].ESBLs产生菌,不仅对β-内酰胺环类抗生素耐药,而且也对氟喹诺酮类、氨基糖苷类、氟苯尼考、多西环素耐药[4],即呈多重耐药特点.将β-内酰胺环类抗生素与β-内酰胺酶抑制剂舒巴坦钠联用,可大大提高其对产 ESBLs抗菌的活性[5].舒巴坦钠与β-内酰胺环类联用的抗菌作用国内外已有报道[5-7],膜通透性促进剂 EDTA能增加抗菌药物对细菌的抗菌作用国外已有报道[8],在国内仅有 1篇[9].关于舒巴坦钠、EDTA对产ESBLs菌的抗菌作用,河南农业大学兽医药理学实验室已有的研究结果表明,在动物方面,产ESBLs与膜通透性降低在细菌多重耐药产生中有协同作用,但首次研究试验菌株较少,仅有6株.为了使结果更具代表性,笔者选择 18株新近分离的产ESBLs鸡大肠杆菌,分别研究酶抑制剂舒巴坦钠、膜通透性促进剂EDTA及二者联用对抗菌药物敏感性的影响,为产ESBLs鸡大肠杆菌感染的控制提供理论依据.
1 材料与方法
1.1 材 料
1.1.1 菌 株
18株产ESBLs鸡大肠杆菌,由河南农业大学兽医药理学实验室分离,是从24株鸡大肠杆菌分离菌中按CLSI方法[10]通过表型筛选和确证实验证实后选出的,经过法国生物梅里埃Vitek-32全自动细菌鉴定仪鉴定.质控菌株为大肠埃希菌ATCC25922,由中国普通微生物菌种保存中心提供.
1.1.2 培养基
主要培养基成分为 MH肉汤、麦康凯琼脂、MH(A)培养基和GN增菌液.
1.1.3 药敏纸片及药品
氨曲南 (AZT,每片30 μg)、头孢曲松 (CRO,每片30 μg)、头孢泊肟 (CPO,每片30 μg)、头孢噻肟 (CTX,每片30 μg)、头孢噻肟/棒酸 (CTC,每片30/10μg)、头孢他啶 (CAZ,每片30 μg)、头孢他啶/棒酸 (CAC,每片30/10μg)均由北京天坛药物公司提供.加替沙星(GAT)、乳酸环丙沙星(CIP)、左氧氟沙星(LEV)、磷霉素(FOS)、舒巴坦钠(SBT)、头孢噻呋(CTF)、头孢噻肟(CTX)、头孢吡肟(CPM)、多西环素(DOX)、阿米卡星(AK)和氟苯尼考(FLO)均由河南牧翔动物药业有限公司提供.
1.1.4 试验仪器
主要试验仪器为Vitek-32全自动细菌鉴定仪、磁力搅拌器、手提式电热压力蒸汽消毒器、隔水式电热恒温培养箱、电子分析天平、振荡培养箱、超净工作台、真空干燥箱、微量移液器.
1.2 方 法
采用微量肉汤稀释法,先测定左氧氟沙星、加替沙星等10种抗菌药对产ESBLs鸡大肠杆菌的最小抑菌浓度(MIC),再分别测定这些药物与舒巴坦钠、EDTA以及舒巴坦钠+EDTA联用的MIC.药物与舒巴坦钠的质量比为 2∶1,EDTA浓度为1/2MIC.标准菌株ATCC25922作为质控菌.耐药临界值按CLSI颁布的数值标准[10-11]判定.
2 结果与分析
10种抗菌药物及其与舒巴坦钠、EDTA、舒巴坦钠+EDTA联用对18株产ESBLs鸡大肠杆菌的抗菌活性见表1、表2.
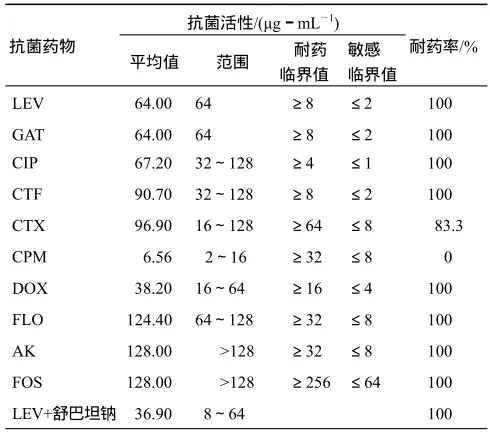
表1 10种抗菌药及其与舒巴坦钠联用对18株产ESBLs鸡大肠杆菌的抗菌活性Table 1 Antibacterial activity of 10 antimicrobial drugs alone and in combination with sulbactam on 18 ESBLs-producing isolates from fowl E. coli
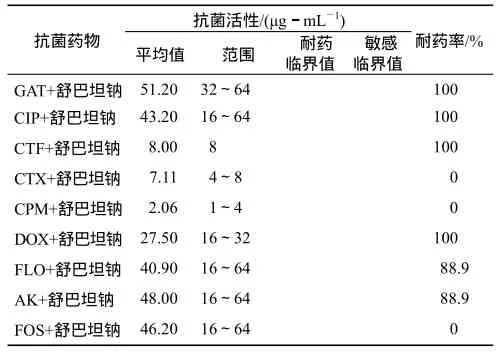
续表
从表1可以看出,18株产ESBLs鸡大肠杆菌对氟喹诺酮类药物的耐药率均达到 100%,加入舒巴坦钠后耐药率没有变化;对第三代头孢菌素类(头孢噻呋、头孢噻肟)的耐药率也较高,但加入舒巴坦钠后,对头孢噻肟的耐药率变为 0;对氟苯尼考、阿米卡星、磷霉素的耐药率达到100%,加入舒巴坦钠后都有所降低,对磷霉素的耐药率变为0;对多西环素的耐药率在加入舒巴坦钠前后没有明显变化.
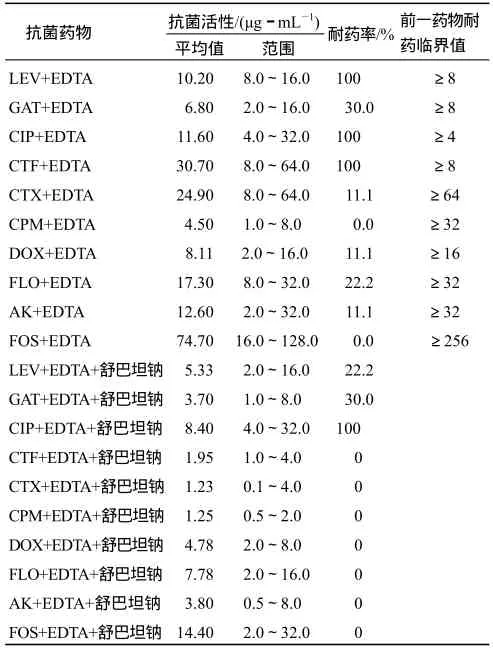
表2 10种抗菌药分别与EDTA、EDTA+舒巴坦钠联用对18株产ESBLs鸡大肠杆菌的抗菌活性Table 2 Antibacterial activity of 10 antimicrobial combinations with EDTA and sulbactam+EDTA against 18 ESBLs-producing isolates from fowl E. coli
从表2可以看出,18株产ESBLs的鸡大肠杆菌对加入EDTA加替沙星的耐药率降至30%,但对加替沙星+EDTA+舒巴坦钠、环丙沙星+EDTA+舒巴坦钠的耐药率,与对加替沙星+EDTA、环丙沙星+EDTA的耐药率无差异.
综合分析表1、表2可知,对加入EDTA的头孢噻呋的耐药率与对头孢噻呋单用的耐药率没有变化,但对第三代头孢菌素类+EDTA+舒巴坦钠的耐药率比对第三代头孢菌素类仅与EDTA或舒巴坦钠联用的耐药率有所降低;对加入EDTA的多西环素、氟苯尼考、阿米卡星的耐药率均比对单药的耐药率低,对氟苯尼考、阿米卡星、多西环素分别与EDTA+舒巴坦钠联用的耐药率均比仅与EDTA或舒巴坦钠联用的耐药率低.
3 结论与讨论
本试验检测的产ESBLs鸡大肠杆菌均呈多重耐药特性,一是因为鸡大肠杆菌携带ESBLs的质粒同时携带有氟喹诺酮类、氨基糖苷类等多种抗菌药的耐药基因,使产ESBLs菌具有多重耐药表型[4],二是因为产生ESBLs等特异性耐药机制和外膜通透性降低、主动外排作用等非特异性耐药机制协同存在导致了多重耐药.舒巴坦钠与β-内酰胺类抗生素联用能明显提高对产酶耐药菌的体外抗菌活性[5].本试验结果表明,舒巴坦钠不仅能增强第三代头孢菌素类抗生素对产ESBLs鸡大肠杆菌的抗菌活性,而且能明显提高阿米卡星、氟苯尼考、磷霉素的抗菌活性.其原因可能是舒巴坦钠本身对产ESBLs菌有一定的内在活性,或当用舒巴坦钠抑制ESBLs后,膜通透性改变,主动外排的作用亦相应减弱,从而在细菌细胞内的药物浓度增加,使这3种药物对产ESBLs鸡大肠杆菌的抗菌活性相应增强,其具体分子机制有待研究.
本试验结果表明,氟喹诺酮类、头孢噻肟、多西环素、氟苯尼考、阿米卡星、磷霉素加入EDTA后对产ESBLs鸡大肠杆菌的MIC降低,部分菌株可恢复敏感性.大多抗菌药物,如β-内酰胺类、氯霉素、磷霉素、氨基糖苷类药物,均主要通过大肠杆菌外膜蛋白(OmpF和OmpC,主要是OmpF)进入细胞内发挥抗菌作用[12].文献[13]报道,EDTA作为一种常见的膜通透性促进剂,可以与维持细胞膜结构和功能的必需成分Ca2+、Mg2+等络合,从而导致细胞流动性和通透性增加,最终结果是增加药物进入细菌的浓度,以对抗外膜渗透性降低及药物外排泵出增强的多重耐药机制.文献[9]报道,在各抗菌药物中加入EDTA可治疗多重耐药细菌感染.在本试验中观察到,在抗菌药物中加入 EDTA使产ESBLs的多重耐药菌对多数抗菌药恢复了敏感性,说明EDTA与抗菌药联用,对控制多重耐药菌感染有应用价值.
本试验结果表明,第三代头孢菌素、阿米卡星、氟苯尼考、磷霉素与舒巴坦钠+EDTA联用的MIC,均比与舒巴坦钠、EDTA联用的MIC有所下降.这表明,β-内酰胺酶抑制剂舒巴坦钠与膜通透性促进剂EDTA联用,不仅对提高β-内酰胺环类药物的抗菌活性有协同作用,而且对提高阿米卡星、氟苯尼考、磷霉素的抗菌活性有协同作用,从而进一步从表型上证明了特异性耐药机制产生 ESBLs与非特异性耐药机制膜通透性降低在产 ESBLs禽大肠杆菌多重耐药中有协同作用.据本试验结果推测,舒巴坦钠+EDTA与第三代头孢、阿米卡星、氟苯尼考、磷霉素等联用,可能在产ESBLs多重耐药禽大肠杆菌的防治上有应用前景.
[1] Bradford P A.Extended-spectrum β-Lactamases in the 21st century:Characterization,epidemiology,and detection of this important resistance threat[J].Cin Microbiol Rev,2001,14:933-951.
[2] 匡秀华,杨玉荣,胡功政,等.鸡肠杆菌科细菌 β-内酰胺酶和超广谱 β-内酰胺酶的检测及药敏分析[J].中国兽医学报,2008,28(2):170-174.
[3] Bush K, Jacoby G A, Medeiros A A.A functional classification scheme for β-Lactamases and its correlation with molecular structure[J].Antimicrob Agents Chemother,1995,39:1211-1233.
[4] Paterson D L, Mulazimoglu L, Casellas J M, et al.Epidemiology of ciprofloxacin resistance and its relationship to extended-spectrum β-Lactamase production inKlebsiella pneumoniaeisolates causing bacteremia[J].Clin Infect Dis,2000,30:473-478.
[5] 胡功政,张春辉,梁军,等. 猪鸡致病菌β-内酰胺酶、超广谱β-内酰胺酶检测与药敏分析[J].中国农业科学,2005,38(2):399-404.
[6] Fuchs P C, Stickel S, Anderson P H, et al.In vitroinactivation of aminoglycosides by sulbactam,other betalactams,and sulbactam-betalactam combinations[J]. Antimicrob Agents Chemother, 1991,35(1):182-184.
[7] 张春辉,周青云,胡功政.舒巴坦钠与常见 β-内酰胺环类抗生素的体外抑菌试验[J].中兽医医药杂志,2005,24(5):36-37.
[8] Bernard Lakaye,Alain Dubus,Bernard Joris.Method for estimation of low outer membrane permeability to β-Lactam Antibiotics[J]. Antimicrobial Agents and Chemotherapy,2002,9:2901-2907.
[9] 庞晓军,莫国艳,利春红,等.乙二胺四醋酸使耐药菌恢复对抗菌药物敏感性的研究[J].中国医院药学杂志,2008,28(14):1182-1184.
[10] M100-S18 CLSI document[S].
[11] M31-A3 CLSI document[S].
[12] Nikaido H.Prevention of drug access to bacterial targets: Permeability barriers and active efflux[J].Science,1994,264:382-388.
[13] 严杰,钱利生,余传霖.临床医学分子细菌学[M].北京:人民卫生出版社,2005:570-572.
英文编辑:罗文翠

