草鱼肠道组织抑制性消减表达序列标签的初步分析
章卓,雷红宇,苏建明*
(1.全国畜牧总站,北京 100125;2.湖南农业大学 动物医学院,湖南 长沙 410128)
鱼类是最早兼有特异性免疫与非特异性免疫的脊椎动物,由于其特异性免疫还不完善,抗体生成又受到水温等多种环境因素的影响,因此非特异性免疫以其反应快速、具有抗病作用而成为鱼类抵抗病原入侵的第一道防线[1].哺乳动物黏膜免疫研究日前已备受重视[2],而对鱼类的免疫学研究目前大多集中在系统免疫上,对黏膜免疫的研究还不够深入[3].肠道存在多种常驻菌群.肠道在与这些微生物共存的同时,也可对存在的有害微生物或被肠道吸附的异己物质进行有效的识别,并加以排除.在感染情况下,肠上皮细胞可表达共刺激分子I-CAM-1,并通过MHC-Ⅰ、MHC-Ⅱ类分子将抗原提呈给CD类型T细胞,引起免疫反应[4].在鱼类肠道没有类似哺乳动物的Peyer氏淋巴结,可能影响对抗原的摄取与提呈[1].目前,以肠道组织为材料,探讨其在外界抗原诱导下表达基因的研究较少.笔者采用抑制性消减杂交技术,构建了草鱼肠道组织抑制性消减cDNA文库,获得了一定数量的草鱼肠道组织差异表达的EST序列,并对获得的序列进行了生物信息学分析,现将结果报道如下.
1 材料与方法
1.1 材 料
供试草鱼4条,体长(20.4±1.8) cm.2条经嗜水气单胞菌灌服诱导,2 d后取肠道组织,用DEPC水处理的无菌水清洗3次,用于感染组消减文库构建;另2条不进行感染处理,同样取出肠道组织用作对照.
1.2 方 法
1.2.1 RNA的提取
按照总RNA提取试剂盒Trizol(Invitrogen)说明书操作,分别从感染组和对照组的肠道组织中提取总RNA;提取的总RNA用PolyATract mRNA Isolation System(Promega)试剂盒进行mRNA分离纯化.
1.2.2 消减cDNA文库的构建
以感染组肠道组织作为检测子样品,以对照组肠道组织作为驱动子样品,参考PCR-select cDNA Subtraction Kit(Clontech)的操作手册进行差减杂交[5].
1.2.3 文库的筛选以及序列分析

图 1 插入cDNA片段的PCR产物电泳结果Fig.1 PCR products electrophoresis of the inserted cDNA fragments
随机挑取24个克隆,利用载体引物M13+ (5′-GTTGTAAAACGACGGCCAGTG-3′)和M13-(5′-CAGGAAACAGCTATGACCATG-3′)进行PCR扩增,确定cDNA插入片段的长度;采用同样的方法筛选cDNA克隆,片段长度大于300 bp的用于测序.随机挑取PCR筛选后的克隆,37 ℃液体培养过夜后,提取质粒(Qiagene).利用载体引物M13+/-为测序引物进行测序,测序由上海英骏生物技术有限公司完成.采用DNAMAN序列分析软件对测序结果原始序列进行分析,去掉两端的载体序列以及难以辨认的核苷酸,个别碱基通过软件Chromas与原始序列文件比对进行更正.
测序结果用Blast在GenBank中进行同源性搜索比对分析,E值小于-6时认为具有较好的同源性[6].搜索顺序依次为 BlastX (the nonredundant protein library,非重复蛋白质文库)、BlastN(the nonredundant nucleotide library,非重复核酸文库)[7],并根据其对应的同源物对其进行注释和归类分析.
2 结果与分析
2.1 PCR检测消减文库质量
对随机挑取的克隆进行PCR检测,结果(图1)显示克隆片段为0.25~1.50 kb.随机挑选的24个克隆插入片段平均长度为0.75 kb,最短的为0.25 kb,最长的为1.5 kb,与文库构建经第2次PCR检测的预期结果相一致,构建的消减cDNA文库质量较好.
2.2 消减cDNA EST序列的统计与分析
对211个克隆中的cDNA进行单向测序, 除去测序效果不好、碱基无法辨认或序列测序片段小于150 bp的序列,实际共获得147个序列EST(非rRNA和chondriogene序列测序的错误率小于5%).相似性搜索结果表明,有97个克隆和GenBank中的已知功能的序列具有较高的同源性(分值>100);17个与未知功能的开放阅读框具有较高的相似性,称之为假定蛋白;33个序列在同源性搜索中没有找到任何对应的相似序列,它们很可能是目前还没有鉴定的EST或是5′-或3′-UTR序列.
2.3 消减cDNA EST功能分类
根据 Ademas等[8]对人类功能基因的分类方法,将获得的EST 序列按BLAST得到的相似性序列功能进行分类,结果见表1、表2.97个已知功能的 EST分别属于46个不同的基因.在获得的已知功能EST序列中,与细胞防御和基因表达有关的蛋白分别占EST簇数的28.26%、19.57%;与代谢和信号传导有关的蛋白分别占EST簇数的23.91%、19.57%.和细胞结构与运动、细胞分裂有关的基因分别只有3、1个,EST簇数也分别只有3、1个.

表 1 与GenBank中编码已知功能蛋白质和假定蛋白质序列有同源性的草鱼ESTTable 1 Grass carp ESTs matched to sequences encoding for known function protein and putative protein in GenBank datbase

续表
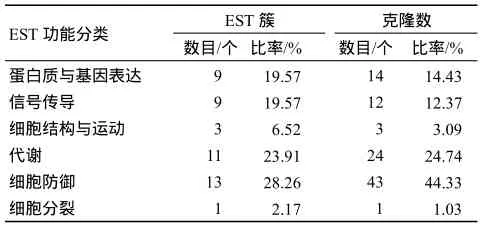
表2 编码已知蛋白表达序列标签(EST)的功能分类Table 2 functional categories of ESTs encoding known proteins
3 讨 论
目前,已针对牙鲆[9-12]、鲶鱼[13]、虹鳟[14]、鲤鱼[15]、草鱼[16]和扇贝[17]等,采用抑制消减杂交技术开展了相关基因的克隆与表达,获得了许多发育、代谢及免疫的相关基因.笔者采用抑制消减杂交技术构建了人工感染致病性细菌后草鱼肠道组织差异表达的cDNA文库.在获得的EST序列中,与细胞防御相关基因的EST最多,表明在细菌诱导下,机体产生了免疫反应过程,经Blast分析获得多个免疫抗病相关基因,如MHC、transferrin、CD9、AMBP、Crystallin等[18-19].MHC参与免疫反应过程对抗原的识别没有特异性,属于机体免疫系统的非特异性免疫体系.相对高等脊椎动物,作为低等脊椎动物的鱼类,其特异性防御机制并不完善,鱼类的非特异性免疫系统在其自身抗病作用中较特异性免疫系统可能发挥了更大的作用.除了MHC之外,转铁蛋白获得4个克隆[20].铁蛋白对由应激、化学物质(尿素、盐酸胍)引起的变性有很强的抵抗力[21].新基因α-1微球蛋白/bikunin前体主要在肝脏中表达,后分离成α-1微球蛋白和胰蛋白酶抑制剂-bikunin.α-1微球蛋白在动物体内分布较广,在人体内参与了免疫调节作用[22],但其确切的生理功能和发生机制还不清楚.试验中还发现 1个Z-Crystallin基因,属于 Crystallin家族蛋白.对Crystallin蛋白的研究[23]表明,α、β-Crystallin蛋白为小分子伴侣蛋白,在老化进程、应激反应中发挥重要作用.Z-Crystallin是种NADPH氧化还原酶,与乙醇脱氢酶序列类似,但无乙醇脱氢酶活性,广泛参与机体的应激反应,说明草鱼在细菌的诱导下,机体在启动自身免疫反应的同时,也加强了自身代谢与基因表达的适应性反应[24].
本研究中,通过抑制性消减杂交技术获得了一定数量的差异表达基因.由于测定的cDNA数目有限,远远低于细胞表达的基因数,但也初步反映了草鱼肠道组织在病原菌的诱导下机体对外来刺激反应的基因表达分布,获得了不少新基因,特别是与免疫作用有关的基因的鉴定.研究这些基因的功能将为鱼类黏膜分子免疫机制研究打下重要的信息基础.
[1] 罗晓春,谢明权,黄玮,等.鱼类黏膜免疫研究进展[J].水产学报,2005,29 (3):411-416.
[2] Vancikova Z.Mucosal immunity-basic principles,ontogeny,cystic fibrosis and mucosal vaccination [J].Current Drug Targets-Immune,Endocrine and Metabolic Disorders,2002,2(1):83-95.
[3] Clerton P,Troutaud D,Descjaix P.The chemilumiescence response of leucocytes isolated from the gut of rainbow trout(Oncorhynchus mykiss)[J]. Fish and Shellfish Immunology,1998,8:73-76.
[4] 杨倩,周广礼.动物黏膜免疫新进展[J].畜牧与兽医,2001,33(5):38-39.
[5] 苏建明,陈韬,肖调义,等.草鱼肠道组织差异表达基因消减文库的构建[J].湖南农业大学学报:自然科学版,2007,33(6):718-722.
[6] Makabe K W,Kawashima T,Kawashima S.Large-scale cDNA analysis of the maternal genetic information in the egg ofHalocynthia roretzifor a gene expression catalog of ascidian development[J].Development,2001,128:2555-2567
[7] Douglas S E,Gallant J W,Bullerwell C E,et al.Winter flounder expressed sequence tags:Establishment of an EST database and identification of novel fish genes [J].Marine Biotechnology,1999,1(5):458-464
[8] Adema C M,Vander Knaap,Sminia W P W,et al. Molluscan hemocyte-mediated cytotoxicity:The role of reactive oxygen intermediates[J].Rev Aquat Sci,1991,4:201-223.
[9] Aoki T,Nam B-H,Hirono I,et al.Sequences of 596 cDNA clones (565,977 bp) of Japanese flounder (Paralichthys olivaceus) leukocytes infected with hirame rhabdovirus[J].Marine Biotechnology,1999,1(5):477-488.
[10] Nam B-H,Yamamoto E,Hirono I,et al.A survey of expressed genes in the leukocytes of Japanese flounder,Paralichthys olivaceus,infected with hirame rhabdovirus[J].Developmental & Comparative Immunology,2000,24(1):13-24.
[11] Kono T,Sakai M.The analysis of expressed genes in the kidney of Japanese flounder,Paralichthys olivaceus,injected with the immunostimulant peptidoglycan [J].Fish & Shellfish Immunology,2001,11(4):357-366.
[12] Nam B-H,Hirono I,Aoki T.Bulk isolation of immune response-related genes by expressed sequenced tags of Japanese flounder,Paralichthys olivaceus,leucocytes stimulated with ConA/PMA[J].Fish & Shellfish Immunology,2003,14(5):467-476.
[13] Ju Z,Karsi A,Kocabas A,et al.Transcriptome analysis of channel catfish(Ictalurus punctatus):Genes and expression profile from the brain[J].Gene,2000,261(2):373-382.
[14] Kono T,Sakai M,LaPatra S E.Expressed sequence tag analysis of kidney and gill tissues from rainbow trout (Oncorhynchus mykiss) infected with infectious hematopoietic necrosis virus[J].Marine Biotechnology,2000,2(5):493-498.
[15] Savan R,Sakai M.Analysis of expressed sequence tags (EST) obtained from common carp,Cyprinus carpio,head kidney cells after stimulation by two mitogens,lipopolysaccharide and concanavalin-A [J].Comparative Biochemistry and Physiology,2002,131(1):71-82.
[16] 陈韬,陈立祥,苏建明,等.草鱼肝胰脏组织部分EST的鉴定及分类[J].中国水产科学,2006,13(5):714-723.
[17] 陈韬,苏建明,文祝友,等.扇贝性腺和肠组织表达序列标签的初步识别[J].农业生物技术学报,2003,11(4):407-411.
[18] ApaniusV,Penn D,Slev P R,et al.The nature of selection on the major histocompatibility complex [J].Critical Review in Immunology,1999,17(2):179-224.
[19] Edward S V,Hedrick P W.Evolution and ecology ofMHCmolecules:From genomics to sexual selection [J].Trends in Ecology &Evolution,1998,13(8):305-311.
[20] Jin W,Takagi H,Pancorbo B,et al.“Opening” the ferritin core for iron release by mutation of conserved amino acids at interhelix and loop sites[J].Biochemistry,2001,40(25):7525-7532.
[21] Crichton R R.Proteins of iron storage and transport [J].Advances in Protein Chemistry,1990,40:281-363.
[22] Kawahara A,Hikosaka A,Sasado T,et al.Thyroid hormone-dependent repression of α1-microglobulin/ bikunin precursor (AMBP) gene expression during amphibian metamorphosis[J].Development Genes and Evolution,1997,206(6):355-362.
[23] Horwitz J.Alpha-crystallin[J].Experimental Eye Research,2003,76(2):145-153.
[24] Norman P C.Zeta-crystallin:A tale of two cells [J].Kidney International,2009,76:691-693.
英文编辑:罗文翠

