胸膜肺炎放线杆菌血清 8型自转运黏附素基因克隆测序及功能区对比
王 瑜,雷连成,韩文瑜,谢 芳,李林溪,周 靓,杨舒心,胡本钢,邢艳苹,计 群,路 荣,刘晓贺,何伯萍
(吉林大学畜牧兽医学院,吉林长春,130062)
胸膜肺炎放线杆菌(Actinobacillus pleuropneumoniae,APP)是猪传染性胸膜肺炎的病原菌。猪传染性胸膜肺炎是一种高度传染性和致死性的呼吸系统疾病,它主要经呼吸道感染并且具有专一性的侵害猪的肺脏。所以,在该菌的定植过程中,黏附成为该菌感染不可缺少的生存定居的过程[1]。2002年,Ingrid Van Overbeke等[2]研究发现,APP黏附于宿主细胞的过程可能是由多因素多因子共同参与完成的。而目前有关 APP黏附作用的研究寥寥无几,仅有脂多糖(LPS)、菌毛等[3~5]。由此推测,含有一些潜在的黏附因子尚未被发现,有待进一步研究。
吉林大学和平校区畜牧兽医学院微生物实验室在前期研究中,首次发现 APP存在三聚体自转运黏附素[6],并发现其在不同血清型中的三聚体自转运黏附素存在着显著的差异,其中血清 5b型具有完整的三聚体自转运黏附素的结构。但是,目前对于该蛋白的黏附功能尚不明确。笔者在生物信息学分析的基础上,将首次获得的 APP血清 8型基因序列与APP血清 3,5b,7型进行对比,以及基因序列进行分析。
1 材料与方法
1.1 菌株
胸膜肺炎放线杆菌(APP)血清 8型 CVCC 405菌株购自中国兽医微生物菌种保藏管理中心(CVCC);大肠杆菌 DH5α菌株购自宝生物工程(大连)有限公司。
1.2 试剂
脑心浸液(Brain Heart Infusion,BHI)、马血清、NAD(sigma)等购自北京鼎国生物试剂公司;AxyPrep BacterialGenomic DNA Miniprep kit(Axygen),QIAquick PCR purification Kit(QIAGEN),DIG-High Prime DNA Labeling and Detection Starter Kit I(Roche)等试剂盒分别购自长春维特洁、长春联星生物公司、长春科隆生物工程用品经销部;限制性内切酶 SalⅠ,EcorⅠ,La Taq,dNTP(TaKaRa)等购自宝生物工程(大连)有限公司。
1.3 培养基
脑心浸液(BHI)液体培养基按文献介绍的方法配制[15],高压灭菌,待温度降到约 50℃时,加入 1/200的 NAD,质量浓度为 50 g/L的小牛血清,摇匀,倒平皿,4℃保存。
1.4 基因组 DNA的提取
APP菌株血清 8型 CVCC405接种于 2m L BHI液体培养基,37℃振荡培养 12 h,10 000 r/min,离心3 min,收集菌体。采用 AxyPrep Bacterial Genomic DNA Miniprep kit(Axygen)提取基因组,具体操作方法参照试剂盒说明书,质量浓度为 7 g/L的琼脂糖凝胶电泳分析。
1.5 PCR扩增条件
通过 APP血清 5b(L20)型的自转运黏附素 N端 3 875 bp设计引物,以 APP血清 8型 CVCC 405为模板,扩增序列。PCR扩增体系:5 L 10×La Taq Buffer,5μL dNTPMixture(2.5mmol/each),1μL Primer(上)(50μmol/L),1μL Primer(下)(50μmol/L),2μL APP血清 8型基因组,0.5μL La Taq(5×106U/L),dd H2O补至 50μL。
PCR扩增程序:95℃预变性 5min;94℃1m in,50℃ 2m in,72℃4min,进行 30个循环,最后 72℃10 min。PCR产物用质量浓度为 10 g/L的琼脂糖凝琼脂糖凝胶电泳检测。
1.6 PCR产物的回收
采用AxyPrep DNAGel Extraction kit(Axygen)对PCR扩增的目的片断进行回收,具体操作方法参照试剂盒说明书。
1.7 克隆与测序
将回收的 PCR产物连接到 pMD18-T载体上按资料介绍的方法[7]连接过夜,转化大肠杆菌 DH5α,经氨苄抗性筛选得到阳性克隆,酶切鉴定,对阳性重组质粒,送上海生工生物工程有限公司测序。
1.8 序列比对分析
应用生物信息学软件将获得的 APP血清 8型核酸序列进行分析,应用 DNAMAN软件进行多重比对及同源性分析,结果用于系统进化分析。
1.9 APP血清 8型自转运黏附素的生物信息学分析
1.9.1 SMART软件在线分析 使用在线分析软件 SMART(http://SMART.embl-heidelberg.de)对测序后推断的 APP血清 8型自转运黏附素的编码蛋白进行分析;同时对 Genbank报道的 APP血清 5b型和7型自转运黏附素序列(登录号:CP000569.1和 CP001091.1)进行分析。
1.9.2 信号肽分析 使用信号肽分析软件 SignalP 3.0(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽。
1.9.3 黏附功能区的预测 使用生物信息学软件 SMART(http://SMART.embl-heidelberg.de)和自转运黏附素分析软件 daTAA(http://toolkit.tuebingen.mpg.de/dataa)对黏附基序进行分析,并预测黏附的重要功能区域。
2 结 果
2.1 PCR扩增
应用本实验室设计的引物对 APP血清 8型基因组进行扩增,得到约 3 000 bp的特异性条带(图 1)。
2.2 序列测定

图 1 PCR扩增结果电泳图 APP血清 8型,
通过 DNAStar软件分析,表明序列长度为 3 366 bp,与血清 5b型相比缺失了 509 bp的氨基酸。该基因编码 1 122个氨基酸。
2.3 序列分析
使用 DNAMAN软件对测序得到的 APP血清 8型核苷酸序列与 GenBank中已知的 3,5b,7核苷酸序列进行比较分析,结果显示序列的一致性为 77.2%,核苷酸序列存在着差异(表 1)。

表 1 不同血清型的APP序列比对
通过 DNAstar软件对测序得到的序列分析,发现 APP血清 8型序列抗原性高(图 2)。通过 DNAstar对序列分析,结果表明所得序列是一个完整的阅读框。
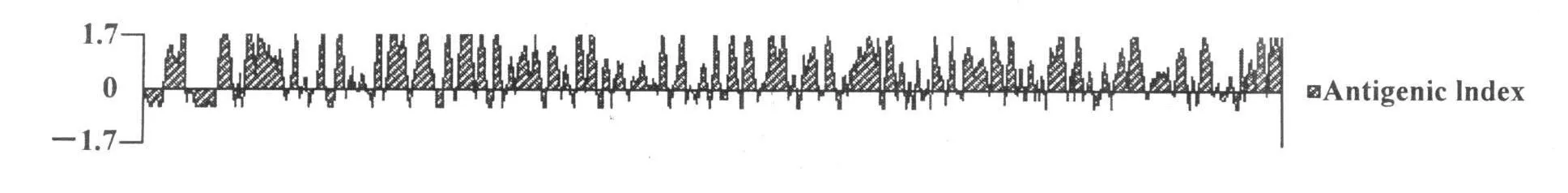
图2 DNAStar软件对 APP血清 8型自转运黏附素的抗原性分析
2.4 核苷酸序列同源性分析
由序列比对结果可知 APP血清 8型核苷酸序列与 GenBank已知血清型序列比对同源性 92%~93%,其中与 APP血清 7型同源性最高 93%,与 APP血清 3,5b型同源性均为 92%。
2.5 系统发生树进化分析
比较结果分为 2大分支,APP血清 8型系统发生树进化关系见图 3。其中血清 8型与 APP血清 3,5b型亲缘关系比较近,APP血清 7型在另一个分支簇。

图 3 根据测序结果所做的系统发生树进化树
2.6 结构及功能分析
使用信号肽分析软件 SignalP 3.0对信号肽区域进行预测,结果显示,APP血清 8型 1-16 aa为信号肽区域(图 4)。使用蛋白分析软件 SMART对黏附基序进行分析,结果发现血清 8型大量的 Hep_Hag基序密集分布在 132~524 aa处,与 APP血清 5b型、APP血清 7型相比各后移了 6 aa(图 5)。使用自转运黏附素分析软件 daTAA对黏附基序进行分析,结果发现血清 8型大量的 Ylhead基序密集分布于 130~618 aa处,与 APP血清 5b型、APP血清 7型相比各后移了 6 aa(图 6)。
分析证明,这段序列为三聚体自转运黏附素结构,并且是完整的 N末端结构,有着非常好的信号肽区域。
3 讨 论
本实验采用 PCR方法对 APP血清 8型进行扩增,所得片段为 3 366 bp,首次获得 APP血清 8型的基因序列并提交 GenBank(bankit1392817 HQ399552)。测得序列比对结果显示,所得序列为胸膜肺炎放线杆菌。比对中发现,与已知的序列一致性仅达到 77.2%。通过 DNAstar软件对得到的序列分析发现,APP血清 8型序列抗原性高。对序列分析结果表明,所得序列是一个完整的阅读框,起始密码子为ATG,终止密码子为 TAA,并且是一个功能蛋白,该基因编码 1 122个氨基酸。通过比对发现,这段序列可能是三聚体自转运黏附素的一段序列。由序列比对结果可知,与 GenBank已知血清型序列比对同源性 92%~93%,其中与APP血清 7型自转运黏附素的 N段序列同源性最高,达 93%;与 APP血清 5b型自转运黏附素的 N段序列同源性均为 92%。
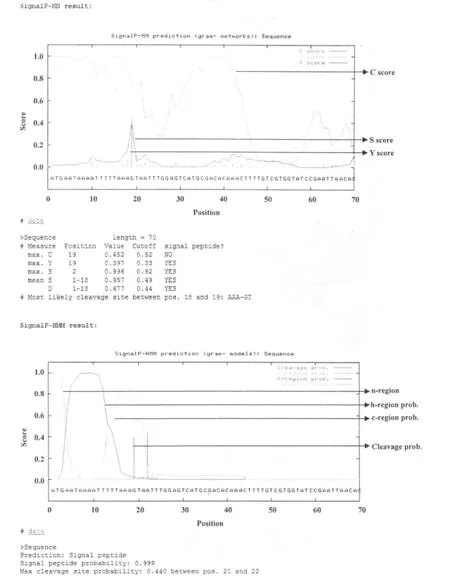
图 4 SignalP 3.0软件对 APP血清 8型自转运黏附素的信号肽分析
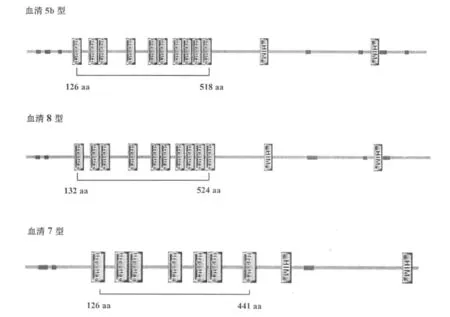
图5 SMART软件对 APP血清 5b,8,7型自转运黏附素的黏附基序比对分析
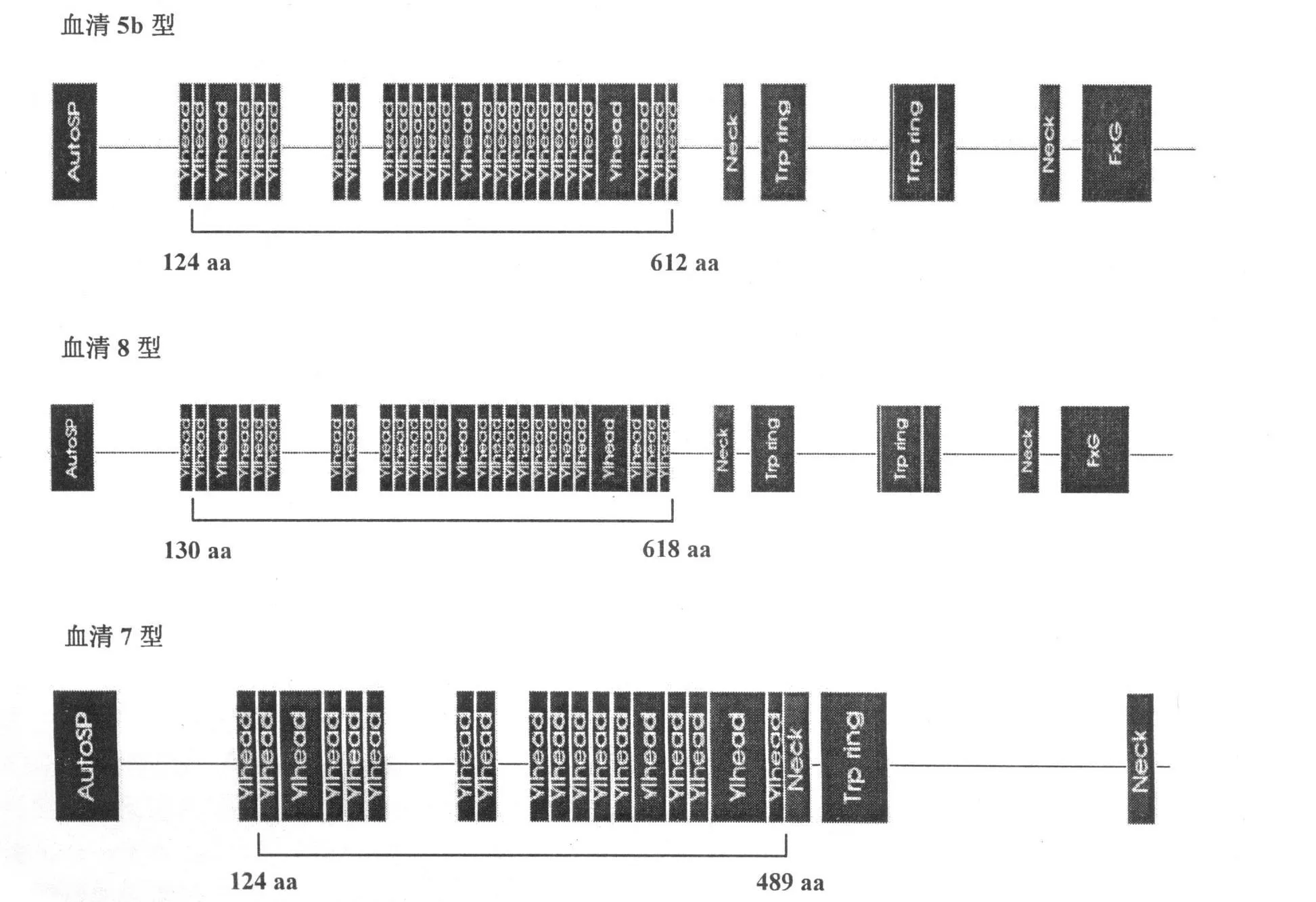
图 6 daTAA软件对 APP血清 5b,8,7型自转运黏附素的黏附基序比对分析
自转运黏附素的序列排布具有典型的特征,包含 N末端信号肽(signal peptide)、中间的承载结构域(passenger domain)、C末端的转运单位(translocation unit)。其中,承载结构域是决定自转运黏附素的功能的区域[8]。因此,首先需要运用使用信号肽分析软件 SignalP 3.0对信号肽区域进行预测,结果显示APP血清 8型 1~19 aa为信号肽区域。目前对三聚体自转运黏附素的研究认为,承载结构域 N端的头部是介导黏附的关键区域[8]。使用蛋白分析软件 SMART发现,血清 8型大量的 Hep_Hag基序密集分布于 132~524 aa处,与 APP血清 5b型、APP血清 7型相比各后移了 6 aa;Hep_Hag基序与细菌的黏附、聚集和侵入密切相关;YadA是最早发现的三聚体自转运黏附素,三聚体自转运黏附素的转运单位极为保守,此后在其他细菌中发现的所有三聚体自转运黏附素都是由于其转运单位与 YadA的相似而被归类于三聚体自转运黏附素亚家族[8,9]。随后使用 daTAA软件对其是否为三聚体自转运黏附素进行进一步确定。daTAA是专门用于分析三聚体自转运黏附素的基序和蛋白域的软件[10],其他的蛋白,包括传统的自转运蛋白,都不能用此软件得到分析结果。使用自转运黏附素分析软件 daTAA结果发现,血清 8型大量的 Ylhead基序密集分布于 130~618 aa处,与 APP血清 5b型、APP血清 7型相比各后移了6 aa,与 SMART分析的结果基本一致,Ylhead就是 YadA-like head,此基序含有 YadA头部的 NSVAIG-S序列[16];由这两种软件的分析结果及信号肽分析结果,此序列为三聚体自转运粘附素 N端序列,预测自转运黏附素 N端 20~618 aa为黏附的重要功能区域,使用 DNAStar软件分析该段具有良好的抗原性。2009年,Auger和 Labrie等[10,11]进行 APP体外黏附猪肺上皮细胞实验和生物被膜形成实验时,都发现了自转运黏附素基因上调表达。这些研究说明自转运黏附素参与了 APP的黏附、聚集和生物被膜形成,可能是 APP新发现的重要的毒力因子。但是,目前的研究仍未对自转运黏附素的黏附功能进行进一步的研究证实,所以随后的实验是非常重要的。
研究还发现,许多自转运黏附素具有免疫保护作用,能激活 B细胞,并且其抗体可阻断细胞黏附或动物感染,这证明自转运黏附素可能成为疫苗的候选因子,在疫苗研制方面具有非常重要的价值[12]。百日咳杆菌的自转运黏附素 pertactin(PRN)已经作为一种疫苗组分添加到商品化的无细胞百日咳疫苗中[13]。所以,APP的自转运粘附素的研究有着商业性的历史意义。开展进一步的研究,证明自转运粘附素与 APP的毒力的关系,及其功能区的研究有着深远的意义。
[1] HOEPELMAN A I,TUOMANEN E I,et al.Consequences ofmicrobial attachment:directing host cell functions with adhesions[J].In fect Immun,1992,60:1 729-1 733.
[2] OVERBEKE I V,CHIERSK,CHARLIER G,et al.Characterization of the in vitro adhesion of Actinobacillus pleuropnemoniae to swine alveolar epithelial cells[J].Veterinary Microbiology,2002,88:59-74.
[3] PARADIS S E,DUBREUIL D,RIOUX S,et al.High-molecular-mass lipopolysaccharides are in-volved in Actinobacillus pleuropneumoniae adherence to porcine respiratory tract cells[J].Infect Immun,1994,62(8):3 311-3 319.
[4] DUBREUIL JD,JACQUESM,MITTAL K R,et al.Actinobacillus pleuropneumoniae surface poly-saccharides:their role in diagnosis and immunogenicity[J].Anim Health Res Rev,2000,1(2):73-93.
[5] BOEKEMA B K,VAN PUTTEN JP,STOCKHOFE-ZURWIEDEN N,et al.Host cell contact-induced transcrip tion of the type IV fimbriagene cluster of Actinobacillus pleuropneumoniae[J].Infect Immun,2004,72(2):691-700.
[6] XIE F,LEILC,DU CT,etal.Genomic differences between Actinobacillus pleuropneumoniae serotypes 1a-nd 3 and the diversity distribution among 15 serotypes[J].FEMSMicrobiology Letters,2010,303(2):147-155.
[7] ENOE C,ANDERSEN S,SORENSEN V,et al.Estimation of sensitivity,specificity and predictive values of two serologic tests for the detection of antibodies against Actinobacillus p leuropneumoniae serotype 2 in the absence of a reference test[J].Prev Vet Med,2001,51(3/4):227-243.
[8] LINKED,RIESS T,AUTENRIETH I B,etal.Trimeric autotransporter adhesins:variable structure,common function[J].TrendsMicrobiol,2006,14(6):264-270.
[9] COTTER S E,SURANA N K,St GEME JW 3rd,et al.Trimeric autotransporters:a distinct subfam ily of autotransporter p roteins[J].Trends Microbiol,2005,13(5):199-205.
[10] SZCZESNY P,LUPAS A.Domain annotation of trimeric autotransporter adhesins--daTAA[J].Bioinformatics,2008,24(10):1 251-1 256.
[11] AUGER E,DESLANDESV,RAMJEETM,et al.Host-pathogen interactions of Actinobacillus pleuropneumoniae with porcine lung and trachealepithelial cells[J].Infect Immun,2009,77(4):1 426-1 441.
[12] LABRIE J,PELLETIEER-JACQUESG,DESLANDESV,et al.Effects of growth conditions on biofilm formation by Actinobacillus p leuropneumoniae[J].Vet Res,2010,41(1):3.
[13] KLEMM P,SCHEMBRIM A.Bacterial adhesins:function and structure[J].Int JMed Microbiol,2000,290(1):27-35.
[14] JEFFERSON T,RUDIN M,DIPIETRANTONJC,et al.Systematic review of the effects of pertussis vaccines in children[J].Vaccine,2003,21(17-18):2 003-2 014.
[15] 陈天寿.微生物培养基的制造与应用[M].北京:中国农业出版社,1995.
[16] BLACKALLP J,KLAASEN H L,VAN DEN BOSCH H,et al.Proposal ofa new serovar of Actinobacillus pleuropneumoniae:serovar 15[J].VetMicrobiol,2002,84:47-52.
(责任编辑:朱宝昌)
- 河北科技师范学院学报的其它文章
- 痤疮丙酸杆菌对小鼠抗胸膜肺炎放线杆菌血清 7型 9型的免疫保护

