日本樱花茎段再生体系的建立
何月秋,王志龙,池树友
(1.宁波城市职业技术学院环境学院,浙江宁波 315502;2.宁波森林病虫害检验检疫站,浙江宁波 315502)
日本樱花(Prunus yedoensis Matsum)隶属蔷薇科李属[1],其花色幽香艳丽,盛开时节花繁艳丽,满树烂漫,如云似霞,极为壮观,是人们所喜爱的木本花卉之一。随着我国经济的发展和人民生活水平的提高,名贵日本樱花走俏市场,苗木供不应求。传统的日本樱花营养繁殖方法繁殖速度慢,并且有严重的根癌病[2]。感病后樱花植株根系发育不良,地上部分生长缓慢,树势衰弱,严重时叶片黄化,早落,甚至全株枯死。该病严重影响苗圃苗木的质量和果园树体的整齐度,重茬苗圃发病率在 20%~100%,严重的甚至造成毁园。到目前樱花根癌病尚未找到经济、有效的化学或物理的方法来防治,这给广大种植户造成了严重的经济损失,大大挫伤了农民的积极性。研究表明,种植抗病品种是综合防治该病的有效途径,可有效抵抗根癌菌的侵染[3]。然而抗性品种的数量有限,在生产中迫切需要一条简便、快捷的技术来加快抗病材料的大量繁殖。植物组织培养技术是快速繁殖优良树种的理想途径,同时也是通过遗传操作获得转基因植物,从而改良树种的前提条件[4]。开展樱花抗根癌病组织培养技术研究,将有利于加速抗病良种的推广进程。
国内黄宇翔等对福建山樱花(Prunus campanulata Maxim)的组织培养技术进行了系统的研究,并建立了规模化繁殖体系[5~7]。王永清等对嫁接在樱桃上的两年生樱花幼树进行取材,获得了日本樱花的丛生芽[8];而姚连芳等也对樱花的组培技术进行了研究,获得了可喜的技术成果[9]。笔者参考相关资料,建立了日本樱花组培快繁技术体系,为进一步开展樱花抗根癌病育种工作提供技术支持。
1 材料与方法
1.1 实验材料
于 2008年 3月 ~2009年 3月,在不同季节取成年日本樱花当年抽出的新梢为外植体,材料源于宁波四明山日本樱花种植基地。
1.2 实验方法
1.2.1 外植体的灭菌
方法 1:取日本樱花新梢中上部发育充实,尚未萌发抽生两次新梢的腋芽,在流水中冲洗 24 h,用70%乙醇和 0.1%HgCl2(加适量吐温 -20)灭菌,处理方法见表 1。
方法 2:先用自来水冲洗干净同一天早上、中午、晚上采摘的外植体的表面,剪去老枝及叶片,用洗洁净溶液浸泡 10 min,在用刷子蘸洗洁净溶液清清刷洗腋芽及茎段,将刷洗好的芽按自然生长方向置于烧杯中待用。采摘时间分别为:早上 7:00;中午 12:00;晚上 19:00。
方法 3:先用自来水冲洗干净同一天中午 12:00采摘的外植体的表面,剪去老枝及叶片,用洗洁净溶液浸泡 10min,在用刷子蘸洗洁净溶液清清刷洗腋芽及茎段,将刷洗好的芽按自然生长方向置于烧杯中,基部用灭过菌的滤纸包裹,套上保鲜袋,放入4℃的冰箱低温冷藏待用。冷藏时间分别为:1 d、2 d、3 d和 4 d。
以上材料经过无菌处理后均接种至:MS+NAA 0.05mg◦ L-1+6-BA2.0mg◦ L-1诱导培养基中[9~10]。
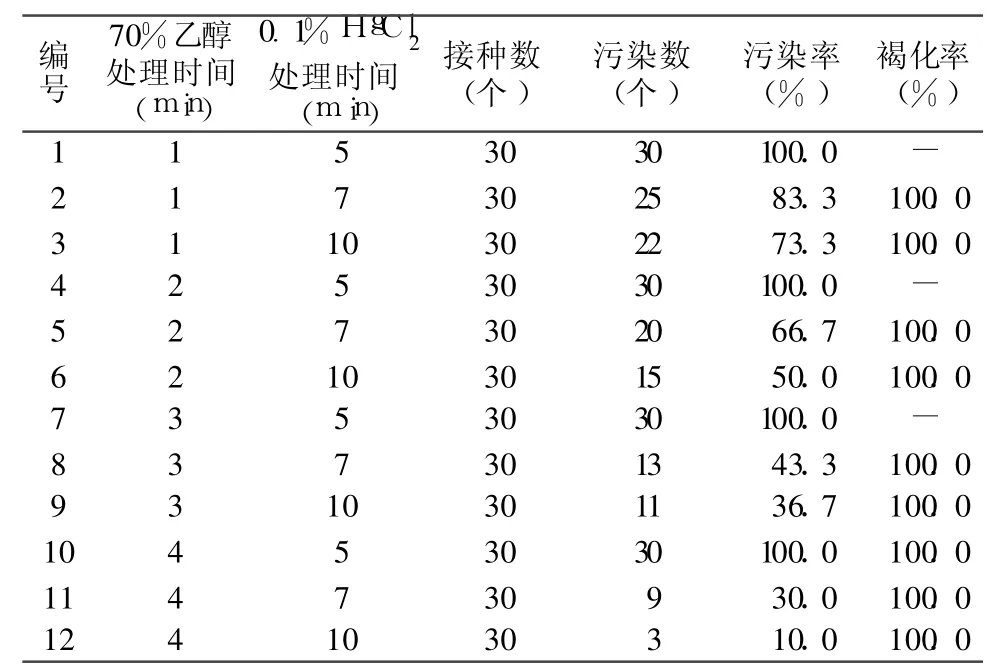
表 1 不同灭菌方法对日本樱花外植体的影响
1.2.2 最适合培养条件的筛选
将获得的已经萌芽的茎段置于附加有不同种类、浓度植物激素的培养基上,观察各种因子对日本樱花丛生芽增殖、丛生芽生长以及生根的影响。
1.3 培养条件
经过灭菌处理后的离体材料培养于 200ml的培养瓶中进行光照培养。诱导培养基、增殖培养基的基本培养剂为 MS,白糖为 30 g◦L-1,而在生根阶段,基本培养基为 1/2MS,白糖为 15 g◦L-1。在整个培养过程中,pH值为 5.8,温度 25℃ ±1℃、光照强度为 40μmol◦m-2◦ s-1、每日光照 14 h的条件下培养。
1.4 数据统计
接种 1周后统计污染率,1个月后统计褐变率(褐变率 =褐变外植体数/未污染外植体数 ×100%),每种处理不少于 30个外植体,重复 3次。茎段在分化培养基上培养 30 d后,统计其分化率(分化率 =腋芽生长的茎段数/接种的总茎段数 ×100%),腋芽在增殖培养基上培养时,统计其增殖系数(增殖系数 =丛生芽总数/接种腋芽总数),每种处理至少 30个外植体,重复 3次。
2 结果与分析
2.1 日本樱花无菌材料的获得
将不同灭菌方法处理的日本樱花茎段接入1/2 MS培养基中,每天观察外植体的污染状况作好记录。接种 10 d以后,外植体的污染状况基本稳定。从表 1所反映的结果可以看出,日本樱花无菌体系比较难建立。主要因为茎段带菌量大,同时成年枝条叶腋部不容易消毒,且保护物质较多从而导致绝大多数外植体出现褐化、坏死现象,因此外植体的存活问题成为系统研究日本樱花组织培养的重要障碍。实验表明,采用乙醇和升汞混合使用的方法时,尽管随着两种灭菌剂处理的时间加长,污染率有所下降,但茎段均全部褐化。通过不同灭菌时间的筛选研究可知,70%乙醇处理 3 min、0.1%HgCl2处理10分钟是较为理想的消毒处理方式,污染率相对较低为 36.7%,而褐化程度最轻。而 70%乙醇处理 4 min、0.1%HgCl2处理 10 min,虽然污染率最低,仅有 10%,但茎段全部坏死。
针对日本樱花茎段灭菌后易褐化的现象,从外植体材料的处理入手探讨建立日本樱花无菌培养物的方法。由表 2结果可知,取材时间的不同、外植体冷藏时间的不同对日本樱花初代培养无菌茎段的获得有重要的影响。实验表明,中午 12:00取材褐化率最低;冷藏时间越长灭菌后材料的褐化率越低,但冷藏时间过长容易导致茎段不能萌芽。一般而言,将在中午 12:00采集的茎段冷藏 2d,经过灭菌处理可获得少数可长出腋芽的无菌茎段。
2.2 激素种类及其浓度对日本樱花丛生芽增殖的影响
将抽出的腋芽连同茎段转接到添加有不同浓度的 6-BA、NAA和 GA3的 MS培养基上进行增殖培养。在适宜的增殖培养基中,腋芽不但能够迅速增殖,而且形成的新芽能够同时长大,接种后 30 d,新芽伸长 2 cm~2.5 cm,每芽的叶片数可达到 6片 ~8片,且叶色嫩绿。形成的新芽继续以单芽或丛芽的方式继续转接至增殖培养基中,又可形成丛芽,如此反复,可在短期内获得大量的樱花丛生芽。表 3表明,培养基中添加的激素浓度和种类的不同,对日本樱花增殖有较大影响。低浓度的 6-BA不利于日本樱花丛生芽的增殖,这与福建山樱花丛生芽增殖所用的激素水平不一致[7],这可能与取材以及基因有关。而当培养基 NAA浓度为 0.4 mg◦L-1时则出现严重的愈伤组织,但 NAA在 0.2 mg◦L-1时尽管有少量愈伤组织,但形成的丛生芽生长缓慢,且茎段很难伸长。添加适当 GA3时则可促进丛生芽的分化和茎段伸长,但浓度高时则容易形成大量愈伤组织。实验结果表明,MS+6-BA4 mg◦L-1+NAA 0.34mg◦ L-1+GA30.05mg◦ L-1是日本樱花丛生芽增殖的最佳组合,增殖系数可达到 6.3。
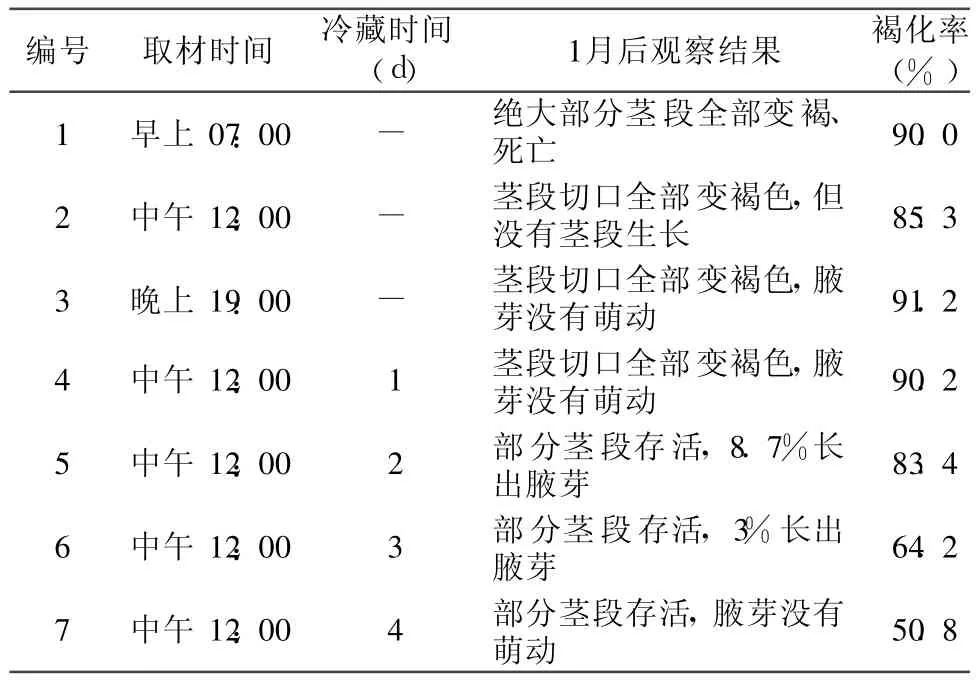
表 2不同预处理改善日本樱花茎段褐化效果

表 3 外源激素对樱花丛生芽增殖的影响
2.3 日本樱花组培苗根的诱导
将生长至 3 cm~3.5 cm的日本樱花丛生芽转移至大量元素减半的、添加有不同浓度生长素的生根培养基中。结果表明,一定浓度IBA和 NAA同时使用可大大提高日本樱花组培苗的生根率见表 4。由表 4可知,只添加 0.2 mg◦L-1IBA时,组培苗的生根率很低,仅有 30.2%,且形成的根细小,生长缓慢;当培养基加入一定浓度的 NAA时,日本樱花组培苗生根率显著提高。实验表明,当 IBA一定时,组培苗的生根率随着 NAA浓度的增加而增加,但组培苗切口愈伤组织也随之严重。综合分析认为:1/2 MS+IBA 0.2mg◦ L-1+NAA0.6mg◦ L-1是福建樱花组培苗最佳的生根培养基。在此培养中,组培苗的生根率可达到 90.1%,且愈伤组织少,根粗壮,炼苗时容易成活。
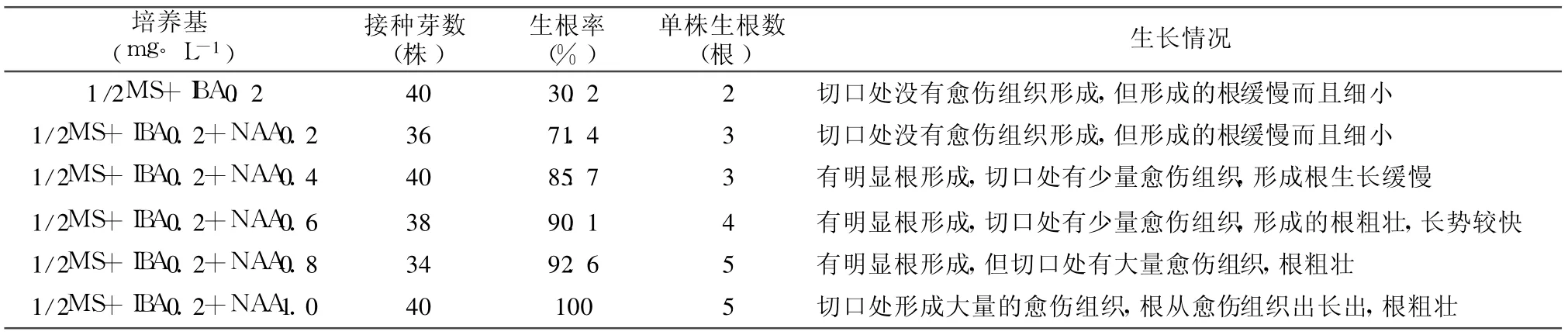
表 5 外源激素对樱花丛生芽增殖的影响
3 结语
利用成龄植物茎段作为外植体建立日本樱花离体培养系统,遇到的主要问题为外植体容易污染、易褐化死亡、丛生芽茎段不易伸长等,克服这些障碍是建立樱花再生体系的关键技术。
污染和褐化是植物组织培养过程中主要困难,许多学者进行了深入研究,但至今还未找到单一有效的方法来克服这些问题[11]。本实验结果表明,采用较长时间的 75%酒精浸泡和 0.1%升汞处理可获得部分无菌的茎段,而在中午取材、4℃冰箱冷藏处理 2 d可获得 8.7%长出腋芽的无菌茎段。这样处理一方面可利用酒精的渗透力使得升汞渗入茎段腋芽部分,另一方面还有充分发挥酒精本身的杀菌效果,但酒精和升汞处理时间太长易导致外植体材料死亡。而特定时间取材和将材料进行冷处理可减少外植体本身抑制物质的产生,降低灭菌后材料的褐化率和死亡率。
一般而言,丛生芽的增殖研究是植物组培再生体系建立的关键环节,是植物快速增殖的根本。本研究表明,高浓度的细胞分裂素有利于日本樱花腋芽的增殖:6-BA浓度在 4mg◦L-1、NAA浓度为0.3mg◦L-1可获得增殖系数高、生长旺盛的丛生芽;当 NAA浓度在 0.4mg◦L-1以上时则容易导致丛生芽形成大量愈伤组织,低于 0.2 mg◦L-1时丛生芽生长缓慢,这与姚连芳[9]得出 6-BA浓度 0.5 mg◦L-1~3.0 mg◦ L-1,NAA0.05 mg◦ L-1~0.3 mg◦L-1这一结论不相符合。其中的差异有可能与实验所选择的材料不同有关。同时,日本樱花的丛生芽茎段不易伸长,这现象在 Prunus属其它植物上也有报道[12],在培养基中添加加一定 0.05mg◦L-1GA3,就可得到解决。
植物激素中,生长素对根的形成具有重要作用[13]。在一定范围内,试管苗的生根率与生长素在培养基中的含量呈正相关;过量时,则会形成大量的愈伤组织团块而导致输导组织不畅,影响苗木生长和移栽成活。本实验表明:NAA大于 0.8 mg◦L-1时,日本樱花组培苗切口处形成大量愈伤组织;而单独使用 IBA不利于根的形成。在本实验体系中,1/2MS+IBA 0.2 mg◦ L-1+NAA 0.6 mg◦ L-1是日本樱花组培苗理想的生根培养基,生根率可达到90.1%。
[1] 俞德浚.中国植物志[M].北京:科学出版社,1986.
[2] 吴文佑,朱天辉.重大植物病害及其研究进展[J].世界林业研究,2006,26~32.
[3] 王慧敏.植物根癌病的发生特点与防治对策[J].世界农业,2000,28~30.
[4] 王明庥.林木遗传育种学[M].北京:中国林业出版社,2001,278~286.
[5] 黄宇翔,刘金燕,卓小丽,等.福建山樱花组培快繁研究[J].林业科学,2006,162~164.
[6] 邹娜,徐楠,曹光球,等.福建山樱花试管苗生根条件的优化[J].江西农业学报,2008,20(4):26~29.
[7] 吕月良,陈 璋,施季森,等.福建山樱花不定芽诱导和植株再生规模化繁殖试验[J].南京林业大学学报:自然科学版,2006,30(3):105~108.
[8] 王永清,汤浩茹,邓群仙,等.樱花离体培养芽外植体的建立[J].四川农业大学学报,1997,l5(3):341~344,387.
[9] 姚连芳,张建伟,冷天波.樱花组培快繁生产技术[J].林业实用技术,2004,27~28.
[10] Murashige T,Skoog F.A revised medium for rapid growth and hioassays with tobacco tissueculture[J].Physio Plant,1962,15:473~497.
[11] 杨丽琴,李瑞,王俊,等.植物组织培养的三大难题[J].北方园艺,2008(4):104~1.
[12] Jona,R.&Vig1iocco,R.Axillary budcu1ture of peach.Acta Horticu1turae,l985:173,223~228.
[13] 陈正华.木本植物组织培养及其应用[M].北京:高等教育出版社,1986:34~49.

