膀胱憩室癌的诊断及治疗(附15例报告)
马春磊,徐 勇,刘冉录,张志宏,谢晓强
(天津医科大学第二医院,天津 300211)
膀胱憩室癌临床较少见,但其恶性程度较高。1995年 2月 ~2010年 3月,我们共收治 15例,占同期收治膀胱恶性肿瘤的0.53%(15/2 856)。现报告如下并结合文献探讨其诊治方法。
1 资料与方法
1.1 临床资料 本组15例中,男13例,女2例;年龄 50~85岁,平均 71岁。以肉眼血尿就诊者 13例,其中间歇性无痛性全程血尿 8例,间歇性全程血尿伴尿频、尿急、尿痛 3例,肉眼血尿伴排尿困难 2例;反复尿路感染1例,无肉眼血尿史;在外院行经尿道膀胱憩室肿瘤电切后膀胱镜复查发现膀胱憩室肿瘤1例。
1.2 检查方法 常规查体无阳性发现。B超检查15例,均发现膀胱憩室,其中 11例发现憩室内实性占位,1例为盆腔实性肿物并与左侧膀胱壁关系密切。合并前列腺增生 7例、结石 2例。行泌尿系造影检查 12例,憩室腔内有较明显的充盈缺损 6例,有憩室影,但憩室腔内未见明显充盈缺损 6例,可见憩室内结石影 2例。CT检查13例,均发现膀胱憩室和憩室内的软组织块影,CT值为30~45 HU,增强扫描后CT值为60~75HU,肿瘤有不同程度的增强。其中 1例憩室位于膀胱左侧壁,与直肠及乙状结肠关系密切。尿脱落细胞检查 14例,10例可见瘤细胞。膀胱镜检查 15例,均发现膀胱憩室,位于膀胱右侧壁 5例,其中 1例靠近右输尿管开口,位于左侧壁 4例、后壁 5例、膀胱三角区 1例。憩室口径0.5~4.5 cm,平均2.4 cm。7例膀胱镜能进入憩室腔内,其中 2例见憩室腔内乳头样肿物,分别为 1.5 cm×2.0 cm×1.5 cm和1.0 cm×2.0 cm×1.5 cm,有蒂;2例憩室内肿物呈菜花状,分别为2.0 cm× 2.5 cm×2.0 cm和1.5 cm×2.0 cm×2.5 cm,覆于憩室壁表面,无蒂;1例憩室内有 2处菜花样肿物,分别为4.0 cm×2.0 cm×2.0 cm和1.5 cm×2.0 cm×1.0 cm,彼此不相连,均附着于憩室壁,无蒂;1例系多发肿瘤;1例可见憩室内数粒结石,大小不一。此 7例中 5例膀胱镜下活检成功。另外 8例中3例因憩室口狭小、5例因憩室口位置等无法活检,且也未能观察到憩室内肿瘤,术中行肿瘤组织快速冰冻检查确诊,术中见膀胱憩室壁均较薄,肌层发育不良。
1.3 治疗方法 15例均行手术治疗。行经尿道膀胱憩室癌电切术 4例,膀胱部分切除术 5例(其中 1例同时行左输尿管移植术),根治性膀胱全切术 +回肠原位新膀胱再造术 3例,根治性膀胱全切术 +双侧输尿管皮肤造口术 2例,1例术中见肿瘤已浸润直肠和乙状结肠,无法手术切除,行耻骨上膀胱造瘘术。行经尿道膀胱憩室肿瘤电切术和膀胱部分切除术的患者术后均给予膀胱内灌注化疗(吡柔比星30mg或羟喜树碱20 mg溶于50m l蒸馏水中,经导尿管排空膀胱后注入,保留1 h,其间每15min变换体位 1次),1次/周、共 6次,以后 1次/月、共 12次;腺癌者术后辅以全身化疗;混合癌者术后辅以放疗和全身化疗,吉西他滨1 200mg/m2,第1、8天静滴,顺铂25 mg/m2,第1~3天静滴,21 d为 1个疗程,连续 4~6个疗程。15例术后每 3个月复查 1次,1 a后每6个月复查 1次。均行泌尿系B超检查,有异常发现者行膀胱镜检查,不能行膀胱镜检查者行盆腔CT检查。经尿道膀胱憩室肿瘤电切术的患者术后每 3个月行膀胱镜检查 1次。
2 结果
15例术后均获随访,随访时间为 6~72个月,平均 30.1个月。其手术方法和预后见表1。
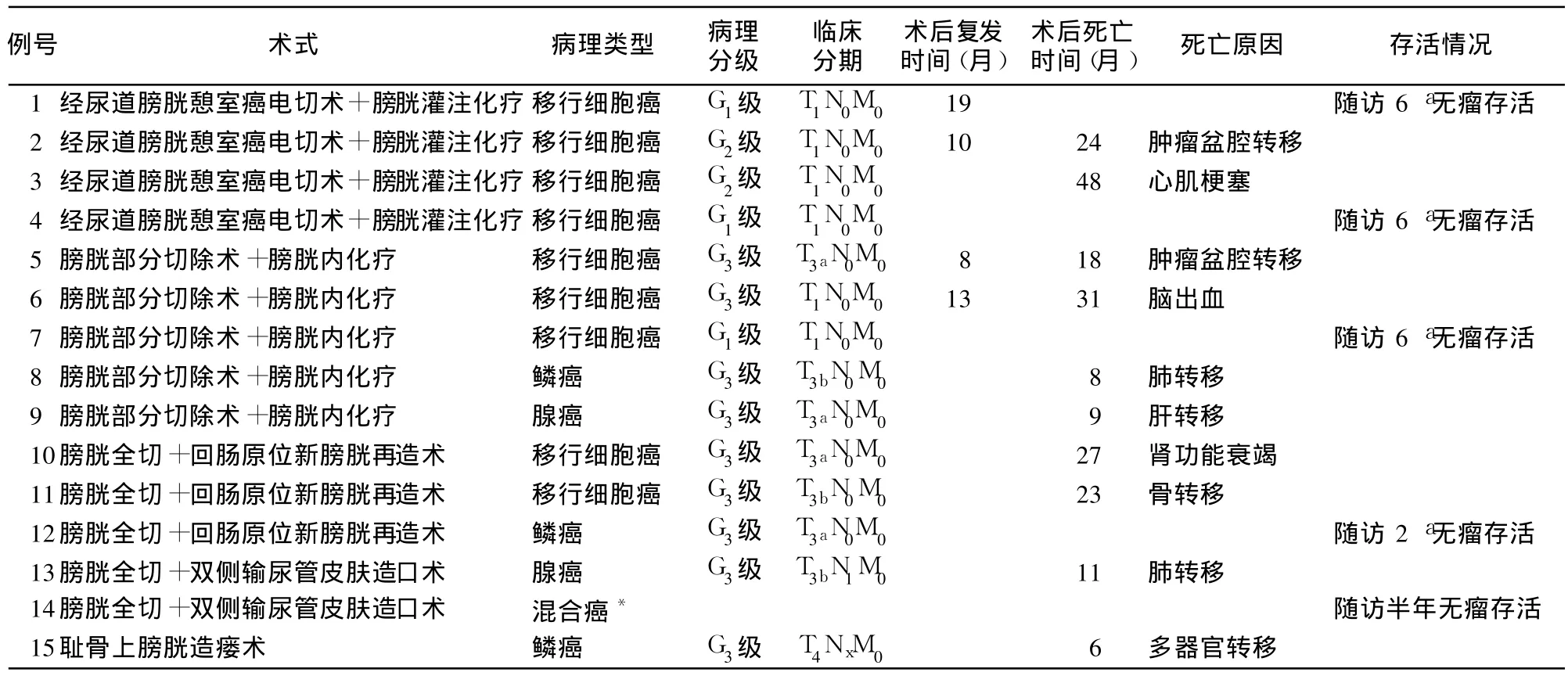
表1 本组 15例手术方式、病理检查结果及预后
3 讨论
临床上最常见的膀胱憩室癌为移行细胞癌(约78%),其次为鳞癌(约17%)、混合癌(2%)和腺癌(2%)[1]。本组中移行细胞癌 9例、鳞癌 3例、腺癌2例、混合癌 1例。由于膀胱憩室肌层薄弱或者肌层发育不全,肿瘤极易从上皮组织侵犯到膀胱周围组织,或发生远处转移,故膀胱憩室癌恶性程度较高,预后差。
3.1 膀胱憩室癌的诊断 肉眼血尿是膀胱憩室癌的重要临床表现[2]。由于继发性膀胱憩室的形成与下尿路梗阻有关,故该病还常伴有排尿困难及泌尿系感染的症状。因此,对合并血尿的膀胱憩室应考虑到本病存在可能。本组中有 13例发病时有肉眼血尿。
B超是膀胱憩室肿瘤的初步筛查手段,可探及膀胱壁向腔外的囊性突出及实质性肿物,可发现直径>1 cm的肿瘤,了解肿瘤大小、部位、侵犯膀胱壁的深度。膀胱造影可发现膀胱憩室及憩室内肿瘤,表现为憩室腔内充盈缺损。本组均行 B超检查,均发现膀胱憩室,其中发现有占位性病变11例,行泌尿系造影检查 12例,发现膀胱憩室和憩室内充盈缺损 6例,未能诊断 6例。因憩室位置欠佳或憩室口较小;肿瘤生长充满憩室;造影时间不够,造影剂尚未完全充盈膀胱等,均可影响其诊断的准确性。CT对膀胱憩室及肿瘤具有较高的准确性,表现为憩室内实性软组织肿物,增强 CT可见肿瘤不规则强化,憩室壁或憩室颈部厚,肌层发育不良或缺损[3]。主要用于肿瘤的诊断与分期。本组 CT检查13例,诊断率为100%。
膀胱镜检查是诊断膀胱憩室癌该病的最直接和最常用的方法[4],可直接观察憩室口径大小及憩室内肿瘤位置、形态、大小等,还可活检,明确肿瘤细胞类型,初步判定肿瘤分级及恶性程度,为制定手术方案提供依据。但憩室口较小,憩室癌小且附有结石或有较多血块时膀胱镜插入及活检困难。对不能在膀胱镜下活检者应尽量选择术中冰冻切片确诊。本组均行膀胱镜检查,膀胱镜活检确诊 5例,余术中冰冻切片确诊。
3.2 膀胱憩室癌的治疗方法 膀胱憩室癌的治疗方法有手术切除如经尿道憩室内肿瘤电切术、围绕憩室膀胱部分切除及膀胱全切[5]和局部及全身化疗及放疗。笔者认为,对Ta期、T1期 G1级、T1期G2级的移行细胞癌患者,只要膀胱憩室直径足够大,颈宽,操作小心,可行经尿道膀胱憩室癌切除术联合术后膀胱内灌注化疗。对 T1期 G3级、T2期的移行细胞癌患者可行围绕憩室膀胱部分切除术,安全切缘至少2 cm,憩室和围绕憩室口的部分正常膀胱壁应一并切除,必要时术中活检证明切缘安全[6]。对 T3期肿瘤及所有非移行细胞癌的膀胱憩室癌,因预后不佳,应尽可能行膀胱全切加盆腔淋巴结清扫术。对憩室与周围组织粘连紧密而难以切除膀胱者,仅行膀胱造瘘术,姑息治疗。根据肿瘤临床分期和病理类型术后辅以膀胱灌注化疗、全身化疗及放疗。
总之,膀胱憩室癌是一种罕见的恶性肿瘤,公认的预后因素为病理类型和临床分期,早期诊治是改善预后的关键。熟悉本病的临床病理学特点,对 Ta期、T1期G1级、T1期G2级的移行细胞癌,行电切术并术后膀胱灌注化疗可使大部分患者达到长期无瘤生存。T3期的移行细胞癌患者以及所有非移行细胞癌患者应行根治性膀胱切除术,必要时辅以放化疗以提高患者生存期,改善其生活质量。
[1]Shirai T,Arai M,Sakata T,et al.Primary carcinoma of urinary bladder diverticula[J].Acta Pathol Jpn,1984,34(2):417-424.
[2]Gadler T,Keedy M,Rivas N.A case of hematuria[J].Adv Emerg Nurs J,2010,32(1):30-41.
[3]李葆青,陈巨坤,张祥.泌尿系少见肿瘤和肿瘤样病变的螺旋CT诊断[J].中国医学影像学杂志,2007,15(4):287-291.
[4]Dondalski M,White EM.Ghahremani GG,et al.Carcinoma arising in urinary bladder diverticula:imaging findings in six patients[J]. Am JRoentgenol,1993,161(4):817-820.
[5]Golijanin D,Yossepowitch O,Beck SD,et al.Carcinoma in a bladder diverticulum:presentation and treatment outcome[J].JU rol, 2003,170(5):1761-1764.
[6]何于成,杨朝东,熊艳春,等.膀胱憩室癌的诊断与治疗(附5例报告)[J].岭南现代临床外科,2006,6(2):136-137.

