pGEX-4T-2-TK原核表达质粒的构建及其表达*
钟俐强,杨斯皓,贾钰铭,吴敬波
(四川省宜宾市第二人民医院肿瘤科 644000)
pGEX-4T-2-TK原核表达质粒的构建及其表达*
钟俐强,杨斯皓,贾钰铭,吴敬波△
(四川省宜宾市第二人民医院肿瘤科 644000)
目的构建含胸苷激酶基因(TK自杀基因)的pGEX-4T-2-TK原核表达质粒,观察其在大肠杆菌中表达情况,为肿瘤基因治疗奠定基础。方法聚合酶链式反应(PCR)扩增TK基因片段,利用限制性内切酶BamHⅠ和SalⅠ将其连接至原核表达载体pGEX-4T-2内,再将连接产物转化入大肠杆菌,挑取单菌落,提取质粒,经PCR和双酶切鉴定后测序。将转化正确的大肠杆菌培养过夜,异丙基-β-D-硫代半乳糖苷(IPTG)诱导后观察蛋白表达情况。结果TK基因片段成功连接至载体pGEX-4T-2中,在大肠杆菌BL21中可得到稳定表达的目的蛋白。结论pGEX-4T-2-TK原核表达质粒构建成功,为后续肿瘤基因治疗研究奠定了基础。
自杀基因;质粒构建;聚合酶链式反应
目前放疗与化疗为恶性肿瘤的主要治疗手段,但肿瘤中乏氧细胞的存在是导致放、化疗失败的重要原因。基因治疗的出现给恶性肿瘤的治疗提供了新的思路[1]。TK基因是近年来研究最多的自杀基因,全称为人类单纯疱疹病毒胸苷激酶基因(HSV-tk),可与更昔洛韦(ganciclovir,GCV)一起组成HSV-tk/GCV自杀基因系统[2]。为此,本实验将TK基因插入到原核表达载体pGEX-4T-2内,并观察其在大肠杆菌BL21中的蛋白表达情况,为进一步研究将构建好的重组质粒转染厌氧菌(如双歧杆菌)后能否解决肿瘤乏氧区放、化疗抗拒,以为提高治疗效果打下基础。
1 材料与方法
1.1 材料
1.1.1 质粒与载体 质粒pORF-HSVtk购自Invivogen公司,表达型质粒载体pGEX-4T-2由四川大学华西医学部公共卫生院汪川老师惠赠,大肠杆菌BL21由四川泸州医学院附院分子生物学中心实验室提供。
1.1.2 主要试剂 质粒小提试剂盒、胶回收试剂盒购自OMEGA公司;聚合酶链反应(PCR)扩增试剂盒、BamH I、Sal I限制性内切酶、T4 dNA连接酶购自TaKaRa公司;LB培养基购自青岛海博公司;SDS-PAGE电泳全套试剂盒购自天根生化公司,引物按照分子克隆实验指南引物设计原则,并且加入特定的酶切位点,由赛百盛生物公司合成。
上游引物:5′-CGCGGATCC ATGGCCTCGTACCCCGGCCATCAACAC-3′BamH I;下游引 物:5′-ACGCGTCGAC TCAGTTAGCCTCCCCCATCTCCCGGG-3′Sal I。
1.2 方法
1.2.1 pORF-HSVtk、pGEX-4T-2质粒的抽提 大肠杆菌DH5α100μ L加入50 mL LB液体培养基,250 r/min 37℃摇菌过夜。用OMEGA公司质粒小提试剂盒提取质粒(按说明书进行操作)。
1.2.2 目的基因片段的扩增及回收 以pORF-HSVtk质粒DNA为模板,PCR扩增TK基因片段。50 μ L反应体系中含10×PCR buffer(Mg2+plus)5 μ L、质粒 DNA 模板 1.0 μ L、dNTP(2.5 mM)4μ L 、上下游引物各 1 μ L、TaqDNA 聚合酶(2 u/μ L)1 μ L。反应参数:94℃预变性 5 min后,94℃变性60 s,55℃退火90 s,72℃延伸75 s,35个循环后,72℃最终延伸20 min。将PCR产物进行1%琼脂糖凝胶电泳,紫外线灯下切割含有目的条带的凝胶块,利用凝胶回收试剂盒进行目的片段回收。
1.2.3 目的基因片段与载体连接及鉴定BamH I、Sal I限制性内切酶双酶切目的基因片段和pGEX-4T-2载体,后在T4 dNA连接酶作用下,16℃连接过夜,构建pGEX-4T-2-TK重组质粒。取连接产物转化至Nishimmra法[3]制备的大肠杆菌BL21感受态细胞中,涂布于含有氨苄青霉素(100 μ g/mL)的LB平板上过夜培养。选取平板上生长状态良好的单个阳性菌落适量扩增后提取质粒 DNA,行BamH I、Sal I限制性内切酶双酶切后,1%琼脂糖凝胶电泳观察酶切结果。
1.2.4 重组质粒测序 将鉴定正确的菌落接种至含有氨苄青霉素(100 μ g/mL)的 LB液体培养基中扩增.取适量菌液送测序。测序工作由英骏公司完成。
1.2.5 目的蛋白在大肠杆菌中的表达 (1)将携带有重组质粒pGEX-4T-2-TK的大肠杆菌接种至5 mL含有氨苄青霉素(100 μ g/mL)的 LB培养基中37℃过夜培养;(2)将过夜菌按1∶50比例分别接种到5 mL含相应抗生素的新鲜LB管中,37℃剧烈摇动培养1.5~3 h,至菌液的OD600 nm值达到0.6~0.8;(3)加IPTG诱导前从各管菌液中分别取出1 mL,保存在4℃冰箱中,作为未诱导对照;(4)在各管菌液中加入IPTG,使其终浓度为1 mM,25℃150 r/min诱导过夜;(5)分别用1.5 mL离心管收集诱导前后样品各1 mL,12 000 r/min离心1 min,弃去上清液,收集菌体;(6)在菌体沉淀中加入1×SDS上样缓冲液(可根据菌体沉淀量相应调整上样缓冲液量),重悬混匀,于100℃水浴煮沸6 min,SDS-PAGE上样前12 000 r/min离心2 min;(7)取 10~20 μ L上清液上样,进行 12%SDS-聚丙烯酰胺凝胶电泳;(8)0.1%考马斯亮蓝G-250染液染胶,脱色至蛋白条带清晰可见时,分析蛋白质表达结果。
2 结 果
2.1 PCR扩增目的片段结果 将PCR产物进行1%的含EB的琼脂糖凝胶电泳,紫外线灯下可见荧光条带,TK基因片段约为1 100 bp,扩增的片段大小与预计一致,见图1。
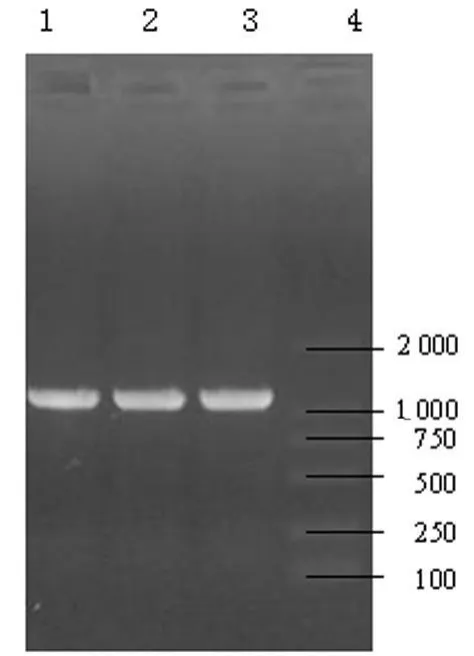
图1 TK基因的PCR扩增电泳图谱
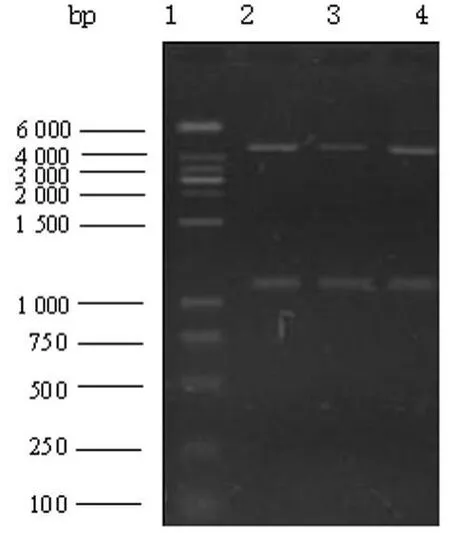
图2 pGEX-4T-2-TK重组质粒的双酶切
2.2 重组质粒的酶切鉴定 重组质粒pGEX-4T-2-TK分别用BamH I、Sal I酶切,切出片段约为 1 100 bp,4 900 bp,与预计大小一致,见图2。
2.3 重组质粒pGEX-4T-2-TK测序鉴定 DNA测序结果与GENBANK提供的TK基因序列完全一致,同源性达100%,从第25个碱基开始为TK基因序列,第19~24碱基为引物的5′端添加的限制性酶切位点 BamHⅠ,第 16~18碱基为引物的5′端添加的3个保护碱基;第15碱基之前为载体pGEX-4T-2上的序列。证明TK基因己成功克隆到克隆载体pGEX-4T-2内,见图 3。

图3 pGEX-4T-2-TK重组质粒测序鉴定部分序列结果
2.4 重组质粒pGEX-4T-2-TK在大肠杆菌中的表达 阳性转化菌经IPTG诱导培养后,行SDS-聚丙烯酰胺凝胶电泳,较未添加IPTG组可见目的蛋白条带产生,说明作者构建的原核表达质粒成功,可以表达目的蛋白,达到实验要求,见图4。

图4 pGEX-4T-2-TK蛋白在BL2l中的表达
3 讨 论
理想的肿瘤基因治疗载体应具备的最重要特性就是对宿主无毒性以及对肿瘤的高度靶向性[4]。现阶段肿瘤基因治疗载体系统主要包括病毒载体系统[5]和非病毒载体系统,病毒载体系统包括逆转录病毒载体、腺病毒载体、腺相关病毒载体及单纯疱疹病毒载体,其中腺病毒载体为目前应用最广泛的病毒载体[6-7]。其优点是高效转染和高效表达,缺点是腺病毒在感染增殖较快的肿瘤细胞同时,也会感染机体增殖快的正常细胞,如上皮细胞,导致一些急性毒性反应,同时由于其自身的免疫原性,多数人群接触过病毒后体内会产生病毒特异性抗体,再次应用同一种病毒载体会被首次应用产生的大量免疫中和抗体所中和;而且给药途径也存在着诸多问题,通过静脉输入病毒载体是否安全,尚未得到确认,目前临床试验只能靠局部瘤内注射给药。因此病毒载体的毒性反应、免疫反应及给药途径限制了病毒载体在临床上的应用[8]。非病毒载体系统包括:裸DNA、脂质体、多聚物及分子耦联体,临床试验中最常用的是真核细胞表达质粒[9]。非病毒载体的优点是安全、制备简单和携带外源基因较大;缺点是靶向性差,基因导入体内后转染效率低、表达水平不够理想。
研究表明绝大多数实体瘤因肿瘤实质细胞增生迅速,而血管形成相当缓慢,造成实体瘤内部大面积缺氧[10]。双歧杆菌属厌氧菌属,能靶向聚集至肿瘤乏氧区域[11]。在安全性方面,双歧杆菌对人体来说是肠道益生菌,不会产生不良反应。Sasaki等[12]将转染前药转换酶基因的长双歧杆菌通过尾静脉注射到豚鼠体内,未见任何过敏反应出现,也未检测到由双歧杆菌介导产生的特殊抗体。因此本实验用双歧杆菌作为基因治疗运载体将TK自杀基因靶向运至肿瘤组织,文献报道双歧杆菌自身具有抗肿瘤作用[13-14],康保国等[15]研究表明TK基因可经放射诱导表达,可以与放疗产生协同作用,进一步提示其是一个很有前途的肿瘤基因治疗运输载体。但双歧杆菌是原核生物,因此必须要原核表达质粒才能在双歧杆菌体内表达。基于此,本实验选用了pGEX-4T-2原核表达质粒,因为该质粒带有非常强的tac启动子,融合蛋白表达系统可以克服转录与转录后水平对外源基因表达可能带来的不利影响,便于融合基因翻译起始,是一种高效的蛋白表达载体,且便于目的蛋白的进一步分离纯化。目前TK基因主要与腺病毒基因重组后,再结合前药更昔洛韦观察体外对肿瘤细胞的杀伤作用,尚无TK基因与pGEX系列载体重组的报道。安丽娜等[16]研究表明,将胞嘧啶脱胺酶(CD)自杀基因与pGEX载体重组后再转入双歧杆菌,自杀基因能很好表达,对黑色素瘤细胞有较强的杀伤力。因此将构建好的pGEX-4T-2-TK原核表达质粒转入双歧杆菌后,可望克服病毒载体不能静脉给药的局限,实现载体安全性与靶向性的统一。
本实验构建的pGEX-4T-2-TK原核表达载体,经过双酶切、PCR扩增、测序等鉴定表明重组质粒构建成功,并在大肠杆菌BL21内能稳定表达,为进一步研究转入双歧杆菌后能否靶向杀伤恶性肿瘤细胞打下了基础。
(志谢:感谢泸州医学院附属医院肿瘤科放射生物与生物治疗实验室杨玲麟博士及汪碧琼老师对本研究提供的技术性帮助。)
[1] Weber W,Fussenegger M.Pharmacologic transgene control systems for gene therapy[J].J Gene Med,2006,8(5):533.
[2] Wang J,Lu XX,Chen DZ,et a1.Herpes simplex virus thymidine kinase and ganciclovir suicide gene therapy for human pancreatic cancer[J].World J Gastroenterol,2004,10(3):400.
[3] 卢圣栋.现代分子生物学实验技术[M].2版.北京:中国协和医科大学出版社,2001:292.
[4] Inoue M,Mukai M,Hamanaka Y,et a1.Targeting hypoxic cancer cells with a protein prodrug is effective in experimental malignant ascites[J].Int J Oncol,2004,25(3):713.
[5] Mancheno-Corvo P,Martin-Duque P.Viral gene therapy[J].Clin T ransl Oneol,2006,8(12):858.
[6] Liu XY.Targeting gene-virotherapy of cancer and its prosperity[J].Cell Res,2006,16(11):879.
[7] 王祎琴,洪苏玲.重组腺病毒相关病毒载体基因治疗研究进展[J].重庆医学,2006,35(2):179.
[8] Hackett NR,Kaminsky SM,Sondhi D,et a1.Antivector and antitransgene host responses in gene therapy[J].Curr Opin M ol Ther,2000,2:376.
[9] Wechuck JB,Ozuer A.Effect of temperature,medium composition,and cell passage on production of herpesbased viral vectors[J].Biotech and Bioengin,2002,79(1):112.
[10] Nuyts S,Van Mellaert L,Theys J,et al.Clostridium spores for tumor-specific drug delivery[J].Anticancer Drugs,2002,13(2):115.
[11]Li X,Fu GF,Fan YR,et al.Bifidobacterium adolescentis as a delivery system of endostatin for cancer gene therapy:selective inhibitor of angiogenesis and hypoxic tumor growth[J].Cancer Gene Ther,2003,10(2):105.
[12]Sasaki T,Fujimori M,Hamaji Y,et al.Genetically engineered Bifidobacterium longum for tumor-targeting enzyme-prodrug therapy of autochthonous mammary tumors in rats[J].Cancer Sci,2006,97(7):649.
[13]Abd el-Gawad IA,el-Sayed EM,Hafez SA,et al.Inhibitory effectofyoghurt and soya yoghurt containing bifidobacteriaon the proliferation ofEhrlich ascites tumour cells in vitro and in vivo in a mouse tumour model[J].Br J Nutr,2004,92(1):81.
[14]Wang Y,M ai T,Liu MF,et al.Effect of lipoteichoic acid of Bifidobacterium on survivin and its regulatory genes[J].Zhonghua Zhong Liu Za Zhi,2007,29(5):325.
[15]康保国,王卫东,陈正堂,等.放射诱导 HSV-TK基因在肺癌细胞中靶向、高效性表达的研究[J].重庆医学,2007,36(6):505.
[16]安丽娜,李著华,岳扬,等.婴儿双歧杆菌介导的CD和UPRT联合5-FC基因疗法对黑色素瘤的体外治疗实验研究[J].四川大学学报:医学版,2007,38(1):27.
Construction and expression of pGEX-4T-2-TK plasmid in procaryote*
Z HONG Li-qiang,Y ANG Si-hao,J I A Yu-ming,et al.
(Department of Oncology,Y ibin Second People's Hospital,Yinbin644000,China)
ObjectiveTo construct the plasmid of pGEX-4T-2-TK containing the TK suicide gene,and then to observe its expression in E.coli.MethodsThe TK suicide gene fragments were amplified from the plasmid of pORF-HSVtk by PCR.The PCR product was digested by the restriction endonucleases BamH I and Sal I.Then we used the same method to deal with the vector of pGEX-4T-2.The recombinant plasmid was transfected into E.coli.The recombinant plasmid was extracted and identified by PCR and enzyme-digestive method,and the sequence was measuerd.The E.coli with correct plasmid was cultured with IPTG over night to induce the protein's express.ResultsThe TK suicide gene fragments were correctly ligated with the vector of pGEX-4T-2.The purpose protein could be expressed stably.ConclusionThe plasmid of pGEX-4T-2-TK was constructed successfully.It will provide the basis for future study on treating carcinoma by transfect the recombinant plasmid into bifidobacterium.
suicide gene;plasmid construction;polymerase chain reaction
R730.54;R446.61
A
1671-8348(2010)09-1036-03
四川省卫生厅科研课题(0331)。△
,E-mail:wjb6147@163.com。
2009-08-30
2009-09-28)
◦论 著◦

