实验性自身免疫性脑脊髓炎小鼠发病高峰期外周及中枢淋巴细胞亚群的变化①
席娜娜 郑荣远 尚晓峰 王 潭 吕 锦 徐 德 吴正刚 陈国钱
(温州医学院附属第一医院神经内科,温州 325000)
实验性自身免疫性脑脊髓炎小鼠发病高峰期外周及中枢淋巴细胞亚群的变化①
席娜娜 郑荣远 尚晓峰 王 潭 吕 锦 徐 德 吴正刚 陈国钱
(温州医学院附属第一医院神经内科,温州 325000)
目的:观察髓鞘少突胶质细胞糖蛋白MOG35-55诱导的实验性自身免疫性脑脊髓炎小鼠发病高峰期中枢及外周淋巴细胞亚群的变化,探讨EAE发病高峰期细胞与体液免疫学的变化。方法:用MOG35-55免疫诱导雌性C57BL/6小鼠制作EAE模型,记录小鼠行为学变化,HE染色观察CNS炎症组织病理变化,使用流式细胞仪检测小鼠中枢及外周脾脏淋巴细胞中CD3+CD4+、CD3+CD8+、CD4+CD25+、B220+细胞亚群变化情况。结果:EAE组小鼠中枢神经系统有CD3+CD4+、CD3+CD8+、CD4+CD25+、B220+淋巴细胞的浸润,CFA阴性对照组中枢神经系统未检测到淋巴细胞浸润。EAE组小鼠外周脾细胞中CD3+CD4+、CD3+CD8+细胞较CFA阴性对照组减少(P<0.05),B220+细胞较CFA阴性对照组明显升高(P<0.01),CD4+CD25+细胞较CFA阴性对照组升高但无统计学差异。结论:小鼠在EAE发病高峰期,外周脾细胞中CD3+CD4+、CD3+CD8+阳性细胞明显减少,B220+明显升高,CD4+CD25+也开始有升高趋势,表明EAE发病高峰期细胞免疫及体液免疫共同调控了EAE的病理过程,T淋巴细胞与B淋巴细胞都起了很重要的主导作用。
实验性自身免疫性脑脊髓炎;淋巴细胞亚群;多发性硬化;T淋巴细胞;B淋巴细胞
多发性硬化(Multipule sclerosis,MS)是一种以中枢神经系统(Centralnervous system,CNS)白质炎性脱髓鞘为主要病理特点的自身免疫性疾病,其确切病因及发病机制尚未阐明。目前认为MS是由CD4+T细胞介导的自身免疫性疾病,激活的T细胞通过血脑屏障(Blood brain barrier,BBB)与中枢的抗原递呈细胞(Antigen presenting cell,APC),即小胶质细胞与星形胶质细胞呈递的靶抗原结合,继而产生炎症细胞因子的分泌,进一步促使巨噬细胞、B细胞的活化,导致神经组织的炎症脱髓鞘反应及神经轴索的损害。随着对MS研究的不断深入,B细胞在MS发病中的作用越来越受到人们重视。脑脊液中持续的鞘内免疫球蛋白(IgG)的合成和寡克隆区带的产生已成为一项诊断MS的重要免疫学指标。然而在MS中体液免疫及细胞免疫病理机制仍未完全阐明。
成熟T细胞可分为CD4+、CD8+T淋巴细胞,CD4+T细胞主要参与辅助作用(TH)及迟发超敏反应(TDTH),CD8+T细胞主要参与细胞毒作用(TC)及免疫抑制(TS)作用。CD4+与CD8+细胞的数量及比值的变化将影响到机体的免疫平衡。而CD4+CD25+细胞,即调节性T淋巴细胞可以抑制CD4+与CD8+细胞的增殖,在机体免疫平衡中也发挥着重要作用。
由于MS患者标本只能检测到患者外周血及脑脊液中淋巴细胞变化,限制了对MS中枢细胞病理机制的深入研究。目前MOG35-55诱导的实验性自身免疫性脑脊髓炎(Experimentalautoimmune encephalom yelitis,EAE)可模拟MS神经功能及病理学上的改变,是一种公认的MS动物模型[1]。我实验室已用MOG35-55成功诱导出稳定的小鼠EAE模型[2]。本实验通过对EAE组小鼠大脑、脊髓及外周脾细胞中淋巴细胞的分离及检测,试图分析在EAE发病过程中外周及中枢部分T、B淋巴细胞亚群的变化。
1 材料与方法
1.1 实验动物、主要试剂及仪器 SPF级野生型C57BL/6小鼠(由美国波士顿大学医学中心提供),雌性,6~8周龄,体重18~20克,12只。MOG35-55,纯度>95%(MEVGWYRSPFSRVVHLYRNGK),购于西安联美生物科技有限公司;人结核分枝杆菌(Mycobacterium tuberculosis,H37RA)购于美国Difco公司;不完全弗氏佐剂(Freund′s ad juvant incomplete,IFA)、百日咳毒素(Pertussis toxin,PT)、淋巴细胞分离液(Percoll液)购于Sigma公司;淋巴细胞表面标记抗体CD3(APCHamsteranti-mouse)、CD4(FITCanti-mouse)、CD8(PE anti-mouse)、CD25(APC anti-mouse)、CD25 对照(APC Rat IgG1 Isotype Control)、B220(PE-Cy5.5 anti-mouse/humanCD45R)购于美国eBioscience公司;流式细胞仪(FACSCalibur)为BD公司产品;水平离心机为Beckman公司产品。
1.2 EAE模型制作 小鼠分组:野生型EAE组6只;野生型CFA阴性对照组6只。
抗原配制及EAE模型制作:①抗原配制:将MOG35-55用 0.01 mol/L的 PBS稀释成 1 mg/0.45ml的溶液;将8 mg的H 37RA用1ml的IFA稀释成8 mg/m l的CFA溶液;将MOG稀释溶液与CFA溶液等体积接三通管冰浴快速混匀10分钟,至油包水状态,即为抗原乳剂。②EAE模型制作:EAE组,小鼠背部分4点皮下注射抗原乳剂0.2m l/只;CFA阴性对照组,用0.01mol/L的PBS代替MOG35-55稀释溶液与CFA溶液等体积混合制备抗原乳剂,过程同EAE组抗原乳剂制备。免疫后0、48小时给予腹腔注射500 ng/0.95m l PBS的PT溶液0.2m l。自免疫当日起每天早晚称量小鼠体重,观察小鼠行为及神经功能表现,发病开始记录神经功能评分以便了解病情进展。
1.3 神经功能评分及标准 使用较为敏感的Weaver 15分法[3]累计积分,其标准为:尾巴:无异常0分、尾半瘫 1分、尾全瘫 2分;四肢:无异常 0分、步态改变1分、轻瘫2分、全瘫3分(四个肢体分别评分后累加);死亡15分。
1.4 组织病理学评分 小鼠发病高峰期麻醉后心脏灌注处死,取腰髓做石蜡包埋,每隔25μm间断连续切片,片厚5μm,然后进行苏木精-伊红染色,光镜下观察病理变化,评分标准[4](Okuda 1998)如下:400倍镜下计数:没有炎症变化为0;炎症细胞浸润仅限于血管周围为1;脊髓内轻微的炎症细胞浸润为2(1~10/视野);脊髓内中度的炎症细胞浸润为 3(11~100/视野);脊髓内重度炎症细胞浸润为4(>100/视野)。
1.5 外周及中枢淋巴细胞分离及检测 小鼠发病高峰期麻醉后心脏灌注处死,无菌条件下取一半大脑、脑干、颈胸髓、脾脏置于装有预冷PBS的培养皿中,传至超净台处理。
将颈胸髓及大脑、脑干的脊膜、脑膜去除干净,组织分离成小块,小心研磨使脑组织中的淋巴细胞充分游离,用200目尼龙网过滤,离心后用 40%的Percoll液重悬,小心将混合液移至70%Percoll液液面上方,注意保持分界面不被破坏,然后使用水平离心机JS 5.3、600 r/m in、25℃、20分钟分离淋巴细胞。离心后MOG组标本出现一白色雾状层,即为淋巴细胞所在层面,将其吸出用含2%BSA的0.01 mol/L的DPBS液清洗。细胞计数后取104细胞加淋巴细胞表面标记抗体CD3、CD4、CD8、CD25、B220及阴性对照,暗室孵育30分钟,1ml PBS充分清洗细胞,用1%pH7.2的多聚甲醛液150μl将细胞固定待检。
将脾脏周围脂肪及纤维组织去除干净,用针刺法制备脾细胞悬液,收集细胞后用红细胞裂解液充分去除红细胞,PBS清洗、细胞计数后将106脾细胞加淋巴细胞表面标记抗体 CD3、CD4、CD8、CD25、B220及阴性对照,之后操作同中枢标本制备。
细胞标本用FACS-Calibur流式细胞仪对淋巴细胞表面标记抗体进行分选检测,数据采用CellQuest 3.2软件分析。
1.6 统计学方法 使用SPSS16.0统计软件进行统计分析,临床症状评分、潜伏期、达峰时间、病理评分、淋巴细胞所占百分数用±s表示,两样本比较用独立样本t检验。
2 结果
2.1 EAE发病情况 EAE组小鼠临床症状最早出现于免疫后第12天,最迟在免疫后16天,潜伏期为(12.83±1.83)天,症状在3~6天达高峰,达峰时间为(18.17±1.94)天。EAE组6只小鼠全部发病,最大症状评分为(8.83±3.26)分。发病期小鼠多数以尾部远端张力下降、行走时尾尖部拖地为首发症状,少数以行走时步态摇晃为首发,继而出现全尾瘫痪、后肢无力、后肢瘫痪、前肢无力等症状。另外还表现为活动减少、食欲降低、毛色暗淡、体重减轻(见图1、2)等。
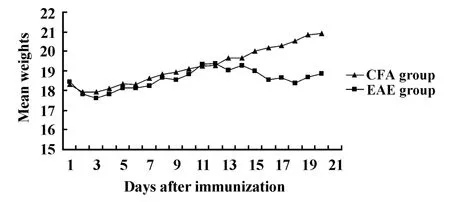
图1 免疫后CFA组及EAE组小鼠平均体重变化Fig.1 Weight change in CFA and EAE group after immunization
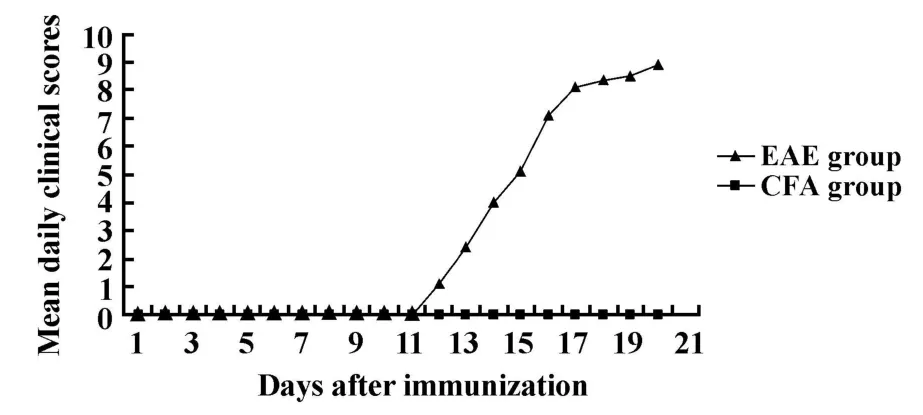
图2 免疫后CFA组及EAE组小鼠日均评分Fig.2 Mean daily clinical scores in CFA and EAE group after immunization
2.2 病理学改变 苏木精-伊红染色(见图3、4),EAE小鼠发病高峰期都可观察到腰髓有大量的炎性细胞浸润,以淋巴细胞为主,多分布于灰质与白质交界处,发病较严重的可见脊膜不完整,并有大量淋巴细胞浸润。部分小血管周围被炎症细胞浸润,形成典型的“血管袖套样”(Cuffing)改变,并且病理评分与神经功能评分基本符合。
2.3 淋巴细胞变化 EAE组高峰期小鼠外周脾细胞中CD3+CD4+、CD3+CD8+细胞较CFA阴性对照组减少(P<0.05),B220+细胞较CFA阴性对照组明显升高(P<0.01),CD4+/CD8+、CD4+CD25+细胞较CFA阴性对照组升高但无统计学差异。EAE组高峰期小鼠中枢神经组织(大脑、脑干、颈胸髓)CD3+CD4+、CD3+CD8+、CD4+CD25+、B220+淋巴细胞浸润明显,而CFA阴性对照组小鼠中枢未检测到淋巴细胞浸润(见表1、图5~8)。
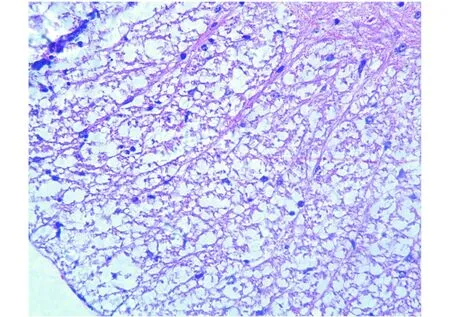
图3 CFA阴性对照组小鼠腰髓(苏木精-伊红染色,×400)Fig.3 Lumbar cord of CFA controlgroup(stained by HE,×400)
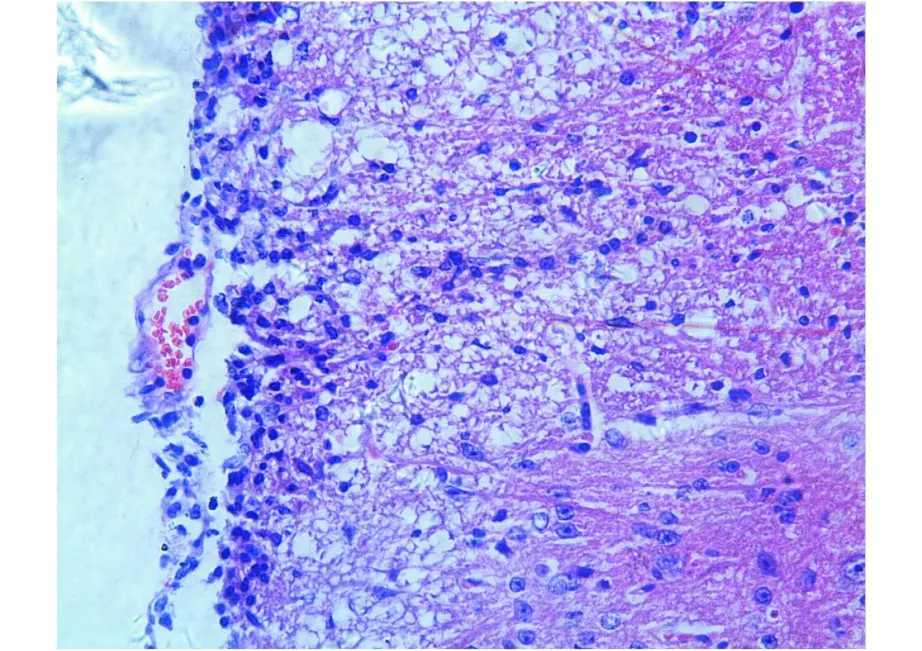
图4 EAE组小鼠腰髓可见灰质明显炎症细胞浸润(苏木精-伊红染色,×400)Fig.4 Thereare obvious in flammatory cells infiltrating in grey matter in lumbar cord of EAE group(stained by HE,×400)
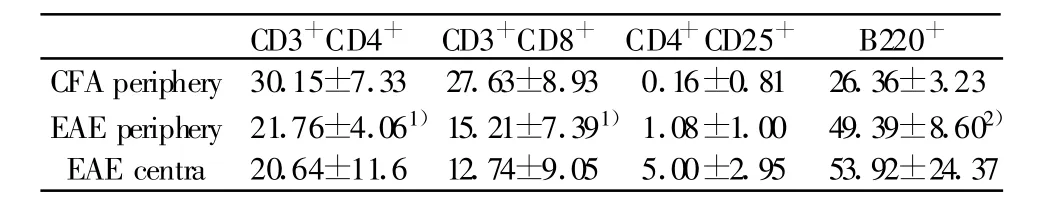
表1 EAE组与CFA组不同淋巴细胞亚群所占比例比较Tab.1 Comparisons of percentages of lymphocyte subsets between EAE and CFA groups
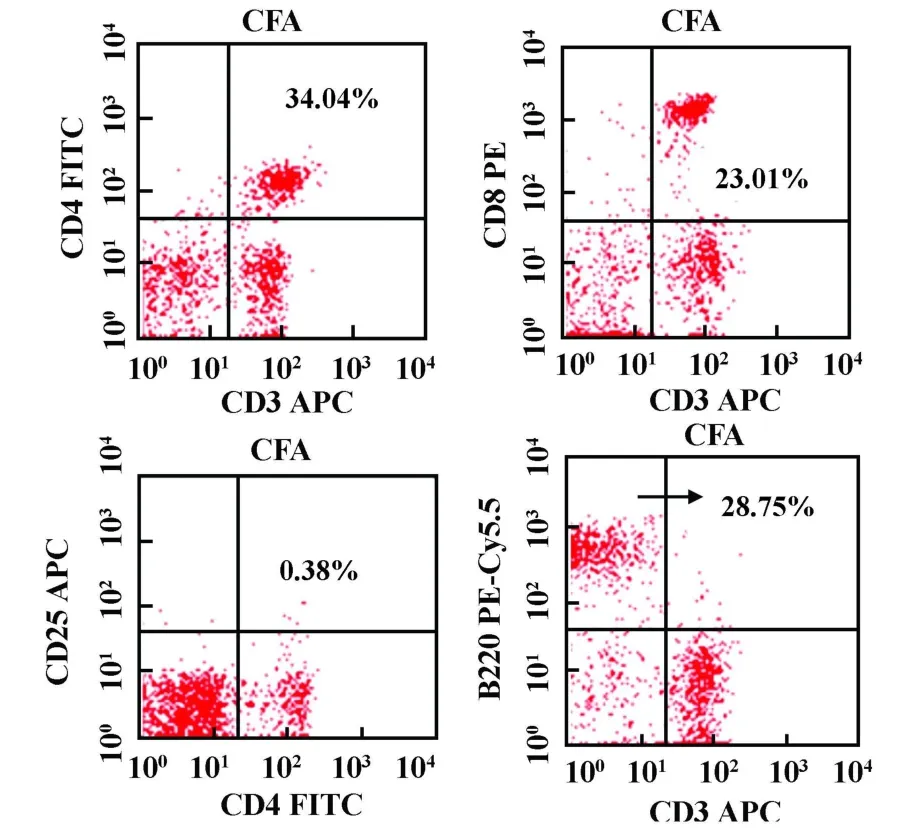
图5 流式细胞仪分析CFA阴性对照组外周脾脏淋巴细胞(CFA)中 CD3+CD4+、CD3+CD8+、CD4+CD25+、B220+所占百分数Fig.5 The percents of CD3+CD4+,CD3+CD8+,CD4+CD25+,B220+in the periphery lymphocytes of CFA control group(CFA),analyzed by flow cy tometry
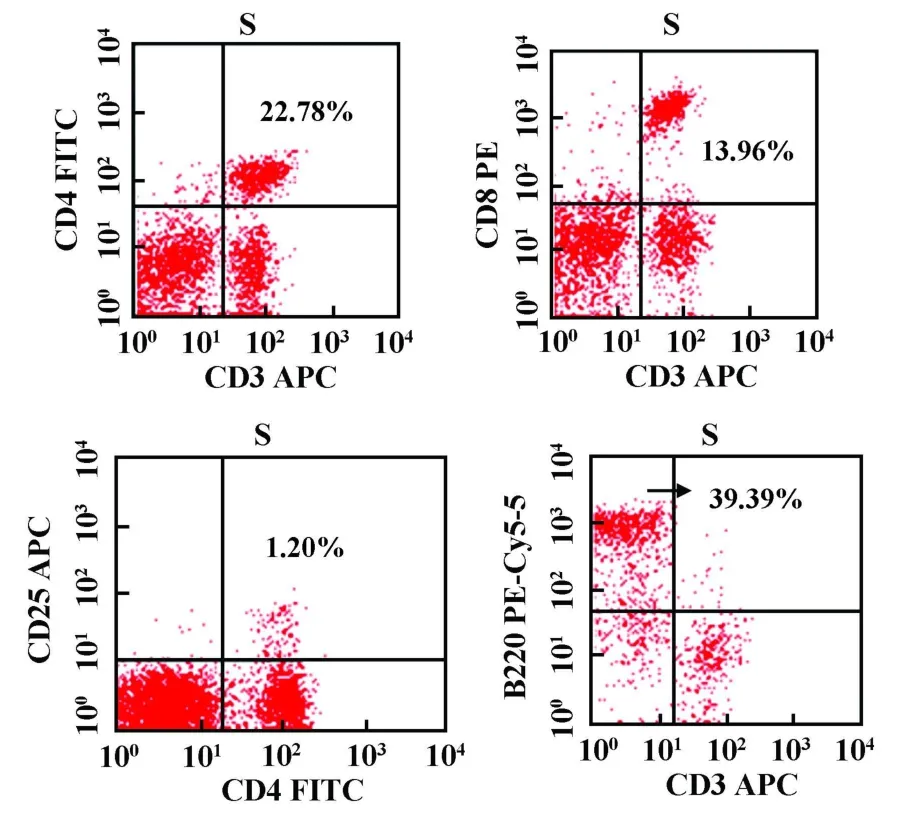
图6 流式细胞仪分析EAE组高峰期外周脾脏淋巴细胞(S)中 CD3+CD4+、CD3+CD8+、CD4+CD25+、B220+细胞所占百分数Fig.6 The percents of CD3+CD4+,CD3+CD8+,CD4+CD25+,B220+cell in the periphery lymphocytes of EAE crest-time group(S),analyzed by flow cytometry
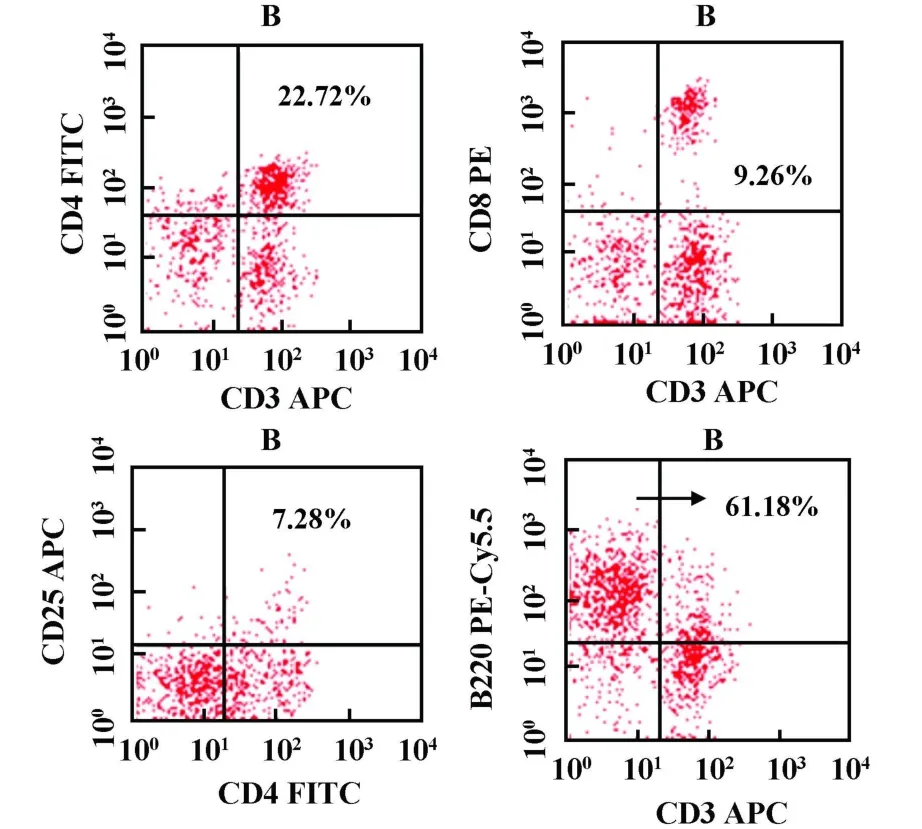
图7 流式细胞仪分析EAE组高峰期中枢神经组织淋巴细胞(B)中 CD3+CD4+、CD3+CD8+、CD4+CD25+、B220+所占百分数Fig.7 The percents of CD3+CD4+,CD3+CD8+,CD4+CD25+,B220+in the center nervous system lymphocytes of EAE crest-time group(B),ana lyzed by flow cy tometry
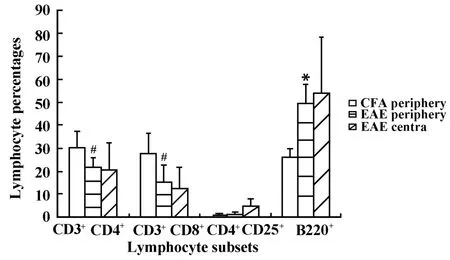
图8 高峰期EAE组与CFA组不同淋巴细胞亚群所占比例比较Fig.8 Comparisons of percentages of lymphocyte subsets between EAE crest-time group and CFA group
3 讨论
MOG35-55诱导C57BL/6小鼠的EAE是MS的一种经典模型,本实验中EAE组小鼠行为学表现为发病期体重下降、尾巴瘫痪、步态异常及不同程度的肢体瘫痪等,其病程在第一个发病高峰期以内呈现慢性迁延性,病理见腰髓白质为主的炎性细胞浸润和血管“袖套”样改变等,与文献[1,2]报道相符合,提示本次实验诱导的EAE模型是成功的,神经功能损伤表现及病理学表现都比较典型。
Mix等[5,6]发现MS患者外周血中CD4+、CD8+细胞数量下降,CD4+/CD8+上升,在脑脊液中CD4+细胞数量及CD4+/CD8+上升,而CD8+细胞数量下降。在本次实验中,EAE组外周及中枢淋巴细胞分离采用流式细胞仪检测结果符合文献报道MS患者外周血及脑脊液淋巴细胞改变,提示在EAE高峰期外周淋巴细胞通过血脑屏障向中枢浸润,而且CD4+辅助性T细胞增多占优势。
CD4+CD25+调节性T细胞是一类具有免疫调节功能的T细胞亚群,可以抑制CD4+、CD8+T细胞。多数研究发现,在MS患者外周血中 CD4+CD25+调节性T细胞免疫抑制作用减弱,而其数量无明显变化[7,8]。而在多数 EAE研究中也发现CD4+CD25+调节性T细胞免疫抑制功能缺失时病情明显加重,转输功能正常的异体小鼠Treg对发病有抑制作用,明显减轻病理损伤[9,10]。Feger等[11-13]研究发现复发-缓解型MS(Relapse-remitting MS,RRMS)患者Treg数量略有增多,其中记忆性Treg比例增多,而 CD4+CD25+Foxp3+显著减少,抑制 T细胞活化功能减弱。本实验中 EAE组外周、中枢CD4+CD25+T淋巴细胞数稍有增多,但未进行进一步分型及功能检测,提示此次检测到的CD4+CD25+T淋巴细胞多数属于记忆性Treg细胞。
目前多数学者对B细胞在MS等自身免疫性疾病中的作用及MS的免疫启动机制提出质疑[14]。Mathey等[15]在继发-进展型MS患者的血清中发现高浓度的针对神经束蛋白的抗体,而注射抗神经束蛋白抗体至EAE模型鼠可导致疾病的恶化。然而,Bourdette等[16]利用利妥昔单抗治疗复发缓解型MS(RRMS)的Ⅱ期临床试验结果显示了该药对B细胞消减治疗的卓越疗效。Matsushita等[17]研究发现诱导EAE之前7天使小鼠B细胞缺失结果加重小鼠发病,而诱导EAE 14天后使小鼠B细胞缺失可减轻小鼠发病。实验推测B细胞不同亚型在EAE不同时相发挥不同的作用。本实验发现EAE组高峰期小鼠外周B细胞较CFA阴性对照组明显升高,而且EAE组高峰期小鼠中枢B细胞较外周又有升高,提示B细胞参与了EAE发病过程。
以往认为,Th2细胞通过分泌IL-4刺激B细胞增殖和Ig类别转换,上调B细胞CD40和MHCⅡ类分子的表达,是辅助B细胞主要的T细胞亚群。而最近发现滤泡辅助性T细胞(T follicularhelper cells,Tfh)是主要负责辅助B细胞的T细胞亚群[18]。本次试验结果提示B细胞的异常同T细胞一起调控了EAE高峰期的病理变化过程,即在EAE发病过程中细胞免疫及体液免疫共同发挥了重要作用,在炎症高峰期,随着康复期的即将来临,B细胞的增殖与功能已开始发挥主导作用。EAE疾病进展中很可能是通过B细胞与T细胞之间的相互作用及其不同细胞亚型的变化来进一步调节中枢的细胞与体液免疫反应,相关的分子免疫病理有待深入研究。
1 徐全刚,王晓辉,黄德辉etal.MOG35-55诱发实验性自身免疫性脑脊髓炎小鼠模型[J].中华神经医学杂志,2006;5(2):141-144.
2 姚苏琴,郑荣远,郦铮铮etal.髓鞘少突胶质细胞诱导实验性自身免疫性脑脊髓炎小鼠的中枢病理损伤与Th1、Th17细胞分泌炎症因子的变化观察[J].中国临床神经科学,2009;17(4):351-356.
3 Weaver A,Goncalvesda Silva A,Nuttall R Ketal.An elevated matrix metalloproteinase(MMP)in an animalmodel ofmultiple sclerosis is protective by affecting Th1/Th2 polarization[J].Faseb J,2005;19(12):1668-1670.
4 Okuda Y,Sakoda S,Bernard C Cetal.IL-6-deficientm ice are resistant to the induction of experimental autoimmune encephalomyelitis provoked bymyelin oligodendrocyte glycoprotein[J].Int Immunol,1998;10(5):703-708.
5 Mix E,O lsson T,Correale Jetal.CD4+,CD8+,and CD 4-CD8-T cells in CSF and blood of patientswithmultiple sclerosisand tension headache[J].Scand J Immunol,1990;31(4):493-501.
6 Vrethem M,Dahle C,EkerfeltCetal.CD4 and CD8 lymphocyte subsets in cerebrospinal fluid and peripheral blood from patients with multiple sclerosis,meningitisand normal controls[J].Acta Neurol Scand,1998;97(4):215-220.
7 Viglietta V,Baecher-Allan C,Weiner H Letal.Loss of functional suppression by CD4+CD25+regulatory T cells in patientswithmultiple sclerosis[J].JExp Med,2004;199(7):971-979.
8 Haas J,Hug A,Viehover Aetal.Reduced suppressive effect of CD4+CD25highregulatory T cells on the T cell immune response againstmyelin oligodendrocyte glycoprotein in patientswith multiple sclerosis[J].Eur J Immunol,2005;35(11):3343-3352.
9 Tischner D,Weishaupt A,van den Brandt Jetal.Polyc lonalexpansion of regulatory T cells interfereswith effector cellm igration in amodel ofmultiple sclerosis[J].Brain,2006;129(10):2635-2647.
10 M cGeachyM J,Stephens LA,Anderton SM.Natural recovery and protection from autoimmuneencephalomyelitis:contribution ofCD4+CD25+regulatory cellswithin the central nervous system[J].J Immunol,2005;175(5):3025-3032.
11 Feger U,Luther C,Poeschel Setal.Increased frequency of CD4+CD25+regulatory T cells in the cerebrospinal fluid but not in the blood ofmultiple sc lerosis patients[J].Clin Exp Immunol,2007;147(3):412-418.
12 KumarM,PutzkiN,Limm roth Vetal.CD4+CD25+FoxP3+T lymphocytes fail to suppressmyelin basic protein-induced proliferation in patientswith multiple sc lerosis[J].JNeuroimmunol,2006;180(1-2):178-184.
13 胡学强,李 盈.Th17/Treg失衡在多发性硬化发病和治疗中的意义[J].中国免疫学杂志,2009;25(6):575-576.
14 吕传真,李振新.对多发性硬化的再认识[J].中华神经科杂志,2009;42(1):3-5.
15 Mathey E K,Derfuss T,Storch M Ketal.Neurofascin as a novel target for autoantibody-mediated axonal injury[J].JExp Med,2007;204(10):2363-2372.
16 Bourdette D,Yadav V.B-cell depletion with rituximab in relapsing-rem ittingmultiple sclerosis[J].Curr Neurol Neurosci Rep,2008;8(5):417-418.
17 Matsushita T,Yanaba K,Bouaziz JDetal.Regulatory B cells inhibit EAE initiation in m ice while other B cells promote disease progression[J].JClin Invest,2008;118(10):3420-3430.
18 金伯泉.T-B细胞协作研究的重大突破[J].细胞与分子免疫学杂志,2009;25(1):1-5.
[收稿2009-10-20 修回2009-12-14]
(编辑 张晓舟)
The change of periphery and central lymphocyte subsets at the crest-time of experimental autoimmune encephalomyelitism ice
XINa-Na,ZHENGRong-Yuan,SHANGXiao-Feng,WANGTan,LÜJin,XUDe,WUZheng-Gang,CHENGuo-Qian.DepartmentofNeurology,theFirstAffiliatedHospitalofWenzhouMedicalCollege,Wenzhou325000,China
Objective:Toobserve the change of periphery and centra lymphocyte subsets at the crest-time of MOG35-55induced EAE disease inmice,and to exp lore the alteration of cellular immunity and humoral immunity in the invasion process in EAE.Methods:MOG35-55was used to establish EAEmodel in femina C57BL/6 mice.The behavioral changes and the histological scoreswere recorded after them ice were immuned.The changes of CD3+CD4+,CD3+CD8+,CD4+CD25+and B220+on periphery and centra lymphocytes in spleen,brain and spinal cord were analyzed by flow cytometry.Results:The CD3+CD4+,CD3+CD8+,CD4+CD25+and B220+lymphocyteswere detected in thebrain and spinal cord of EAE groupmice,but theywere notdetected in CFA controlgroup.The CD3+CD4+and CD3+CD8+lymphocytes in the spleen of EAE crest-time group were lower than those in CFA control group(P<0.05).The B220+lymphocyteswereobviously higher than in the CFA controlgroup(P<0.01).And CD4+CD25+lymphocyteswere slighthigher than the CFA controlgroup.Conclusion:At the crest-time during EAE,the CD3+CD4+,CD3+CD8+lymphocytes of spleen reduced obviously,B220+lymphocytesincreasedmarkedly,and the CD4+CD25+lymphocytes justhave the increasing trend.It indicates that cellular immunity and humoral immunity coregulated the patho-p rocess at the crest-time of EAE,T lymphocytes and B lymphocytes all played important roles in the pathogenesy of EAE.
Experimental autoimmune encephalomyelitis;Lymphocyte subset;Multiple sclerosis;T lymphocyte;B lymphocyte
R744.5
A
1000-484X(2010)03-0236-05
①本文为省部共建基金(wkj:2005-2-041)
席娜娜(1982年-),女,在读硕士,主要从事脱髓鞘疾病及神经免疫学的研究,E-mail:xinana0844@163.com;
及指导教师:郑荣远(1949年-),男,教授,博士生导师,主要从事脱髓鞘疾病及神经免疫学、神经药理学的研究,E-mail:zhengry@yahoo.com.cn。