癌迪针剂对荷瘤小鼠免疫功能的影响①
艾金霞 刘 良 (北华大学医学院免疫教研室,吉林 132013)
癌迪针剂对荷瘤小鼠免疫功能的影响①
艾金霞 刘 良②(北华大学医学院免疫教研室,吉林 132013)
目的:研究癌迪针剂对肿瘤的作用效果及其抗肿瘤免疫效应机制。方法:选用H22肝癌荷瘤小鼠注射癌迪针剂7天后,观察荷瘤小鼠肿瘤抑制率、胸腺、脾脏指数、淋巴细胞转化功能、腹腔巨噬细胞吞噬功能、TNF活性、IL-2及血清IFN-α水平。结果:癌迪针剂可明显抑制荷瘤小鼠肿瘤生长;能提高荷瘤小鼠的淋巴细胞转化功能;可增强巨噬细胞吞噬活性和TNF活性;能提高IL-2和IFN-α水平。结论:癌迪针剂能明显抑制荷瘤小鼠肿瘤生长,增强机体的免疫功能。
癌迪针剂;抗肿瘤;免疫功能
癌迪针剂为中药一类新药,成分澳洲茄胺盐酸盐,本品为粉针剂,X-射线衍射等十一项检测,确定分子结构为SBHL(带码)、分子量为:450.10,样品纯度为:大于99.2%。澳洲茄胺盐酸盐是从龙葵浓缩果汁中提取出的一种游离的生物碱盐酸盐。近几年研究报道澳洲茄胺盐酸盐不但具有抗炎、镇痛作用,还具有抑制核糖核酸的合成、代谢,诱导细胞分化等机制发挥其抗肿瘤作用[1,2]。本实验用移植性腹水型肝癌(H22)荷瘤小鼠做实验,探讨癌迪针剂对机体免疫功能的影响及其作用机制。
1 材料与方法
1.1 药品 癌迪针剂由北华大学生物与化学学院刘良教授提供,为白色粉末。
1.2 动物及瘤株
1.2.1 动物 BALB/c小鼠(20±2克)由长春高新医学动物实验研究中心提供,雌雄各半。
1.2.2 瘤株 移植性腹水型肝癌(H22)细胞株由长春生物制品研究所提供。
1.3 仪器及试剂
1.3.1 仪器 YJ-875超净工作台(苏州净化设备公司);DG-3022酶联免疫测定仪(华东电子医疗设备厂);CO2培养箱:美国杜邦公司产品。
1.3.2 试剂 RPMI1640培养基由美国Invitrogen公司提供;小牛血清购自杭州四季青生物有限公司;IFN-α酶联免疫检测试剂盒购自华美生物工程公司;环磷酰胺(CTX)购自江苏恒瑞医药股份有限公司(批号06050821);分析纯二甲基亚砜(DMSO)为金山化工厂产品。
1.4 肿瘤模型的建立 将接种肿瘤细胞后7天生长良好的小鼠,颈椎脱臼处死,置75%的酒精中浸泡10分钟,置超净工作台,从移植性腹水型肝癌(H22)肿瘤小鼠腹腔内抽取腹腔瘤液,镜检,用无菌生理盐水按1∶4比例配制成癌细胞悬液(2×106ml-1)。将该肿瘤细胞悬液对实验小鼠进行造模,每只小鼠右腋窝皮下接种0.2m l。以上均在无菌环境中操作。
1.5 分组及给药 设6组,每组10只,雌雄各半。设一组为不接种瘤株的生理盐水正常对照组;余50只小鼠每只右腋皮下接种0.2ml癌细胞悬液,24小时后随机分为5组,即荷瘤对照组,环磷酰胺对照组及癌迪针剂11、33、55mg/kg 3个剂量组。正常对照组和荷瘤空白对照组用生理盐水给予尾静脉注射,环磷酰胺对照组给予尾静脉注射环磷酰胺20mg/kg,连续给药7天,癌迪针剂3个剂量组于接种第2天开始尾静脉注射,每天1次,连续10天,第11天处死小鼠。
1.6 测肿瘤抑制率 停药后第2天处死小鼠,剥离完整肿瘤组织,电子天平称量瘤体湿重(精确到0.01 g)并计算肿瘤生长抑制率,抑瘤率(%)=(荷瘤对照组平均瘤重-给药组平均瘤重)/荷瘤对照组平均瘤重×100%。肿瘤组动物平均质量小于1表示肿瘤生长不良,实验组小鼠死亡率超过20%表示药物所致毒性。
1.7 对小鼠免疫器官的影响 给药结束后次日解剖小鼠取出胸腺、脾脏,计算脏器重量、脏器指数,脏器指数=免疫器官质量/体质量×1 000。
1.8 对小鼠巨噬细胞吞噬功能的影响 处死30分钟前,每鼠腹腔注射2%CRBC 0.5ml,立即取腹腔液滴片,甲醇固定,Giemsa染色,显微镜下计数200个巨噬细胞,检测吞噬百分率和指数[3]。
1.9 小鼠脾细胞悬液的制备 将小鼠处死,取脾脏,研磨,沙网过滤(200目),加入红细胞裂解液,裂解3分钟,1 500 r/min离心8分钟,取出淋巴细胞,生理盐水冲洗2次,800 r/min离心10分钟,用RPM I1640培养液调细胞浓度为5×106ml-1,37℃5%CO2饱和湿度培养,备用。
1.10 对小鼠脾淋巴细胞转化的影响 将制备的小鼠脾细胞悬液用RPM I1640培养液制成2×107m l-1细胞悬液,每孔1m l分装到24孔培养板中,每孔加入ConA 3μg,置于CO2培养箱37℃孵育56小时后,加入[3H]TdR达终浓度37 kBq·m l-1后继续置CO2培养箱孵育16小时后,将各孔细胞收集到玻璃纤维纸上,置FJ-2100型液体闪烁计数器测定并计算dpm值[4]。
1.11 TNF活性测定 将制备的小鼠脾细胞悬液用含10%小牛血清的RPMI1640培养液调整细胞浓度为1×106m l-1,接种于24孔培养板,每孔500μl,每孔再加终浓度为 5μg/m l的 ConA,500μl/孔,37℃5%CO2培养箱内培养48小时后,吸出细胞培养上清,12 000 r/min离心15分钟,取上清液,备用。将生长良好的L929细胞用0.25%胰酶消化液消化,用RPM I1640培养液配制成4×105m l-1,接种于96孔培养板100μl/孔,同时将待测样品也加入培养板100μl/孔,37℃5%CO2培养箱内培养48小时后,轻轻吸去上清液100μl,加入MTT(1 mg/ml)试液100μl,37℃5%CO2培养箱内培养2小时后,2 000 r/min离心5分钟,吸弃上清液,每孔加DMSO 100μl,作用30分钟,用酶标测定仪测570 nm处的吸收度。
1.12 IL-2诱生水平的测定 将制备的小鼠脾细胞悬液用含10%小牛血清的RPMI1640培养液调整细胞浓度为1×106m l-1,接种于24孔培养板,每孔500μl,每孔再加终浓度为5μg/ml的 ConA,500μl/孔,37℃5%CO2培养箱内培养48小时后,吸出细胞培养上清,12 000 r/min离心15分钟,取上清,备用。取传代培养48小时的CTLL-2细胞,用培养液离心洗涤2次,每次1 000 r/min离心5分钟,再用含10%小牛血清的RPMI1640培养液调整细胞浓度为1×105ml-1,接种于96孔培养板100 μl/孔,同时将待测样品也加入培养板100μl/孔,37℃5%CO2培养箱内培养48分钟后,轻轻吸去上清液100μl,加入MTT(1mg/m l)试液 100μl,37℃5%CO2培养箱内培养2小时后,2 000 r/min离心5分钟,吸弃上清液,每孔加DMSO 100μl,作用 30分钟,用酶标测定仪测在570 nm波长处测吸收度。
1.13 对小鼠血清IFN-α生成的影响 酶联免疫吸附法测定血清IFN-α的含量,实验操作按试剂盒说明进行。A 450 nm下,用酶标仪检测各孔OD值。根据稀释标准IFN-αOD值作出标准曲线,用每份标本OD平均值在标准曲线上查出其浓度。
1.14 统计学处理 采用SPSS11.5统计分析软件,计量资料用±s表示。用药组与空白组之间的比较采用单因素方差分析法中的Dunnett-t法检验。
2 结果
2.1 肿瘤抑瘤率 实验显示癌迪针剂33 mg/kg、55 mg/kg剂量组对何瘤小鼠的肿瘤生长具有一定抑制作用,抑瘤率分别为77.6%、87.2%。与荷瘤对照组比较有显著性差异(P<0.05)。结果见图1,表1。

图1 癌迪针剂对荷瘤小鼠的肿瘤抑制作用Fig 1 Effect of AiD i-in jection on the tumor inhibition in tumor bearingm ice
2.2 对荷瘤小鼠免疫器官的影响 从表2可以看出肿瘤模型组小鼠胸腺指数明显低于正常组,而三个剂量组能明显提高荷瘤小鼠的胸腺指数,使其恢复到正常水平,但给药组并未表现出剂量依赖性。从表2可以看出用药各剂量组脾脏指数与荷瘤对照组比较无显著差异(P>0.05),结果见表2。
2.3 对小鼠腹腔巨噬细胞吞噬功能的影响 从表3可以看出肿瘤模型组小鼠巨噬细胞吞噬功能低于正常组,而三个剂量组能明显提高荷瘤小鼠的吞噬功能(P<0.05),结果见表3。
2.4 对淋巴细胞转化功能的影响 肿瘤模型组小鼠的淋巴细胞转化功能明显低于正常组,用CTX治疗的小鼠使淋巴细胞转化功能进一步降低。而药物组可明显提高荷瘤小鼠的淋巴细胞转化功能,具有剂量依赖性,其中高、中剂量组与正常组比较无明显差异,结果见表4。
表1 癌迪针剂对荷瘤小鼠的肿瘤抑制作用(n=10,±s)Tab.1 Effect of AiDi-injection on the inhibitory rate of tumor of themice(n=10,±s)

表1 癌迪针剂对荷瘤小鼠的肿瘤抑制作用(n=10,±s)Tab.1 Effect of AiDi-injection on the inhibitory rate of tumor of themice(n=10,±s)
Note:1)P<0.05 vs NS(tumor bearing group).
Groups Weight of tumor(mg)Inhibitory rate of tumor(%)NS(tumor bearing) 2 977.3±2 225.75 CTX 1 983.30±1 608.45 33.4 AiDi injection(11mg/kg)1 326.30±1 516.11 50.9 AiDi injection(33mg/kg) 667.88±418.131) 77.6 AiDi injection(55mg/kg) 381.33±275.821) 87.2
表2 癌迪针剂对小鼠胸腺指数及脾脏指数的影响(n=10,±s)Tab.2 Effect of AiDi-injection on the indexes of thymus and spleen of them ice(n=10,±s)

表2 癌迪针剂对小鼠胸腺指数及脾脏指数的影响(n=10,±s)Tab.2 Effect of AiDi-injection on the indexes of thymus and spleen of them ice(n=10,±s)
Note:1)P<0.05 vs NS(tumor bearing group).
Groups Indexes of spleen Indexesof thymus NS(control) 41.2±4.3 8.3±1.1 NS(tumor bearing) 35.2±3.4 5.8±4.1 CTX 36.2±3.7 7.9±3.5 AiDi injection(11mg/kg) 36.9±2.4 6.2±2.7 AiDi injection(33mg/kg) 37.9±3.1 7.9±1.61)AiDi injection(55mg/kg) 42.6±10.31) 8.2±4.71)
表3 癌迪针剂对小鼠腹腔巨噬细胞吞噬功能的影响(n=10,±s)Tab.3 Effect of AiDi-in jection on macrophage phagocytosis function of them ice(n=10,±s)

表3 癌迪针剂对小鼠腹腔巨噬细胞吞噬功能的影响(n=10,±s)Tab.3 Effect of AiDi-in jection on macrophage phagocytosis function of them ice(n=10,±s)
Note:1)P<0.05 vs NS(tumor bearing group);2)P<0.05 vs NS(normal controlgroup).
Groups Phagocytosis percentage(%)Phagocytosis index NS(control) 60.4±0.4 1.070±0.10 NS(tumor bearing) 30.3±0.52) 0.56±0.082)CTX 50.3±0.51) 0.96±0.18 AiDi injection(11mg/kg) 47.4±1.21) 0.92±0.301)AiDi injection(33mg/kg) 59.3±1.21) 1.00±0.141)AiDi injection(55mg/kg) 59.8±3.21) 1.03±0.181)
2.5 对小鼠TNF活性的影响 给药组低剂量组能提高荷瘤小鼠TNF活性,但不能达到正常组水平,中、高剂量组能提高到正常组水平,具有剂量依赖性,结果见表5。
表4 癌迪针剂对小鼠脾淋巴细胞转化影响(A450 nm,n=10,±s)Tab.4 Effect of AiDi-injection on lymphocytes transformation function of them ice(A450 nm,n=10,±s)
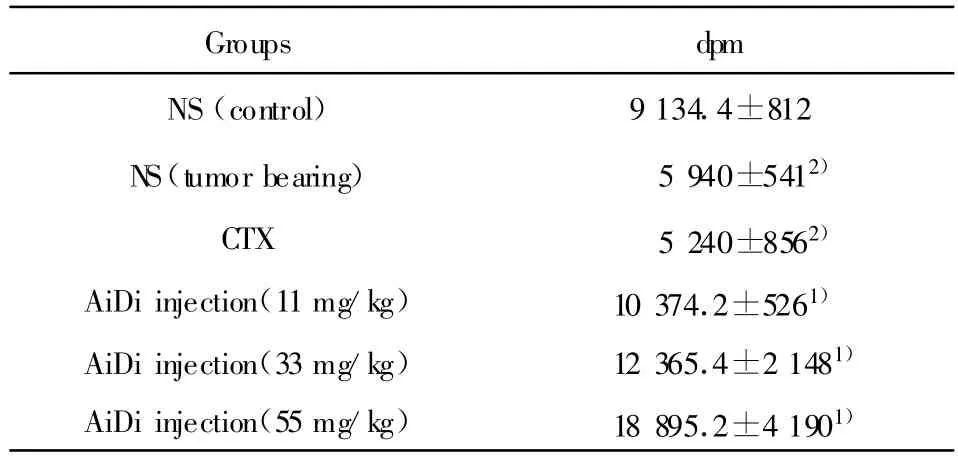
表4 癌迪针剂对小鼠脾淋巴细胞转化影响(A450 nm,n=10,±s)Tab.4 Effect of AiDi-injection on lymphocytes transformation function of them ice(A450 nm,n=10,±s)
Note:1)P<0.05 vs NS(tumor bearing group);2)P<0.05 vs NS(normal control group).
Groups dpm NS(control) 9 134.4±812 NS(tumor bearing) 5 940±5412)CTX 5 240±8562)AiDi injection(11mg/kg) 10 374.2±5261)AiDi injection(33mg/kg) 12 365.4±2 1481)AiDi injection(55mg/kg) 18 895.2±4 1901)
表5 癌迪针剂对小鼠TNF活性的影响(n=10,±s)Tab.5 Effect of AiDi-injection on TNF activity of them ice(n=10,±s)
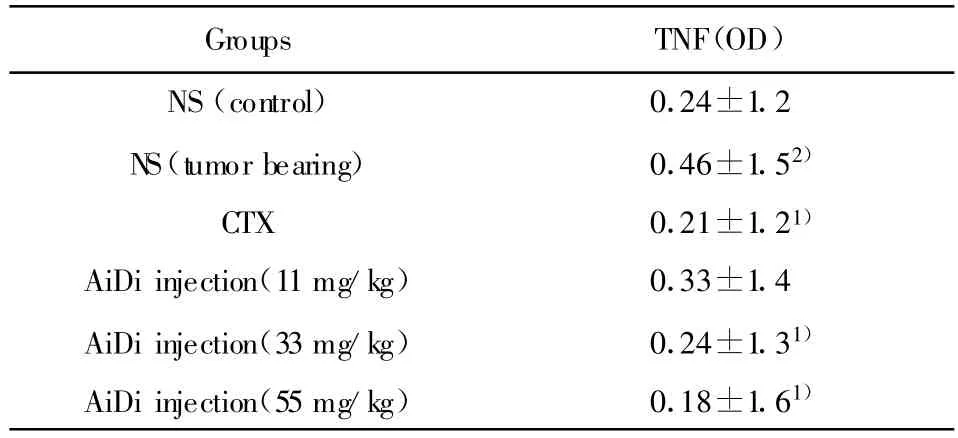
表5 癌迪针剂对小鼠TNF活性的影响(n=10,±s)Tab.5 Effect of AiDi-injection on TNF activity of them ice(n=10,±s)
Note:1)P<0.05 vs NS(tumor bearing group);2)P<0.05 vs NS(normal control group).
Groups TNF(OD)NS(control) 0.24±1.2 NS(tumor bearing) 0.46±1.52)CTX 0.21±1.21)AiDi injection(11mg/kg) 0.33±1.4 AiDi injection(33mg/kg) 0.24±1.31)AiDi injection(55mg/kg) 0.18±1.61)
表6 癌迪针剂对小鼠脾细胞IL-2的影响(n=10,±s)Tab.6 Effect of AiDi-injection on IL-2 of spleen cells of the m ice(n=10,±s)

表6 癌迪针剂对小鼠脾细胞IL-2的影响(n=10,±s)Tab.6 Effect of AiDi-injection on IL-2 of spleen cells of the m ice(n=10,±s)
Note:1)P<0.05 vsNS(tumor bearing sroup);2)P<0.05 vsNS(normal control group).
Groups IL-2(OD)NS(control) 0.64±5.2 NS(tumor bearing) 0.36±3.12)CTX 0.41±4.7 AiDi injection(11mg/kg) 0.43±2.1 AiDi injection(33mg/kg) 0.54±1.31)AiDi injection(55mg/kg) 0.62±1.61)
表7 癌迪针剂对小鼠IFN-α产生的影响(A450 nm,n=10,±s)Tab.7 Effect of AiDi-in jection on IFN-αof the m ice(A450 nm,n=10,±s)

表7 癌迪针剂对小鼠IFN-α产生的影响(A450 nm,n=10,±s)Tab.7 Effect of AiDi-in jection on IFN-αof the m ice(A450 nm,n=10,±s)
Note:1)P<0.05 vsNS(tumor bearing groups);2)P<0.05 vs NS(normal controlgroup).
Groups IFN-α(pg/ml)NS(control) 57±2.1 NS(tumor bearing) 44±5.2 CTX 9±2.51)2)AiDi injection(11mg/kg) 98±4.3 AiDi injection(33mg/kg) 118±1.51)2)AiDi injection(55mg/kg) 122±2.11)2)
2.6 对小鼠IL-2(诱生)水平的影响 各剂量组能显著提高荷瘤小鼠脾细胞IL-2诱生水平,其中高剂量组能提高到正常组的水平,结果见表6。
2.7 对小鼠血清IFN-α生成的影响 与正常对照组相比,CTX组小鼠血清IFN-α产生显著降低;与荷瘤相比,癌迪针剂各剂量组IFN-α产生显著增加,结果见表7。
3 讨论
肿瘤患者常伴有免疫系统机能低下,当肿瘤细胞侵入机体时,会对机体造成免疫功能抑制,许多中药具有抑制肿瘤生长的作用[5],且毒副作用较低,显示了较好的抗瘤效果。癌迪针剂为中药一类新药,药效学实验结果证明,癌迪针剂对人体外肝癌、肺癌、胃癌、宫颈癌、HeLa细胞均有明显的抑制作用[1,2]。本实验用癌迪针剂对H22荷瘤小鼠进行了体内抗肿瘤实验,结果显示癌迪针剂具有明显的体内抗肿瘤作用。实验表明33mg/kg、55 mg/kg剂量组对H22荷瘤小鼠有明显抑瘤效果,抑瘤率可达77.6%、87.2%。与荷瘤对照组比较有显著性差异。同时我们的实验结果表明,癌迪针剂能明显提高荷瘤小鼠的胸腺指数,使其恢复到正常水平,但给药组并未表现出剂量依赖性。另外癌迪针剂可明显提高荷瘤小鼠的淋巴细胞转化功能,具有剂量依赖性。巨噬细胞是机体抗肿瘤免疫作用中的重要效应细胞。巨噬细胞的抗肿瘤作用具有选择性,即仅杀伤肿瘤细胞而不杀伤正常细胞,本实验癌迪针剂明显提高荷瘤小鼠巨噬细胞的吞噬功能。另外,激活的巨噬细胞在杀伤肿瘤细胞同时会释放IFN-α,而Ⅰ型干扰素的主要生物学作用是抗肿瘤、抗病毒和免疫调节作用。而从本实验可见癌迪针剂组可促进IFN-α产生。
TNF是由单核-巨噬细胞系统分泌的一种细胞因子,具有多种生物学活性。如能够激活T细胞、刺激B细胞产生抗体、刺激单核细胞等产生细胞因子、促进白细胞杀死微生物及杀灭肿瘤细胞等功能。其最大特点是能选择性杀伤肿瘤细胞,抑制肿瘤细胞增殖,而不影响正常细胞的生长、分化和代谢功能。本实验结果表明,肿瘤模型组的TNF活性较正常组明显下降,而三个剂量组TNF活性与肿瘤模型组比较具有很大的提高,与正常组比较无差异。
IL-2是由活化的辅助性T细胞分泌的一种细胞增殖因子,具有多种生物学活性。如能够促进T细胞增殖及维持T细胞体外长期生长、促进B细胞增殖分化和刺激NK细胞生长,在机体的免疫应答和调节中起重要作用。另有学者表明,IL-2能促进外周血单核细胞产生TNF,从而增强抗肿瘤的作用[6]。由于IL-2的含量与机体的免疫功能相关,尤其是与细胞免疫功能密切相关,因此可将IL-2的产生作为细胞免疫效应的主要指标。本实验结果表明,肿瘤模型组脾细胞的IL-2诱生水平明显低于正常组,这与国内外学者的研究结果相一致,而三个剂量组的IL-2诱生水平与肿瘤模型组比较可以明显提高,且随剂量增加而增加,直至达到正常组的水平。说明癌迪针剂可改善荷瘤小鼠的免疫指标,提高机体的抗肿瘤能力,并能改善荷瘤小鼠的免疫失衡状态[7]。癌迪针剂可通过增强机体的细胞免疫和活化免疫细胞分泌细胞因子参与抗肿瘤作用,达到杀灭肿瘤细胞的目的。
1 艾金霞,刘 良.SBHL对HeLa细胞生长抑制作用的影响[J].第四军医大学学报,2004;25(8):1791-1793.
2 艾金霞,刘 良.SBHL对人宫颈癌细胞凋亡作用的实验研究[J].北华大学学报,2008;1(6):221-223.
3 徐叔云,卞如濂.药理实验方法学[M].北京:人民卫生出版社,1982:944-952.
4 樊俊杰,贾正平.瑞香狼毒多糖对小鼠免疫功能的影响[J].西北国防医学杂志,2000;21(9):263-264.
5 单保恩,张金艳,杜肖娜etal.白花蛇舌草的免疫学调节活性和抗肿瘤的活性[J].中国中西医结合杂志,2001;20(5):370-372.
6 张占英,张滦生,李春兰etal.胸膜渗液中白细胞介素2及自然杀伤细胞毒因子活性的研究[J].苏州医学院学报,1995;15(3):503-504.
7 Graves D T,cochran D.The contribution of interleukin-1 and tumor necrosis factor toperiodontal tissue destruction[J].Jperiodontol,2003,74(3):391-392.
[收稿2009-11-20 修回2009-12-23]
(编辑 倪 鹏)
The effect of AD injection on immune functions in tumor-bearingmice
AIJin-Xia,LIULiang.DepartmentofImmunology,MedicalCollegeofBeihuaUniversity,Jilin132013,China
Objective:In order to study the antitumoreffectof AD injection and itsimmunologicalmechanisms.Methods:Liver cancer H22-bearingmice were treatedwith AD injection and 7 days later toobserve the effectofAD injectionon the inhibitory rateof tumor,indexesof thymus and spleen,lymphocytes transformation function,phagocytosis of the peritonealmacrophage,activity of TNF,the levelof IL-2 and IFN-α in serum.Results:AD in jection could inhibit the grow th of tumor in bearingmice significantly and promote the transformation function of lymphocytes and enhance the peritonealmacrophage phagocytosis and the activities of TNF.AD injection could improve the levelof IL-2 of spleen cells and IFN-αin serum.Conclusion:These results suggested that AD in jection could obviously inhibit the growth of tumor and enhance the immune functions in bearingmice.
AD-injection;Antitumor;Immunological function
R392.1
A
1000-484X(2010)03-0224-04
①本文为吉林市卓怡康纳中药研发基金(ZY040301)
②北华大学生物与化学学院,吉林132013
艾金霞(1968年-),女,硕士,副教授,E-mail:bhdxajx@163.com。
·肿瘤免疫学·
——单针剂C群脑膜炎球菌结合疫苗在婴儿12月龄接种加强剂量疫苗后的免疫原性:开放标签随机对照试验