高温压榨对花生蛋白功能性质的影响
胡小静,郑大川,黄凤勤
(文山学院生化系,云南文山 663000)
花生粕是以花生为原料,经提取油脂后的副产品,为淡褐色或深褐色,有淡花生香味,形状为小块状或粉末状,目前主要用于饲料,造成花生蛋白资源严重浪费。[1-2]蛋白质的功能性质一般是指能使蛋白质成为人们所需要的食品特征而具有的物理化学性质。这些性质对含蛋白质食品的质量及风味起着重要的作用,是开发和有效利用蛋白质资源的重要依据。[3]蛋白质提取常用的方法有水提法、有机溶剂提取法等,[4]文章采用有机溶剂提取法中的醇法和水提法中的碱提酸沉法提取花生和花生粕中的蛋白质,对所提取蛋白质做了功能性质的分析比较,为进一步开发利用花生粕提供科学依据。
1 材料与仪器
1.1 原料
小粒花生、花生粕,由云南砚山县丰林小粒花生油厂提供。
1.2 仪器
索氏抽提器;HH-Z型数显恒温水浴锅 (国华电器有限公司);常量凯氏定氮装置;电子天平(北京赛多利斯仪器系列有限公司);DHG-9076A型电热恒温鼓风干燥箱 (上海跃进医用光学器械厂);飞利浦二合一搅拌机、800型离心机 (江苏金坛市大地自动化仪器厂);SHB-III型循环水式多用真空泵 (郑州长城科工贸有限公司);磁力加热搅拌器 (常洲国华电器有限公司)。
2 测定方法
2.1 脱脂
称取一定量的花生和花生粕分别粉碎后用索氏抽提法进行脱脂处理。[5]
2.2 花生蛋白的提取和预处理
2.2.1 醇法提取花生蛋白
取一定量脱脂样品加入浓度为 75%的乙醇溶液,固液比为 1∶5,混合均匀,置于温度为 30℃的水浴锅中浸提 60 min。然后取出,倒去上清液,再加入等量的浓度为 90%的乙醇溶液,将其置于温度为 50℃的水浴锅中浸提 30 min。倒去上清液,滤渣干燥,得到粗蛋白。[6-7]
2.2.2 碱提酸沉法提取花生蛋白
取一定量样品,用温水浸泡,料液比为 1∶8(m/v),匀浆处理。调节 pH值至 8.2,在温度为60℃的水浴中浸提 2小时,重复两次。再过滤或离心除去其中的不溶物,用盐酸调节浸提液 pH值为4.5。离心分离后得到花生蛋白,干燥备用。[8]
2.2.3 蛋白样品水分含量的测定
采用直接干燥法。[5]
2.2.4 蛋白质样品中蛋白纯度的测定
采用凯氏常量定氮法测定。[5]
2.3 蛋白质的功能性测定
2.3.1 蛋白质持水性的测定[5]
蛋白质的持水性是一种重要的水化性质,常用持水力来表示。持水力反映了蛋白质吸附水的能力,通常用每克蛋白质吸附水分的质量 (g)或体积(mL)来表示。称取 2.0 g花生蛋白质置于预先称重过的离心管中,逐步加水,每加一次水都用玻棒将样品搅匀,加至样品呈浆状无水析为止。再加 1~2 mL水冲洗玻棒,用手振动离心管后于转速为2 500 r/min下离心 10 min,倒去上层清液,称重。若没有上清液,则应加水搅匀再离心,直至有上清液止。其公式为:持水性 (g水 /g样品) = [(离心管重 +沉淀物重) - (离心管重 +样品重)]/样品,数值越大,吸收水分越多,持水性越好。2.3.2蛋白质乳化度的测定[5]
蛋白质的乳化性是指蛋白质产品能将油 /水结合在一起形成乳状液的性能。
取 50 mL1%花生蛋白溶液加入 50 mL色拉油混合,使其形成均一的乳化溶液。于转速为 2 500 r/min下离心 5 min,量取油层、乳化层的高度,计算样品乳化度。其公式为:乳化度 =(1-V油层/V总油)×100%,数值越大,乳化性越好。
2.3.3 蛋白质溶解度的测定[9]
蛋白质的溶解度是蛋白质 -蛋白质与蛋白质 -溶剂相互作用达到平衡的热力学表现形式。蛋白质的溶解度与它们的结构状态紧密相关,因此,在蛋白质的提取、分离和纯化过程中,它常被用来衡量蛋白质的变性程度,它还是判断蛋白质潜在应用价值的一个指标。
称取干燥的蛋白质 1.5 g,加入 75 mL 0.2%的KOH溶液,在磁力搅拌器中搅拌 20 min。量取50 mL液体至离心管中,在 2700 r/min速度下离心10 min后,吸取上清液 15 mL,用凯氏定氮法测定其中的蛋白质含量。溶液中蛋白质含量越高表明蛋白质溶解性越好。
2.3.4 蛋白质的热稳定性的测定[10]
配制一定量 5%的花生蛋白质溶液,取乳化层10 mL,分别在 40℃、60℃、80℃、100℃水浴中保温 30 min后,于转速为 2500 r/min下离心10 min,倒出上层溶液,称取下层沉淀物重量,计算蛋白质稳定性。沉淀物越多表明蛋白质稳定性越差。
3 结果与分析
3.1 花生蛋白纯度的分析比较
按照 2.2.1和 2.2.2对花生和花生粕中蛋白质进行提取,提取的结果见表 1。

表1 提取的蛋白质纯度
从表 1中可看出,碱提酸沉法提取的蛋白质纯度较醇法高,对于相同提取方法,花生中提取的蛋白质纯度较花生粕高。
3.2 花生蛋白持水性的分析比较
按照 2.3.1对所提取的蛋白质做持水性测定,测定结果见表 2。
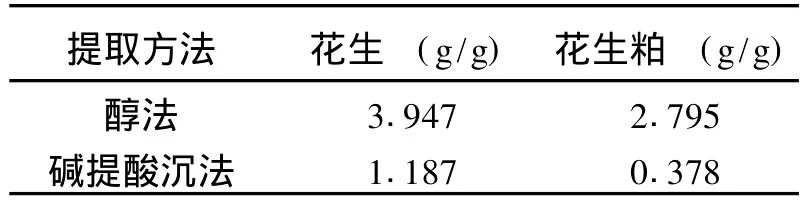
表2 提取蛋白质的持水性
由表 2可看出,醇法提取的蛋白质较碱提酸沉法的持水性好,对同一方法,花生提取的蛋白质持水性较花生粕高。
3.3 花生蛋白乳化度的分析比较
按照 2.3.2对所提取蛋白质进行了乳化性能的测定,测定结果见表 3。

表3 提取蛋白质的乳化性
由表 3可看出,醇法提取的蛋白质乳化性较碱提酸沉法好,对同一方法,花生蛋白质乳化性较花生粕好。
3.4 花生蛋白溶解度的分析比较
按照 2.3.3对所提取的蛋白质进行溶解度的测定,测定结果见表 4。

表4 提取蛋白质的溶解度
由表 4可看出,醇法提取的蛋白质溶解度较碱提酸沉法好,对同一方法,花生蛋白质溶解度较花生粕好。
3.5 花生蛋白稳定性的分析比较
按照 2.3.4对所提取的蛋白质进行稳定性测定,测定结果见表 5。
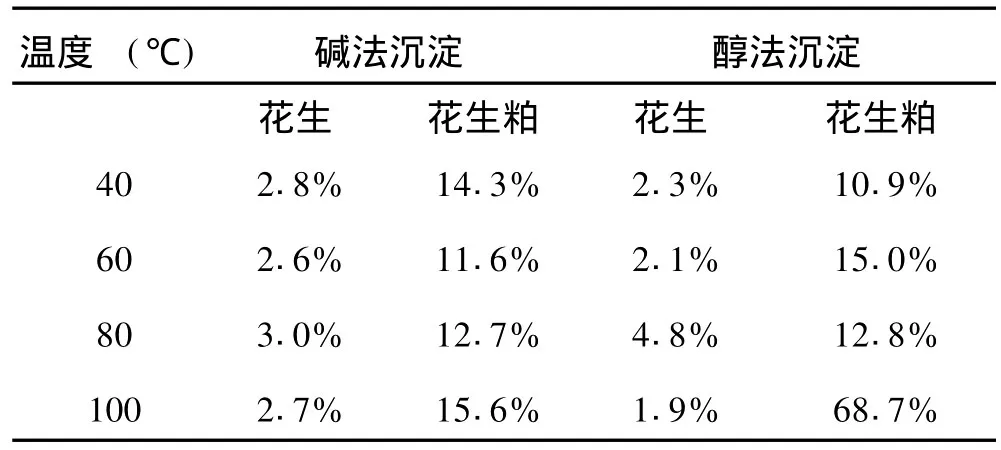
表5 提取蛋白质的稳定性比较
从表 5中可看出对于同种提取方法,从花生中提取的蛋白质比从花生粕中提取的蛋白质稳定性好。碱提酸沉法提取的蛋白质比醇法提取的蛋白质稳定性好,60℃时蛋白质的稳定性较好,随着温度升高,蛋白质的稳定性越来越差。
4 讨论
高温压榨法生产花生油,其操作工艺中烘炒一般温度为 18~200℃,压榨温度在 100℃以上。在这样高的温度下,通过两种方法提取出的花生蛋白的功能性质:持水性、乳化性、溶解度、稳定性都有所下降,究其原因有以下几点: (1)对于持水性来说,温度在 0~40℃或 50℃之间,蛋白质的持水性随温度的提高而提高,但更高温度会使蛋白质的高级结构被破坏而变性聚集。在花生榨油过程中,一方面,蛋白质中的氢键结合水和表面结合水随温度升高一般下降,持水性可能下降。另一方面,结构很紧密的蛋白质被加热处理时,可能导致内部疏水基团暴露而改变其持水性。[11](2)对于乳化性来说,花生在高温压榨过程中,热处理降低了吸附在界面上的蛋白质膜的黏度和硬度,因而降低了乳状液的稳定性,从而使乳化性降低。[12](3)对于溶解度来说,在恒定的 pH和离子强度下,大多数蛋白质的溶解度在 0~50℃之间随温度的升高而升高。当温度超过 50℃时,由于热导致蛋白质结构的展开(变性),促进了聚集和沉淀作用,使蛋白质溶解度下降。[3](4)由于高温导致的蛋白质变性聚集使其稳定性有所下降。[8]
[1] 张吉民.我国花生产业现状与入世后发展对策[J].山东农业科学,2002,(5):12.
[2] 刘祥,马艳伟.花生粕的品质鉴定与搀假识别 [J].河南畜牧兽医,2005,(6):35.
[3] 胡慰望,谢笔均.食品化学 [M].北京:科学出版社,2008.63,68.
[4] 王岸娜,刘小彦,吴立根,等.蛋白质的提取、纯化及性质研究概述[J].中国食品工业,2008,(6):56-58.
[5] 黄晓钰,刘邻渭.食品化学综合实验 [M].北京:中国农业大学出版社,2006.136,106,114,122-125.
[6] 梁剑锋,周晓薇,李红,等.醇法提取大豆浓缩蛋白工艺条件研究[J].粮油加工,2007(10):87-89.
[7] 黄晓杰,郭雪松,王烁,等.醇法提取大豆浓缩蛋白凝胶性能的优化[J].食品研究与开发,2007,(11):67-70.
[8] 李明姝,姚开,贾冬英等.碱提酸沉法制取花生分离蛋白的优化条件[J].中国油脂,2004,(11):21-23.
[9] 张彩猛,华欲飞,唐建强.不同处理方法对醇变性大豆蛋白溶解特征影响的研究[J].中国油脂,2007,(6):16-18.
[10] 徐志宏,魏振承,张雁,等.几种蛋白质功能性质的比较研究[J].食品科学,2006,(12):249-252.
[11] 华欲飞,顾玉兴.大豆蛋白的吸水和持水性能[J].中国油脂,1999,(4):64-67.
[12] 殷军,华欲飞.大豆蛋白乳化性能比较及机理探讨[J].中国油脂,2005,(5):35-38.

