青蒿琥酯缓释固体分散体的制备及体外溶出度研究
黄兰芷, 赵志强, 衡林森, 何从林, 刘晓琴
(重庆邮电大学生物信息学院,重庆400065)
青蒿琥酯[1](Artesunate)化学名为二氢青蒿素-1,2-α-琥珀酸单酯,分子式为 C19O8H28,是具有倍半萜结构的抗疟青蒿素的衍生物之一。青蒿琥酯作为新型的抗疟药,具有高效、速效、低毒等特点,而且不易产生耐受性。青蒿琥酯除抗疟外,尚有治疗弓形虫病[2],抗肿瘤等作用[3]。但由于青蒿琥酯溶解性较差,目前市场上青蒿琥酯药物剂型较少,主要为片剂、栓剂、注射液等。而青蒿琥酯适用病症的治疗病程较长,需长期服药的特点,很有必要开发一种用药次数少,持续时间长的缓释制剂,以达到提高药物生物利用度的目的。
固体分散体(Solid Dispersion,简称 SD)[4]系指将固体药物,特别是难溶性固体药物以微粒、微晶或分子状态等形式均匀分散在固态载体物质中的体系。其主要特点是利用不同性质的载体,使药物在高度分散状态下达到不同要求的用药目的。例如,增加难溶药物的溶解度;延缓或控制药物释放;增大药物的稳定性;延缓药物氧化和分解;提高药物生物利用度;降低药物的毒性和副作用;控制药物在靶器官释放;掩盖药品的不良气味等。本实验采用溶剂法制备青蒿琥酯缓释固体分散体,以提高体外溶出度。
1 试药与仪器
青蒿琥酯(重庆华立武陵山制药有限公司,批号080402);乙基纤维素(EC10cp上海卡乐康公司);羟丙甲纤维素(HPMC15cp上海卡乐康公司);十二烷基硫酸钠(SLS,分析纯,天津市博迪化工有限公司);无水乙醇为分析纯。
ZRD6-8溶出度测定仪(天津大学无线电厂);TU-1901双光束紫外可见分光光度计(北京普析通用仪器有限公司);HH-2双孔电热恒温水浴锅(上海比朗仪器有限公司);GG88-DGF3006(A)电热鼓风干燥箱(北京中西远大科技有限公司);Mettler AE100电子分析天平(梅特勒一托利多仪器上海有限公司);DZF-6050B真空干燥箱(郑州南北仪器设备有限公司)。
2 实验方法
2.1 青蒿琥酯固体分散体制备 采用溶剂法制备缓释固体分散体,通过一系列初步研究和处方筛选,最终选择用乙基纤维素(EC)作为固体分散体的载体。先将载体和药物分别按一定比例溶于无水乙醇,待完全溶解后,将药物溶液与载体溶液在不断搅拌下置水浴中充分混合均匀,并待乙醇挥尽,混合物呈黏稠状态后,于60℃干燥,取出,粉碎,过筛整粒,即得。
2.2 青蒿琥酯含量测定 精密称定80℃干燥至恒重的青蒿琥酯对照品10 mg,置于50 mL量瓶中,加无水乙醇溶解并稀释至刻度,得到标准溶液。分别精密量取青蒿琥酯标准溶液 0、2、4、6、8、10 mL,各置50 mL量瓶中,加入10 mL 1 mol/L的氢氧化钠,加水稀释至刻度后于50℃的水浴锅中加热45 min,取出迅速冷却至室温,在238 nm的条件下测定吸光度。以浓度对应吸光度进行线性回归,得回归方程为:A=0.021 8C-0.004 9,相关系数 r=0.999 8,结果表明,青蒿琥酯在8.12 μg ~40.6 μg/mL 时,线性关系良好。
2.3 体外溶出度测定 按中国药典2005年版(二部)桨法测定,释放介质:含0.3%十二烷基硫酸钠的0.1 mol/L盐酸,温度(37±0.5)℃,转速:100 r/min。将3批固体分散体称取6份待测物适量,分别置于6个溶出杯中,定时取液5 mL(取出后迅速补加等量的新鲜介质),经0.8 μm微孔滤膜滤过,注入25 mL的量瓶中,加1 mol/L的氢氧化钠溶液5 mL,加水稀释至刻度后于50℃的水浴锅中加热45 min,取出迅速冷却至室温,在238 nm的条件下测定吸光度,求得青蒿琥酯的浓度并计算其累积释放百分率。
3 试验结果
3.1 不同种类的辅料对青蒿琥酯溶出度的影响
取4种不同黏度的乙基纤维素和药物分别按2∶1溶于无水乙醇,待完全溶解后,按前述方法进行制备固体分散体,并测定青蒿琥酯的溶出度。见图1。

图1 由不同种类辅料制得青蒿琥酯固体分散体累计释放率
从试验结果可看出,EC200cp由于黏度过大,在预期时间内累积释放率较低,而 EC10cp、EC20cp、EC45CP三种辅料制得的固体分散体均能实现缓释的效果,其中以EC10cp释放较完全,故选择EC10cp作为固体分散体的载体。
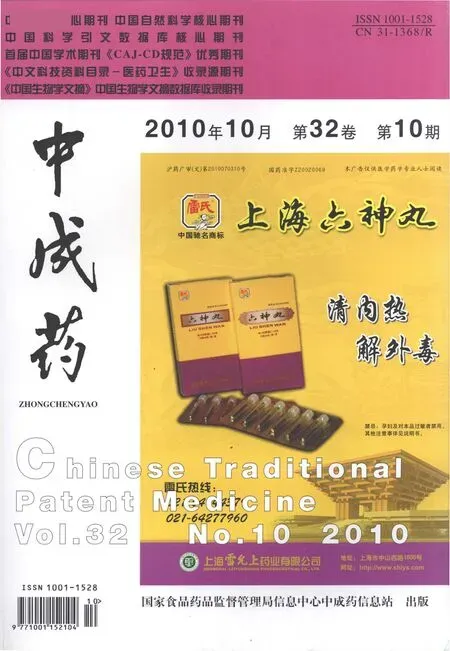
3.2 辅料用量对青蒿琥酯溶出度的影响 取EC10cp和药物分别不同比例溶于无水乙醇,待完全溶解后,按前述方法进行制备固体分散体,并测定其累积释放率。结果见图2。
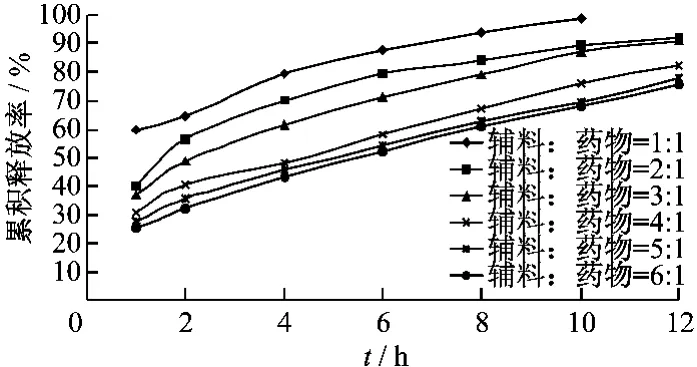
图2 不同辅料用量制得青蒿琥酯固体分散体累积释放率
由上图可见这几个比例的处方中,随着辅料与药物比例增大,释放速度减慢。辅料药物比为1∶1时,释药速度过快,8 h释放度就达到90%以上,基本没有缓释效果;而辅料:药物在4∶1、5∶1、6∶1时释药速度过慢。只有辅料药物比为2∶1和3∶1时,12 h释放度能达到90%以上,能满足缓释制剂的基本要求。依据在不影响药物疗效和作用的情况下,尽量减少辅料用量的原则,本方采用EC10cp:药品=3:1的比例进行制剂成型研究。
3.3 释放调节剂HPMC对青蒿琥酯溶出度的影响
取EC10cp、药物和不同黏度的HPMC按3∶1∶0.5比例溶于无水乙醇,待完全溶解后,按上述方法制备固体分散体,并测定其累积释放率。结果见图3。
从以上实验可看出,HPMC黏度增大,固体分散体体外释放度反而减小,可能是由于HPMC在药物表面形成的凝胶层阻滞了药物的释放。因此,选用黏度较小的HPMC15cp为释放调节剂进行筛选。

图3 不同HPMC制得青蒿琥酯固体分散体累积释放率
3.4 HPMC用量对青蒿琥酯溶出度的影响 取EC、HPMC和药物分别不同比例溶于无水乙醇,待完全溶解后,按前述方法进行制备固体分散体,并测定其累积释放率。结果见表1,图4。
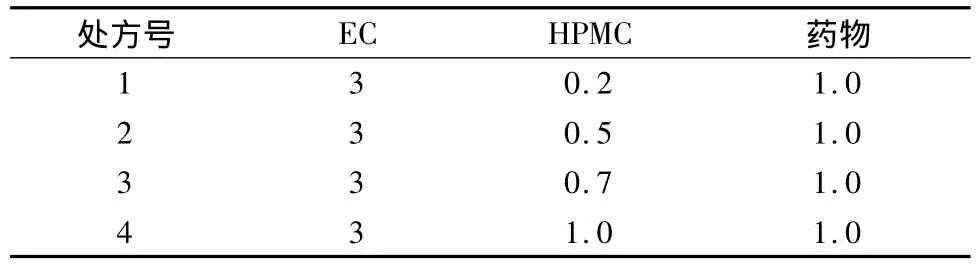
表1 HPMC用量筛选试验设计

图4 不同用量HPMC制得青蒿琥酯固体分散体累积释放度
结果表明,处方2的释放效果较为理想,故选择EC10cp、药品、HPMC 比例为3∶1∶0.5。
3.5 处方验证实验 依据试验所得出的最终处方,制备3批处方药物的缓释固体分散体,测定其体外释放度,用以验证处方的合理性和工艺的稳定性。结果见图5。
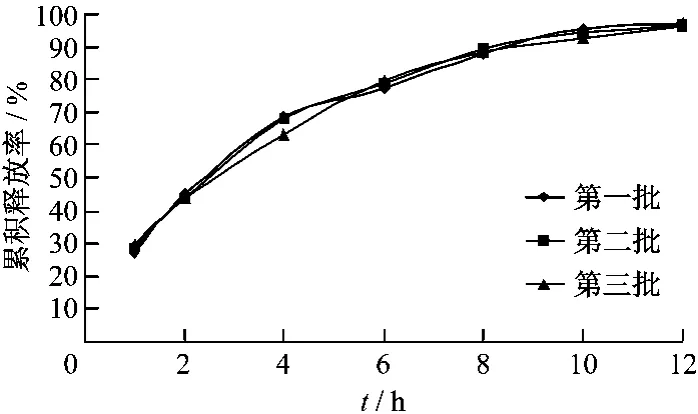
图5 3批青蒿琥酯固体分散体累积释放率
3批制剂的累积溶出度来看,缓释固体分散体中青蒿琥酯的累积释放率重现性好,缓释制剂体外释放度在1 h没有突释现象,2 h释放率在50%左右;12 h内释放率大于80%,说明本处方释放效果稳定。证明所选处方工艺基本合理,稳定。
4 讨论
4.1 对不同辅料比的累积释放率进行零级释放释药方程拟合,结果见表2。

表2 不同辅料比累积释放率释药拟合方程
辅料用量为药物4倍以上时,处方药物基本呈零级释放,没有缓释效果。由此可知,缓释制剂的辅料用量越大,其缓释效果降低,证实辅料用量也是影响其缓释效果的重要因素。
4.2 干燥方法对缓释制剂成型的影响
在本研究中,笔者曾用4种不同黏度的EC作为载体制备固体分散体,在研究中发现,黏度越高,采用溶剂法制备固体分散体的难度增加,其原因可能是由于载体黏度过大,影响药物与载体的干燥,从而影响到制剂的成型。在干燥方法的选择上,也尝试过多种干燥方式,发现普通的真空减压干燥时间较长,且得到的固体分散体质地韧性较大,不易粉碎。而后选择微波干燥法,得到的固体分散体质地韧性减小,脆性增大,易于粉碎制粒。微波干燥法具有干燥效率高,质量好,干燥温度低等特点,适于大生产使用,克服了常规干燥方法的缺陷,是一种新型、高效的干燥方法。
[1]刘 旭.青蒿素衍生物研究[J].药学通报,1980,15(4):39.
[2]王京燕,徐在海,王明道.青蒿素钠的毒性机理及对弓形虫的作用[J].中国药理学和毒理学杂志,1997,11(2):127.
[3]杨小平,潘启超,梁永钜.青蒿素钠的抗肿瘤作用[J].癌症,1997,16(3):186.
[4]胡容峰,梅康康.固体分散体技术及其在缓控释制剂中的应用[J].安徽医药,2008,(11):1001-1004.