铜与浓硫酸反应的实验探索
陈文兴,王敏,罗宿星
(1.遵义师范学院化学系,贵州遵义563002;2.仁怀酒都高级中学,贵州仁怀564500)
铜与浓硫酸的反应是高中化学教材中重要的演示实验之一,实验的原理是:Cu+2HSO4(浓)
2CuSO4+SO2↑+2H2O,实验方法是:在一支试管中加入一小块铜片,再加入3mL浓硫酸,然后用装有玻璃导管的单孔橡皮塞好,加热。将放出的气体通入品红溶液中,观察反应现象,见图1。反应完毕,冷却后,将试管中的液体慢慢倒入另一支盛有少量水的试管中,观察溶液的颜色[1]。
该实验的教学目的是让学生通过观察到的实验现象(生成物溶于水后溶液呈蓝色,放出的气体能使品红溶液褪色),了解并掌握浓硫酸的氧化性质。然而,教材提供的实验方法和步骤存在四方面的欠缺:第一、装置属半敞开式,蘸有NaOH溶液的棉花团不能保证完全吸收多余的二氧化硫气体,就有可能造成环境污染,达不到当今绿色化学的标准;第二、要将反应后的液体倒入另一支盛有水的试管中,必须将反应物冷却,使得实验时间较长操作又烦琐,导致教学环节松散;第三、生成物中仍有浓硫酸,溶于水时放出大量的热,给实验带进安全隐患;第四、生成物中夹杂有大量的黑色物质,这些黑色物质不溶于水影响对溶液颜色的观察,甚至根本观察不到蓝色的溶液,使得实验现象既不鲜明,教学效果又不明显。针对这些问题,作者对课本实验作了探索性的改进。

1 仪器与试剂
实验仪器:试管(20×180mm)、具支试管(20×180mm)、酒精灯、橡皮塞、乳胶头、导气管。
实验药品:2mol/LNaOH、0.05%品红、98%浓硫酸、棉花、铜片、铜丝。
2 试验方法
2.1 改进方法一
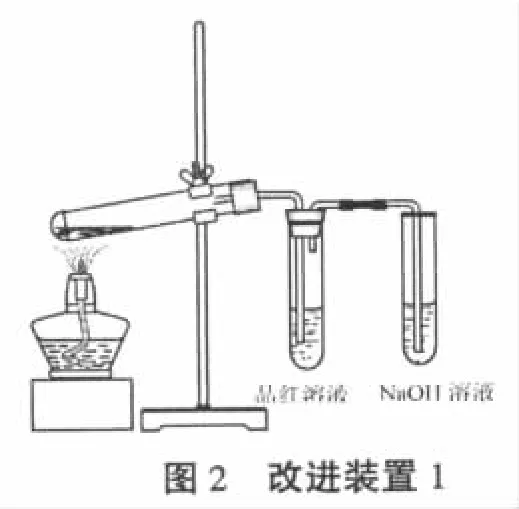
将蘸有NaOH溶液的棉花团改为装NaOH溶液的试管,确保完全吸收多于的二氧化硫气体。按图2所示安装实验装置,检查装置的气密性;在装有铜片的试管中加入3mL98%的浓硫酸,加热。待品红溶液褪至无色时,停止加热。
2.1.1 实验现象
反应过程中出现大量的黑色固体物质沉淀于试管底部,试管中产生大量白色烟雾,品红溶液褪至无色。
2.1.2 结果讨论
改进后的实验只解决了污染问题。但由于反应后期产生的SO2气体量减少,装置内的气压降低,易导致品红溶液倒吸。品红溶液一旦倒吸,就会产生干扰,导致实验失败。
2.2 改进方法二
增加缓冲装置,改品红溶液为蘸有品红溶液的长纸条放入试管内。图3所示。
2.2.1 实验现象
溶液开始变蓝的同时出现黑色的物质,并产生大量的白色烟雾,待品红试纸完全褪成无色时,试管中只有黑色固体和无色液体。

2.2.2 实验结果分析
由于98%的浓硫酸沸点是338℃[1],而硫酸铜晶体在218℃时就全部失水[2]。随着反应时间的增加,反应体系中的水分被蒸发,浓硫酸部分生成发烟硫酸,故产生大量的白色烟雾;产物硫酸铜处在非水体系中不显蓝色,因而观察不到蓝色的硫酸铜溶液生成。黑色的固体物质可能是铜与浓硫酸共热时反应生成的硫化亚铜和硫化铜的混合物。因为铜与浓硫酸反应时会有多种副反应发生[3],低于100℃时5Cu+4H2SO4(浓)Cu2S+3CuSO4+4H2O随着温度的升高,浓硫酸氧化性增强,继续发生如下的副反应:
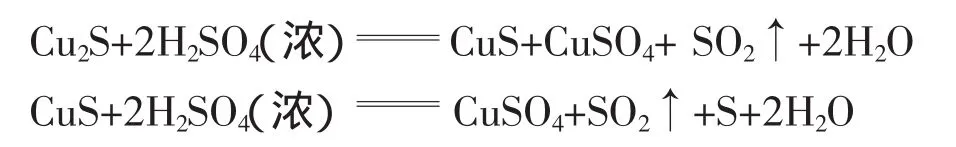
所以,在实验过程中由于黑色固体物质的干扰,既观察不到CuSO4的白颜色,也不易观察到Cu(H2O)SO4呈现的蓝色。
由此可知,影响反应的因素有:反应温度、反应时间、硫酸溶液的浓度。而导致黑色物质产生的主要原因是:反应时间过长、硫酸的浓度过大及未控制反应温度。当98%的浓H2SO4体积为3mL时,铜片的质量为0.1~0.6g(或相当于此用量比),实验效果较明显,实验成功率较高,故再次将实验改进。
2.3 改进方法三
2.3.1 实验方法改试管为具支试管,将铜片改为可上下抽动的铜丝。在橡皮塞上插入带有乳胶头的短玻璃管,将铜丝经乳胶头穿过玻璃管插入具支试管内,把铜丝末端绕成团,上端弯成小钩状(便于抽取悬入硫酸溶液中央的铜丝团,同时保证气密性),如图4所示。由于60%的浓硫酸就具有一定的氧化性[4]。向具支试管中加入3mL80%的硫酸溶液,预热硫酸溶液接近沸腾时,撤离酒精灯,将铜丝伸入硫酸溶液中,反应立即发生。当品红试纸褪至无色时,把铜丝抽离硫酸溶液。
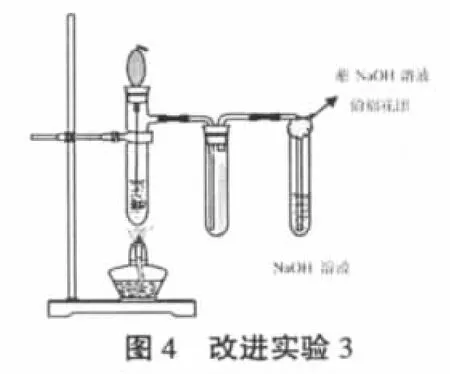
2.3.2 实验现象与结果反应开始试管中溶液逐渐变蓝,当品红试纸褪至无色时,溶液的蓝色鲜明,且没有黑色物质产生。
2.4 最佳反应条件
配制50%—95%不同浓度的硫酸溶液。分别用相同体积不同浓度的硫酸溶液与质量相同的可移动铜丝按图4的装置和2.3.1的方法做对比实验,得到表1所示的一组实验数据:
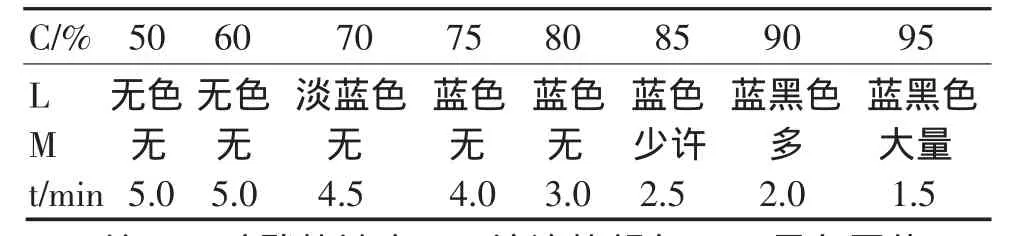
表1 铜丝与50%—95%的硫酸溶液反应
实验数据表明:硫酸溶液的浓度在70%—85%时,反应所需要时间较短,几乎看不到黑色沉淀,试管中溶液呈现的蓝色鲜明。再用72%—84%不同浓度的硫酸溶液,按2.3.1的方法进行对比试验,得到表2所示的一组实验数据:

表2 铜丝与72%—84%的硫酸溶液反应
3 结果与讨论
根据表1和表2所示的实验数据得出:用80%的硫酸溶液做此实验。品红试纸褪至无色时只需3.0分钟,试管中溶液呈现明显的蓝色,且没有黑色物质生成,是浓硫酸氧化铜的最佳反条件。
实验中应注意:(1)控制反应温度,温度不宜太高,用小火加热;(2)硫酸溶液加热至接近沸腾时再将铜丝团伸进硫酸溶液中,并且铜丝团应悬在硫酸溶液中央;(3)品红试纸褪成无色后,应立即把铜丝团抽离硫酸溶液终止反应。
改进后的实验具有以下优点:(1)整个实验装置简单,气密性良好,即能确保尾气被完全吸收,又避免了溶液倒吸;(2)可移动的铜丝既能灵活地控制反应进程,又可以重复使用,节约了药品;(3)简化了实验步骤,缩短了演示实验的时间。总之,经过探索改进后的实验现象既鲜明,教学效果又明显,不但达到绿色化学与环保的目的,同时还能开拓学生的思维,提高学生分析问题的能力。
[1] 人民教育出版社化学室.全日制普通高级中学教科书(必修)化学[M].北京:人民教育出版社,2003.
[2] 北京师范大学无机化学教研室,东北师范大学无机化学教研室,华中师范大学无机化学教研室,等.无机化学实验(第三版)[M].北京:高等教育出版社,2001.
[3] 杨丽君,沙丽丽.铜与浓硫酸反应实验的探究[J].玉溪师范学院学报,2005,22(12):43-45.
[4] 王贵和.中学化学实验研究[M].贵阳:贵州教育出版社,2000.

