c-FLIP和RECK在喉鳞状细胞癌及癌旁黏膜组织中的表达及其对于喉癌手术切除的意义
常 玮, 王斌全, 温树信, 张春明
喉鳞状细胞癌是头颈部常见的恶性肿瘤之一,癌基因的激活和抑癌基因的失活在其发生、发展中起重要作用。c-FLIP (细胞型Fas相关死亡域样白介素-1β转换酶抑制蛋白)是1997年发现的一类含有死亡效应结构域的凋亡抑制蛋白,能抑制Fas、INFR-1、DR3、TRAILR 介导的细胞凋亡。肿瘤转移抑制基因RECK是1998年发现的新型基质金属蛋白酶(MMPs)抑制剂,它可在转录后水平抑制多种MMP的表达,从而抑制肿瘤的侵袭及转移。在我国,对喉癌的治疗主张以手术为主的综合治疗,选择合理的手术切缘便显得非常重要。本实验旨在通过免疫组化和RT-PCR的方法,检测c-FLIP和RECK在喉癌及癌旁组织中的表达情况,探讨其与喉癌临床特征的关系,并从细胞的蛋白水平及基因水平探讨喉癌手术安全切缘的范围,为喉癌的诊断与治疗提供参考。
1 材料与方法
1.1 临床资料
收集2008年至2009年于山西医科大学第一医院耳鼻喉科及山西省肿瘤医院行手术治疗的喉癌患者38例资料,均为首次手术。详细记录患者年龄、肿瘤部位、表型、分期、分化及转移情况等。术前均经病理证实为鳞癌,术前均未进行放化疗等肿瘤学治疗。38 例中,男35 例,女3 例;年龄42~80岁,其中声门上型19例,声门型13例,跨声门型6例;临床分期按2002美国癌症联合会(AJCC) 分期方案进行:T1期4例,T2期18例,T3期10例,T4期6例;依据病理分化程度类型分为:高分化鳞癌10例,中分化鳞癌19例,低分化鳞癌9例。全部患者行手术治疗,对于T1、T2期行激光手术或放射治疗的病例不在本研究收取标本之列。喉全切除8 例,喉扩大次全切除伴发音重建7例,喉部分切除23例;25例行颈清扫术,经病理证实有淋巴结转移23例。术中行多方位切缘冰冻切片检查未见癌细胞。
1.2 标本收取
喉全切除及喉大部切除术后,检查全喉,在瘤体周围有较长距离黏膜的部位进行取材,保证可以取到距离瘤体边缘2 mm、5 mm、10 mm、15 mm的黏膜组织。对于喉部分切除术,术中清楚暴露肿瘤后,在不影响喉腔重建的黏膜处,分别距离肿瘤边缘2 mm、5 mm、10 mm、15 mm处取材。取材后,一半新鲜标本立即投入液氮罐,随后放入-80℃深低温冰箱中保存备RT-PCR实验用。另一半标本用10%甲醛固定,石蜡包埋。将癌组织,癌旁2 mm、5 mm、10 mm、15 mm处黏膜组织标本分别设为A、B、C、D、E组。
1.3 试剂
免疫组化试剂包括Goat Anti-Human RECK Monoclonal Antibody(Santa Cruz,美国),以及Rabbit Anti-Flip(北京博奥森生物技术有限公司),二步法PV-9000免疫组化检测试剂和浓缩型DAB试剂盒(北京中杉金桥生物有限公司);RT-PCR试剂包括Trizol Reagent,RT-PCR试剂盒(北京全式金生物技术有限公司)。
1.4 方法
1.4.1 免疫组织化学PV-9000二步法 参照PV-9000二抗试剂盒,检测石蜡标本切片中的RECK蛋白和c-FLIP蛋白的表达。RECK和c-FLIP先行预试验,确定合适的一抗浓度分别为1∶400和1∶200。抗原修复采用热修复。
1.4.2 RT-PCR法 按照Trizol说明书,提取各冻存组织总RNA,分别进行纯度和浓度的鉴定和检测。将合格总RNA按RT-PCR试剂盒要求进行逆转录合成cDNA,再加入目的基因引物进行PCR扩增,产物用1.5%琼脂糖电泳检测并记录结果。PCR引物由Primer 5.0设计,经上海生工公司合成(表1)。RECK和c-FLIP反应条件为:94℃预变性2 min,94℃变性30 s,55℃(RECK)30 s,57℃(c-FLIP,GAPDH)30 s退火;72℃(RECK、c-FLIP,GAPDH)40s延伸35个循环,最后72℃再延伸5 min,产物经1.5%琼脂糖电泳检测。
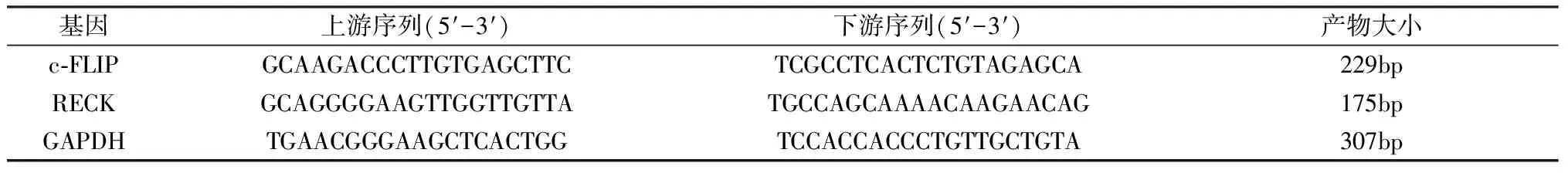
表1 RECK、c-FLIP,GAPDH引物序列和产物大小
1.5 结果判定标准
c-FLIP蛋白和RECK蛋白均表达于胞质中,故阳性标准细胞的胞质染色应呈棕黄色。参考Fujimura等[1-2]的标准,光镜下对每张切片随机取5个视野,根据阳性细胞的阳性强度按无着色、淡黄色、棕黄色和棕褐色分别评为0、1、2、3分;然后再按照色阳性细胞数所占百分比打分:小于5%为0分,5%~25%为1分,26%~50%为2分,大于50%为3分。最后以两者之和判断其表达结果:小于2分为阴性(-),2~4分为阳性(+),4~6(包括4)分为强阳性(++)。RT-PCR检测结果的判定以出现扩增带为阳性,应用图像分析软件Quantity One 4.4.0对电泳条带进行测定,其中PCR产物的含量以累积光密度(IOD)表示,IOD=平均光密度×发光面积,目的基因mRNA的相对含量以同一标本目的基因与内参照GAPDH的PCR产物含量的比值来表示;重复3次取平均值,如果无扩增条带,则IOD值为0。
1.6 统计学处理
2 结果
2.1 c-FLIP和RECK蛋白在喉癌组织和癌旁不同距离组织中的表达
c-FLIP在喉癌组织中阳性表达率为92.11%,在距癌旁2 mm、5 mm、10 mm及15 mm组织中的阳性表达率分别为84.21 %、36.84%、15.79%、10.53%,呈现出逐渐递减的趋势。癌组织与癌旁5 mm、10 mm、15 mm处组织之间分别比较差异均有统计学意义(P均<0.01);癌组织与癌旁2 mm组织之间比较,差异无统计学意义(P=0.283);癌旁5 mm与癌旁10 mm、15 mm组织之间差异无统计学意义(P均>0.05),详见表2,图示见图1、2。
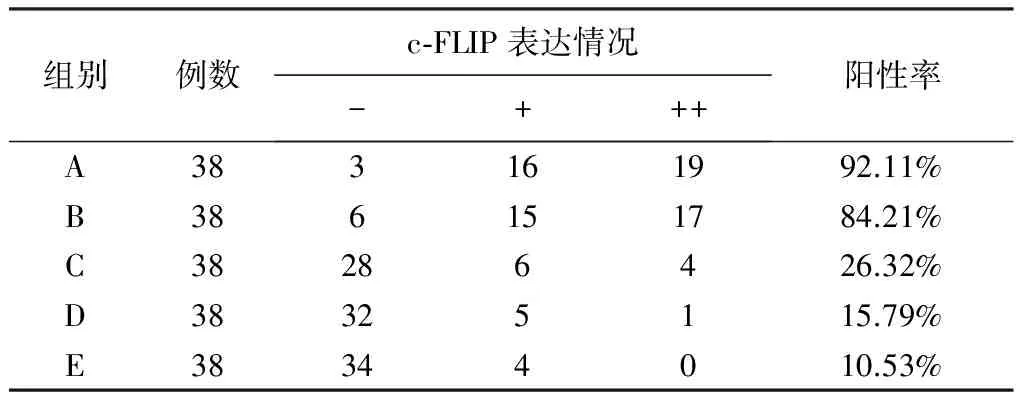
表2 c-FLIP蛋白在喉癌组织和癌旁不同距离组织中的表达
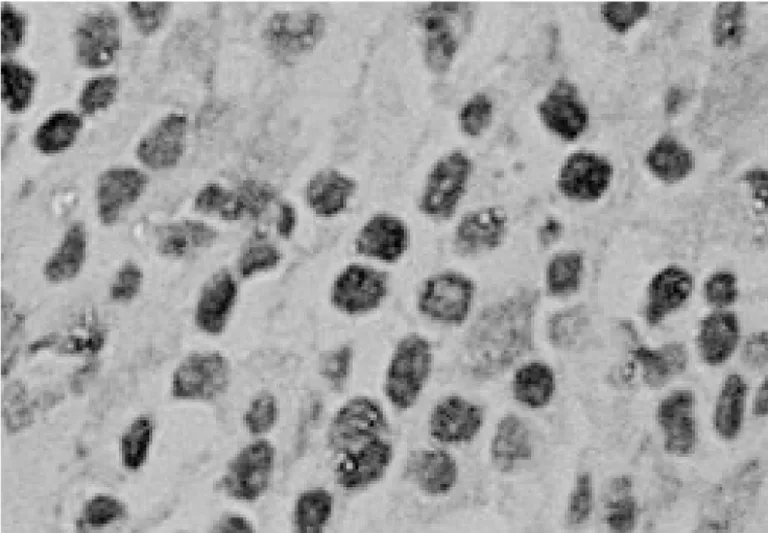
图1 c-FLIP在喉癌中的表达(×400)
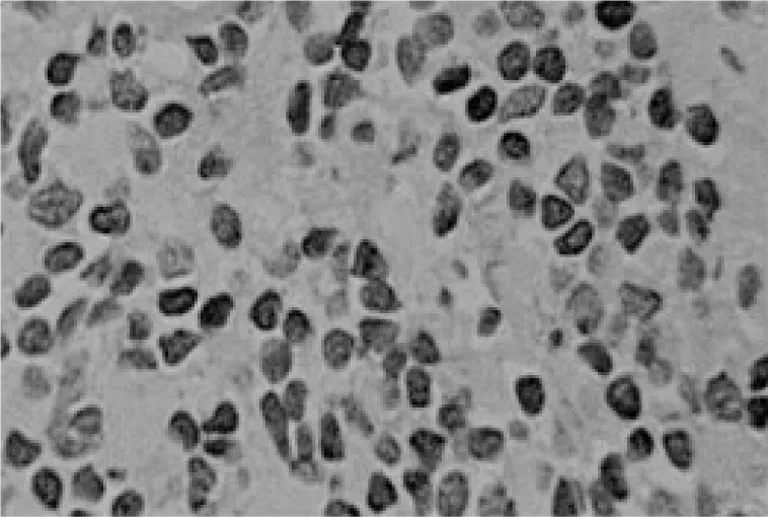
图2 c-FLIP在癌旁正常黏膜中的表达(×400)
RECK在喉癌组织中阳性表达率为60.53%,在距癌旁2 mm、5 mm、10 mm及15 mm组织中的阳性表达率分别为65.79%、89.47%、94.74%、100%。癌组织与癌旁5 mm、10 mm、15 mm之间分别比较差别均有统计学意义(P均<0.01);癌组织与癌旁2 mm组织之间比较,差别无统计学意义(P=0.634);癌旁5 mm与癌旁10 mm、15 mm组织之间差别无统计学意义(P均>0.05),结果见表3,图示见图3、4。
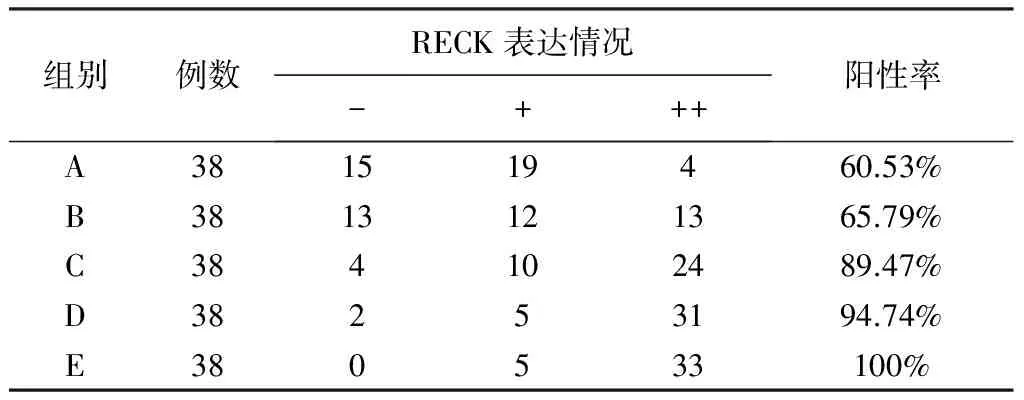
表3 RECK蛋白在喉癌组织和癌旁不同距离组织中的表达
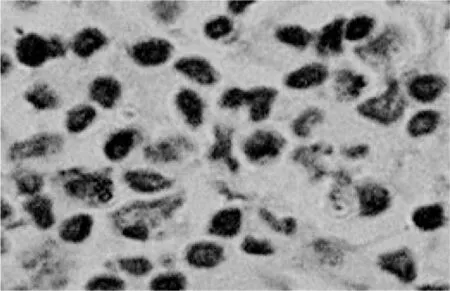
图3 PECK在喉癌中的表达(×400)

图4 PECK在癌旁正常黏膜中的表达(×400)
2.2 c-FLIP mRNA和RECK mRNA在喉癌组织和癌旁不同距离组织中的表达
从A组到E组c-FLIP mRNA的表达逐渐减弱,5组间的差别有统计学意义(P<0.01),从A组到E组RECK mRNA的表达逐渐增强,存在明显差别(P<0.01)。经组间多重比较,两种基因的表达 A组、B组分别与C、D、E组比较差异有统计学意义。RECK mRNA的表达A、B组之间以及D、E组之间差异无统计学意义,C组与D、E组之间比较有统计学意义。c-FLIP mRNA的表达A、B组之间以及C、D、E组之间差异无统计学意义。结果见表4,图示见图5、6、7。
表4 c-FLIP和RECK mRNA在喉癌组织和癌旁不同距离组织中的表达
注:各组数据经SPSS 13.0软件分析,方差齐,并呈正态分布。组间差异性比较采用方差分析。组间多重比较采用SNK检验,同一纵列不同字母间表示有显著差别
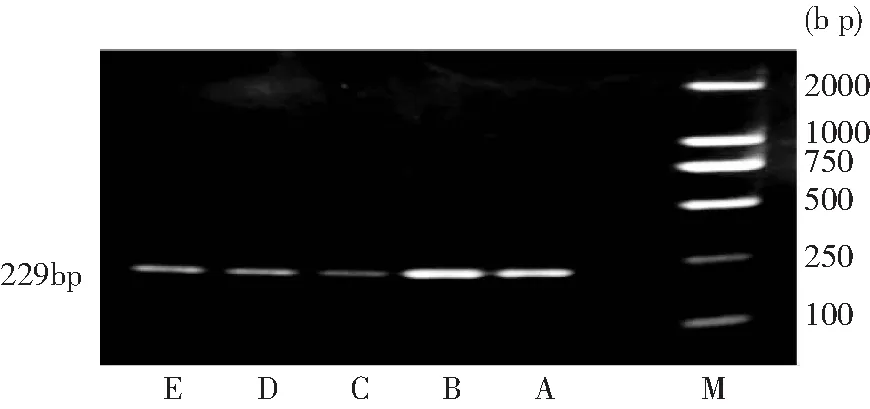
图5 c-PLIP mRNA在喉癌及癌旁不同距离黏膜组织中的表达
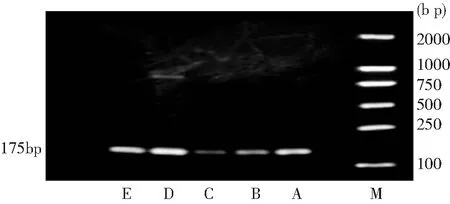
图6 RECK mRNA在喉癌及癌旁不同距离黏膜组织中的表达
图7 GAPDH mRNA在喉癌及癌旁不同距离黏膜组织中的表达A: 喉癌组织 B: 癌旁2 mm黏膜 C: 癌旁5 mm黏膜 D: 癌旁10 mm黏膜 E: 癌旁15 mm黏膜 M: Marker
2.3 c-FLIP和RECK的表达与喉鳞癌患者临床病理特征的关系
c-FLIP和RECK的表达与喉鳞癌患者的临床分期、病理分化程度及有无颈淋巴结转移有关(P均<0.01);而与喉癌的临床分型不相关(P>0.05)。
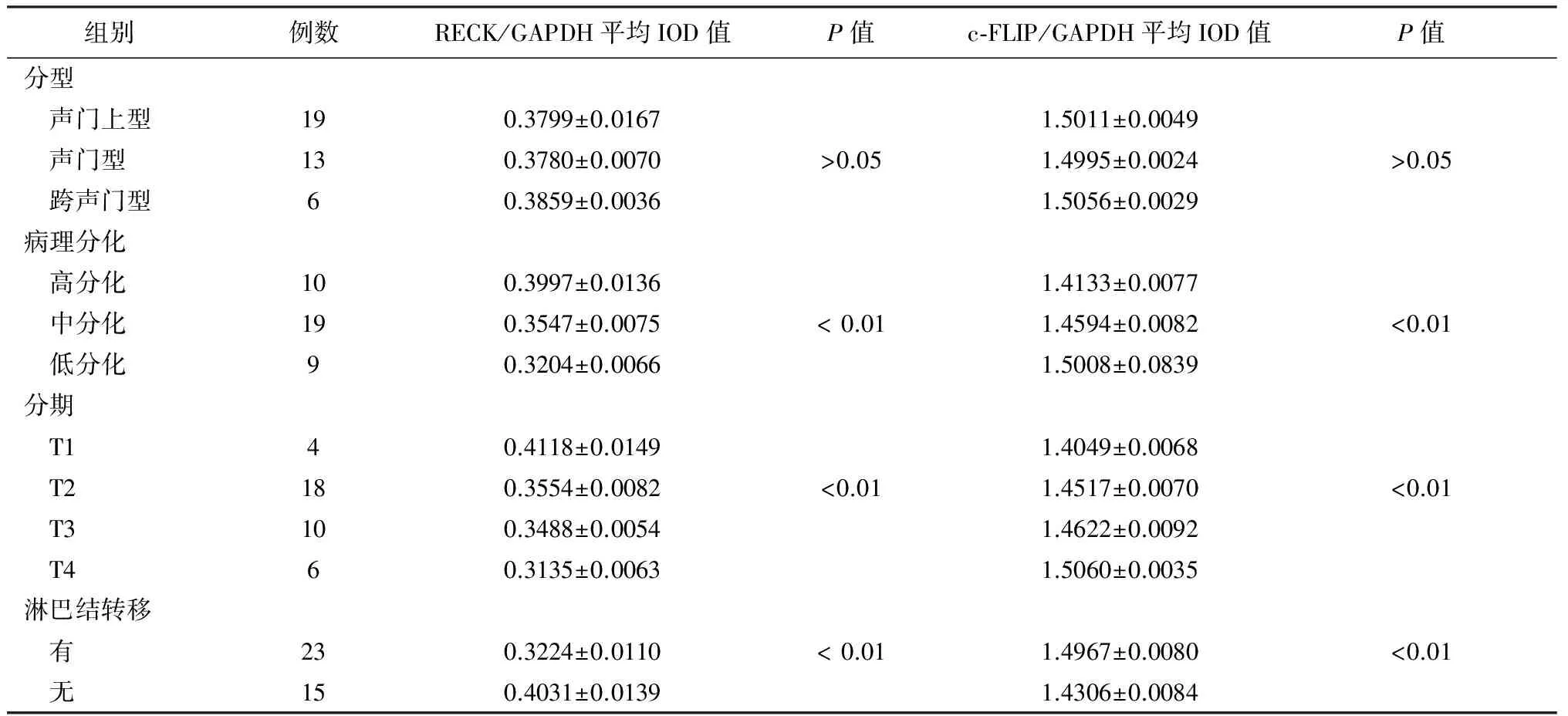
表5 c-FLIP和RECK mRNA在不同病理分化程度,不同临床分型、分期及有无淋巴结转移的喉癌中的表达情况
注:各组数据经SPSS 13.0软件分析,方差齐,并呈正态分布。组间差异性比较采用方差分析。
3 讨论
3.1 c-FLIP 蛋白在喉鳞癌组织中的表达及意义
c-FLIP是1997年Irmler[3]在研究恶性黑色素瘤时发现的一类含有死亡效应结构域(death effect domains, DED)的凋亡抑制蛋白,能抑制Fas、INFR-1、DR3、TRAILR 介导的细胞凋亡。目前认为c-FLIP基因与Caspase10的基因共同定位于人染色体2q33,其蛋白形式有两种:长链FLIPL和短链FLIPS。c-FLIP主要参与了Fas/FasL,TRAIL等死亡受体介导的凋亡途径,近几年已经明确证明TRAIL及Fas受体是肿瘤免疫监视的关键调节者[4],体内外实验均证实它们能够诱导肿瘤细胞的凋亡。c-FLIP能抑制此过程,其在肿瘤组织中常常过表达,成为肿瘤进展的因素之一[5]。多项研究证实[6],在黑色素瘤、胆管癌、胰腺癌、骨肉瘤、大肠癌、肺癌、卵巢癌、胃癌、食管鳞癌、口腔鳞癌和甲状腺癌等组织中均存在c-FLIP的过表达。本实验结果显示:(1)喉癌组织中c-FLIP mRNA相对表达量明显高于癌旁正常对照组,并沿着癌组织→癌旁2 mm→癌旁5 mm→癌旁10 mm→癌旁15 mm顺序递减。蛋白水平的研究亦表明,喉癌组织中c-FLIP蛋白的阳性表达率为92.11%,明显高于正常组织阳性率(10.53%),差异有统计学意义。提示c-FLIP可能对喉癌的发生发展有一定的促进作用。(2)喉癌组织中c-FLIP的表达水平与临床分型无关,而与病理分化程度,临床分期及淋巴结转移有关,高表达者易发生淋巴结转移,由此可见检测其表达可评估喉鳞癌的侵袭转移潜能,对于治疗方案的制定及判断预后有重要意义。c-FLIP有望成为喉鳞癌诊断和治疗研究的病理学靶向指标。
3.2 RECK蛋白在喉鳞癌组织中的表达及意义
RECK是1998年日本学者Takahashi等[7]将v-Ki-ras基因转染到小鼠的纤维原细胞(NIH3T3) 而克隆到的cDNA表达中分离出的新基因。RECK基因定位于人染色体9p12~13,整个基因的长度约87kb,其中包含21个外显子,20个内含子,共有13个单核苷酸多态性(SNP)。研究表明,RECK可以抑制基质金属蛋白酶(MMPs),从而抑制肿瘤的侵袭和转移[8]。RECK至少能在转录后水平调节3种MMP,即MMP-2、MMP-9和MTI-MMP(MMP-14),其中MMP-2和MMP-9是肿瘤浸润转移过程中涉及到的主要蛋白水解酶[9]。RECK基因及MMP的相互调节对于肿瘤新生血管形成起着重要作用。在无RECK基因表达的情况下,MMP的过表达可导致细胞表面细胞外基质(ECM)过度降解,血管及周围组织完整性降低,促进新生血管形成;相反,RECK基因的高表达可抑制新生血管的形成。Kumamoto等[10]对10例牙胚瘤、40例良性成釉细胞瘤、5例恶性成釉细胞瘤进行研究,发现在成釉细胞瘤中恶性程度越高RECK表达越低,RECK的表达与肿瘤的分期成负相关。本研究结果显示,喉癌组织中RECK mRNA相对表达量沿着癌组织→癌旁2 mm→癌旁5 mm→癌旁10 mm→癌旁15 mm的顺序递增。蛋白水平的研究表明,喉癌组织中RECK蛋白的阳性表达率为60.53%,明显低于癌旁正常组织阳性率(100%),差异有统计学意义。同时本实验还发现RECK的表达与喉癌临床分型无关,而与病理分化程度、临床分期及有无淋巴结转移有关。喉癌的病理分化程度越低,临床分期越晚,且有淋巴结转移的情况下RECK蛋白及mRNA表达明显下调,这提示RECK作为一种肿瘤转移抑制基因参与抑制喉鳞癌的浸润和转移。高表达的RECK基因可以保护细胞外基质及基底膜不被肿瘤细胞降解,从而使其向淋巴管浸润的能力大大降低。RECK基因可以成为喉癌诊断治疗及预后评估中一个重要病理学指标。
3.3 c-FLIP和RECK在喉癌外科手术中的应用
手术切除仍是各型喉鳞癌最主要的治疗手段。目前的手术方法主要有全喉切除术及喉部分切除术。但全喉切除会造成患者吞咽功能受到影响,发音功能丧失和呼吸通道改变,在彻底切除肿瘤、减少局部复发,又尽可能保留喉的发声功能,提高患者的生存质量,是研究的重要课题。
本研究采用免疫组化和RT-PCR方法检测癌组织及癌旁不同距离组织中的c-FLIP和RECK的表达情况,以确定恰当的手术切缘。结果显示,c-FLIP在喉癌组织和癌旁15 mm处组织的表达有明显差异。在癌组织向正常组织移行的过程中,其表达水平逐渐降低。c-FLIP在癌组织中的表达水平与癌旁5 mm、10 mm、15 mm处组织差异有统计学意义,与癌旁2 mm处差异无统计学意义。而癌旁5 mm、10 mm、15 mm处组织比较无差异。RECK的表达与c-FLIP正好相反。这样的差异表明距离肿瘤边缘5 mm以内的癌旁组织有明显恶变倾向,这种潜在的恶变性质表现为基因的异常表达,构成了喉癌手术后局部复发的基础和根源。由此得出结论:喉鳞状细胞癌手术切除的范围应该包括距离肿瘤边缘5 mm之内的癌旁黏膜组织。当然,这一结果还需要结合长期随访结果来综合判断。建立完善的喉癌切缘立体研究结构,精确地指导各类术式的切缘安全界,将是我们的下一步目标。
[1] Fujimura M, Watanabe M, Shimizu H, et al. Expression of matrix metalloproteinases (MMPs) and tissue inhibitor of metalloproteinase (TIMP) in cerebral cavernous malformations: immunohistochemical analysis of MMP-2, -9 and TIMP-2[J]. Acta Neurochir (Wien), 2007,149(2):179-183.
[2] Takagi S, Kato Y, Asano K, et al. Matrix metalloproteinase inhibitor RECK expression in canine tumors[J]. J Vet Med Sci, 2005, 67(8):761-767.
[3] Irmler M, Thome M, Hahne M, et al. Inhibition of death receptor signals by celluar FLIP[J]. Nature, 1997, 388 (6638) :190-195.
[4] Yagita H, Takeda K, Hayakawa Y, et al. TRAIL and its receptors as targets for cancer therapy [J]. Cancer Sci, 2004,95(10):777-783.
[5] French LE, Tschopp J. Defective death receptor signaling as a cause of tumor immune escape[J]. Semin Cancer Biol, 2002, 12(1):51-55.
[6] Mitsiades CS, Poulaki V, McMullan C,et al. Novel histone deacetylase inhibitors in the treatment of thyroid cancer[J]. Clin Cancer Res, 2005,11(10):3958-3965.
[7] Takahashi C, Sheng Z, Horan TP, et a1.Regulation of matrix metalloproteinase-9 and inhibition of tumor invasion by the membrane-anchored glycoprotein RECK[J]. Proc Natl Acad Sci USA, 1998, 95(22):13221-13226.
[8] Noda M, Oh J, Takahashi R, Kondo S, et al. RECK: a novel suppressor of malignancy linking oncogenic signaling to extracellular matrix remodeling[J]. Cancer Metastasis Rev, 2003, 22(2-3):167-175.
[9] Clark JC, Thomas DM, Choong PF, et al. RECK—a newly discovered inhibitor of metastasis with prognostic significance in multiple forms of cancer[J]. Cancer Metastasis Rev, 2007, 26(3-4):675-683.
[10] Kumamoto H, Ooya K. Immunohistochemical detection of MT1-MMP, RECK, and EMMPRIN in ameloblastic tumors[J]. J Oral Pathol Med, 2006, 35(6):345-351.
