Snail转录因子在肝癌中的表达及干扰Snail对肝癌转移的影响
钱 明, 张士群, 朱 嘉
肝癌具有隐匿和高度侵袭的特点,早期即可发生转移,传统疗效较差,基因治疗被寄予厚望。Snail是转录因子Snail家族中编码锌指蛋白的转录因子,可以介导上皮细胞向间充质细胞的转化,并抑制E-cadherin(上皮细胞钙黏蛋白)的表达,在肺癌、乳腺癌、结直肠癌、食管癌等研究[1-5]中均发现,Snail可促进肿瘤的侵袭和转移。本研究探讨了Snail,E-cadherin蛋白和mRNA在肝癌组织中的表达及其与转移的关系,并观察Snail对E-cadherin mRNA和蛋白表达的逆转作用及对HCC9024细胞株体外侵袭、运动的抑制作用。
1 材料和方法
1.1 一般资料 选取江苏大学附属医院普外科2001年10月至2008年10月临床病理资料完整的肝癌(术后病理证实)手术切除组织标本36例,其中男24例,女12例;中位年龄56.6岁;发生淋巴结转移和远处转移(腹膜种植、周围浸润)16例,无转移20例。以正常肝组织和癌旁组织标本36例作为对照。所有患者术前均未接受任何放化疗及免疫治疗。无菌条件下切取标本后立即置液氮中,后转移至-80℃保存。
1.2 细胞培养 HCC9024细胞系人肝转移细胞株,可应用于肝癌转移机制研究和抗肝转移药物的筛选。在37℃ 5% CO2含有10%小牛血清的DMEM培养基中培养。取对数生长期的细胞为研究对象。
1.3 主要试剂 鼠抗人Snail单抗、鼠抗人E-cadherin单抗(SANTA CRAUZ公司);鼠抗人β-actin单抗(江苏碧云天生物技术公司);免疫组化SP试剂盒(福建迈新生物公司);Lipofectamine(INVITROGEN);质粒提取试剂盒(AXYGEN); Millicell(MilliPore);Matrigel和6孔板(美国BD公司);Snail-shRNA-1和shRNA-1由海口市人民医院王齐全博士惠赠。
1.4 免疫组化法检测肝癌组织Snail及E-cadherin蛋白表达 取无出血、无坏死的组织经10%福尔马林固定24 h以上,石蜡包埋,连续切片,厚度4 μm。石蜡切片脱蜡至水,PBS冲洗3 min×3次,柠檬酸缓冲液修复抗原。3%H2O2灭活内源性过氧化物酶10 min,PBS冲洗3 min×3次,除去PBS,滴加50 μL 5%BSA(牛血清蛋白),室温下孵育10 min,除去血清,滴加50 μL一抗,4℃过夜。Snail蛋白的稀释度为1∶50,E-cadherin蛋白稀释度为1∶100,用武汉博士德公司提供的已知人直肠癌切片作阳性对照,以PBS代替一抗作阴性对照,PBS冲洗3 min×3次,除去PBS液,滴加50 μL生物素标记的二抗,室温下孵育10 min, PBS冲洗3 min×3次,除去PBS液,滴加50 μL链霉菌抗生物素——过氧化物酶溶液,室温下孵育10 min,PBS冲洗3 min×3次,DAB显色(镜下控制显色时间),自来水冲洗3 min终止反应,苏木素复染,自来水冲洗返蓝。切片经过梯度酒精脱水干燥,二甲苯透明,中性树脂封固。阳性判断标准:Snail蛋白以细胞核或胞浆内有棕黄色细颗粒为阳性,E-cadherin表达以肿瘤细胞胞质或胞膜出现棕黄色细颗粒为阳性。阳性细胞百分组成<10%为阴性,阳性细胞≥10%为阳性。
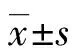
1.6 基因转染及稳定表达细胞株的筛选 加入0.25% 的胰酶处理HCC9024细胞后,按每孔4×104个细胞均匀加至96孔板中,当细胞达85%~90%汇合时,分别转染Snail-siRNA和pNeg-siRNA质粒(阴性对照用),具体操作按照脂质体转染试剂Lipofectamine 2000说明书进行。转染24 h后将细胞以1∶10 比例传代,次日开始用含有500 μg/mL G418的培养基进行筛选培养,每3 d更换1次培养基,连续筛选3周,随后将获得的细胞克隆,扩大培养,取转染48 h后的细胞为瞬时转染组,转染3周后的细胞为稳定转染组。
1.7 RT-PCR检测HCC9024细胞中Snail及E-cadherin mRNA的表达 分别取未转染组、瞬时转染组、稳定转染组的细胞,加入Trizol试剂后匀浆,抽提总RNA;按逆转录试剂盒说明合成cDNA,后按照1.5方法进行操作。
1.8 Western blot检测HCC9024细胞中Snail及E-cadherin蛋白的表达 分别提取未转染组、瞬时转染组、稳定转染组的细胞总蛋白进行Western Blot检测:SDS-PAGE分离胶浓度为12%,积层胶浓度为5%,上样量为15 μg/L;SDS电泳条件:恒流,每块板20~40 mA,电泳时间约2 h;转膜条件:恒流,每张膜42 mA,时间3.5 h。
1.9 重组细胞摹底膜侵袭实验 设未转染组、pNeg-siRNA质粒(阴性对照组)和Snail-siRNA质粒(转染Snail组)3个试验组。将matrigel按40μL/孔均匀地铺在millicell膜上,37℃成胶30 min,置紫外灯照射过夜,实验前再次成胶30 min。待培养的肿瘤细胞达80%饱和度时,消化、计数,取不同处理组细胞2.0×103个,分别接种到成胶的millicell内,将millicell小室置于24孔板内,用含10%PBS的RPMI1640 培养液培养48 h后,取millicell去除matrigel,少量PBS洗3次,95%的乙醇固定15 min,HE染色,揭下millicell膜反贴在载玻片上。结果判定:在200倍光镜下,每个滤膜分别计数5个视野的穿膜细胞数,并计算每个视野的平均穿膜细胞数。
1.10 体外细胞运动实验 分组同1.9,取Transwell小室放入24孔板,将稳定转染后的HCC9024细胞经胰酶消化,稀释至1×106/mL,后按照文献[6]方法进行操作。
2 结果
2.1 Snail及E-cadherin蛋白的表达 肝癌组织中Snail阳性率44%(16/36),而正常肝组织中Snail阳性率8.3%(3/36),两者差异有统计学意义(P<0.05)。肝癌组织中E-cadherin阳性率16.7%(6/36),全部为低表达,正常肝组织中E-cadherin阳性率53%(19/36),两者差异有统计学意义(P<0.05)。Snail在转移组阳性率(75%,12/16)明显高于无转移组(20%,4/20),两者差异有统计学意义(P<0.05)。E-cadherin阳性表达的6例全部在无转移组,与转移组比较差异有统计学意义(P<0.01)。
2.2 Snail及E-cadherin mRNA的表达 在肝癌组织中Snail mRNA表达为0.935 4±0.089 3,正常肝组织中为0.104 5±0.053 6,两者差异有统计学意义(P<0.01)。转移肝癌组织中Snail mRNA表达为1.216±0.091 4,无转移组织为0.768±0.071 8,差异有统计学意义(P<0.05)。E-cadherin mRNA在肝癌中的表达为0.170 2±0.035 3,在正常肝组织中为0.584 4±0.064 9,两者差异有统计学意义(P<0.05)。转移肝细胞癌组织中未见E-cadherin mRNA表达。
2.3 HCC9024细胞转染质粒后Snail及E-cadherinmRNA表达的变化 Snail mRNA在未转染组、瞬时转染组、稳定转染组中的表达为0.985±0.016,0.554±0.011,0.206±0.017,差异有统计学意义(P<0 .05)。E-cadherin mRNA在未转染组、瞬时转染组、稳定转染组中的表达为0.120±0.001,0.360±0.002,0.727±0.006,差异有统计学意义(P<0.05)。
2.4 HCC9024细胞转染质粒后Snail及E-cadherin蛋白表达的变化 HCC9024细胞Snail蛋白与E-cadherin蛋白在未转染组、瞬时转染组、稳定转染组中的表达变化见图1A,1B。Snail蛋白的表达在转染质粒后明显降低,E-cadherin蛋白的变化规律则与Snail相反。
2.5 HCC9024细胞体外运动和侵袭能力的比较 Transwell小室体外运动实验显示,未转染组、阴性对照组及转染Snail组跨膜细胞数分别为(393±28)、(352±24)、(96±13)个/高倍镜(×200),差异有统计学意义(P<0.01)。重组细胞基底膜侵袭实验显示,3组穿透基底膜细胞数分别为(223±69)、(202±64)、(65±19)个/高倍镜(×200),差异有统计学意义(P<0.05)。
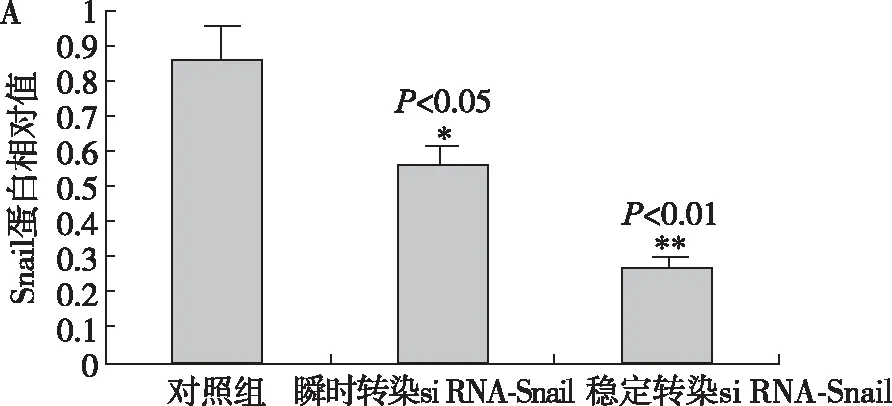
图1A Snail-shRNA-1转染对Snail蛋白表达的影响
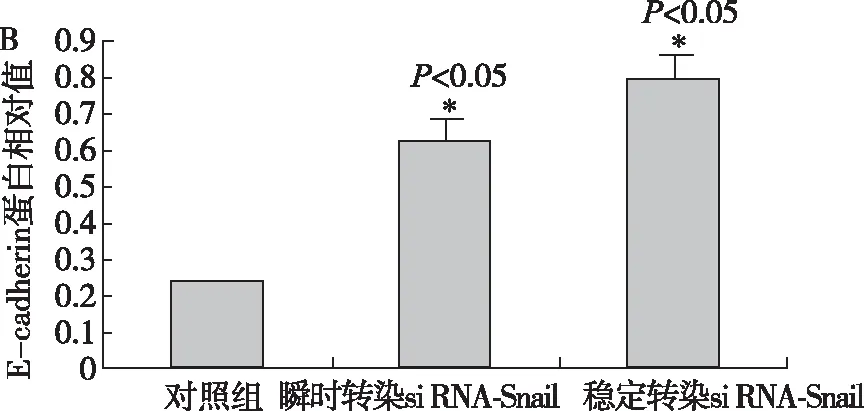
图1B Snail-shRNA-1转染对E-cadherin蛋白表达的影响
3 讨论
3.1 Snail及E-cadherin在肝癌组织中的表达 Snail是编码锌指蛋白的基因,多个研究报道[1-5],Snail在多种恶性肿瘤中存在明显上调,Snail上调的肿瘤易出现远处转移、深层浸润和较差预后。研究认为,恶性肿瘤侵袭、转移的通常表现为失去上皮细胞标志物而重新表达间充质细胞标志物,并且证实,肿瘤细胞的此种特性与E-cadherin表达的下调密切相关[7]。
最近发现Snail是E-cadherin的强烈抑制基因,Snail能明显下调肿瘤细胞内E-cadherin表达,因此,Snail表达与肿瘤转移相关。Snail和E-cadherin在很多肿瘤上皮细胞中存在明显的反向表达。
本研究采用免疫组化和RT-PCR技术检测了Snail及E-cadherin在肝癌组织中的表达,结果为:肝癌组织中Snail高表达,正常肝组织微量表达,提示Snail与肝癌的发生可能有关。Snail在转移组的阳性率为75%(12/16),明显高于无转移组(20%,4/20),提示Snail与肝癌转移有关。36例肝癌中有6例E-cadherin表达阳性,并且全部表达在无转移组,Snail和E-cadherin存在明显的反向表达,抑制Snail可能抑制肝癌的转移。
3.2 肝细胞中Snail与E-cadherin mRNA表达的逆转关系 本研究以有高转移潜能的肝癌细胞株HCC9024为研究对象,RT-PCR检测证实,HCC9024细胞存在Snail mRNA的明显表达,而未检测到E-cadherin mRNA的表达,说明肝癌细胞中存在Snail与E-cadherin mRNA表达的逆转关系。为进一步证明这种逆转关系的存在,我们瞬时转染Snail干扰质粒,观察Snail和E-cadherin mRNA表达的变化,发现在HCC9024细胞中Snail mRNA表达降低的同时,E-cadherin mRNA开始表达;而稳定转染Snail干扰质粒后,Snail mRNA下降,E-cadherin mRNA上升则更明显,证实两者存在逆转关系。
3.3 干扰Snail对肝癌细胞侵袭、运动能力的抑制作用 肿瘤细胞在缺失E-cadherin表达时侵袭性增强,容易发生转移。Joseph等[8]最新研究证明,在卵巢癌细胞株中,Snail不仅抑制E-cadherin的表达,还间接调控基质金属蛋白酶家族成员的表达以增加细胞的侵袭能力。Sivertsen等[9]发现,在恶性黑色素瘤细胞株中,Snail通过调节基质金属蛋白酶家族成员表达以增加细胞的侵袭能力,而与E-cadherin的表达无关。
本研究体外侵袭和运动实验表明,当Snail mRNA 受到抑制后,可以显著降低HCC9024细胞的运动能力且侵袭细胞外基质的能力明显下降。但Snail介导的肝癌细胞侵袭能力的改变是否与基质金属蛋白酶家族成员相关尚需进一步的实验证明。
总之,本研究显示,肝癌细胞中Snail mRNA可影响E-cadherin mRNA的表达,并在肿瘤细胞获得侵袭和转移能力的过程中起重要作用,阻断Snail mRNA的表达可能会为肝癌的治疗提供新的思路。
[1] Hajra KM, Chen DY, Fearon ER. The SLUG zinc-finger protein represses E-cadherin in breast cancer[J]. Cancer Res, 2002, 62(6):1613-1618.
[2] Sugimachi K, Tanaka S, Kameyama T, et al. Transcriptional repressor snail and progression of human hepatocellular carcinoma[J]. Clin Cancer Res, 2003, 9(7):2657-2664.
[3] Uchikado Y, Natsugoe S, Okumura H, et al. Slug Expression in the E-cadherin preserved tumors is related to prognosis in patients with esophageal squamous cell carcinoma[J]. Clin Cancer Res, 2005, 11(3):1174-1180.
[4] Shih JY, Tsai MF, Chang TH, et al. Transcription repressor Snail promotes carcinoma invasion and predicts outcome of patients with lung adenocarcinoma[J]. Clin Cancer Res, 2005,11(22):8070-8078.
[5] Shioiri M, Shida T, Koda K, et al. Snail expression is an independent prognostic parameter for poor survival in colorectal carcinoma patients[J]. Br J Cancer, 2006, 94(12):1816-1822.
[6] Sun D, Baur S, Hay ED. Epithelial-mesenchymal transformation is the mechanism for fusion of the craniofacial primordia involved in morphogenesis of the chicken lip[J]. Dev Biol, 2000, 228(2):337-349.
[7] Endo K, Ueda T, Ueyama J, et al. Immunoreactive E-cadherin, alpha-catenin, beta-catenin, and gamma-catenin proteins in hepatocellular carcinoma: relationships with tumor grade, clinicopathologic parameters, and patients' survival[J]. Hum Pathol, 2000, 31(5):558-565.
[8] Joseph MJ, Dangi-Garimella S, Shields MA, et al. Snail is a downstream mediator of transforming growth factor-beta1-induced matrix metalloproteinase-9 expression and invasion of oral cancer cells[J]. Cell Biochem, 2009,108(3):726-736.
[9] Sivertsen S, Hadar R, Elloul S, et al. Expression of Snail, Snail and Sip1 in malignant mesothelioma effusions is associated with matrix metalloproteinase, but not with cadherin expression[J]. Lung Cancer, 2006, 54(3):309-317.
