乳腺浸润性导管癌超声声像与分子免疫学指标检测相关性探讨
谭旭艳, 吴 丹, 高志刚
2007年美国临床肿瘤学会(ASCO)再次发布乳腺癌肿瘤标记物使用和建议的更新和修订[1],雌激素受体(ER),孕激素受体(PR)及人类上皮生长因子受体(cerbB-2)的检测成为乳腺癌常规病理检查项目,是确定治疗方案和预后评估的客观依据。高频超声对肿瘤形态学特征显示清晰,诊断率高。本研究回顾性总结和探讨乳腺浸润性导管癌(infitrating ductal carcinoma,IDC)超声声像特征与肿瘤病理免疫检查ER、PR、cerbB-2表达之间的关系。
1 资料与方法
1.1 一般资料 收集2008年6月至2010年2月我院住院及门诊的98例乳腺癌患者,均为女性,年龄25~74岁,平均50.6岁;1例为多灶性乳腺癌,其余均为单侧单发。全部病例行高频超声检查,并行超声引导自动穿刺活检(USGAB)获得病理诊断及免疫组化ER、PR、cerbB-2的检测结果。所有病例的诊断均有我院外科手术结果做佐证,最终病理诊断为乳腺浸润性导管癌。
1.2 仪器及方法 采用百胜DU-8,GE公司Logic-7彩色多普勒超声诊断仪,高频线阵探头,探头频率7~10MHz。对乳腺4个象限、乳晕及双侧腋窝行直接扫查,仔细观察并记录肿块的声像,包括边缘毛刺征、微钙化、后方回声衰减、周边高回声晕、肿瘤纵横径比值(L/T)及腋窝淋巴结肿大等特征。
标本处理及判断标准:穿刺活检的肿瘤标本经4%甲醛固定,石蜡包埋,行HE染色及免疫组化染色(Envision二步法),ER、PR、CerbB-2试剂盒(克隆号)分别为SP1、SP2及A-0485,均为DaKo公司产品,一抗、二抗均购自上海基因科技公司。DAB显色,在显微镜下观察结果:ER、PR以核着色为阳性,CerbB-2以膜着色为阳性。阴性组对照用PBS替代一抗,用已知阳性片做阳性对照。
1.3 统计学处理 应用SPSS 17.0统计学软件,两组数据间比较采用χ2检验。
2 结果
98例的肿瘤大小为 6~58 mm,中位数19 mm。小于10 mm 8例,占8%;10~20 mm 62例,占63.27%;20~40 mm 25例,占25.51%;大于40 mm 3例,占3.06%。肿瘤标本的ER、PR、CerbB-2检测结果见表1,超声图像特征与ER、PR、CerbB-2检测结果的相关关系见表2。

表1 98例乳腺IDC的ER、PR、cerbB-2的检测结果及百分率
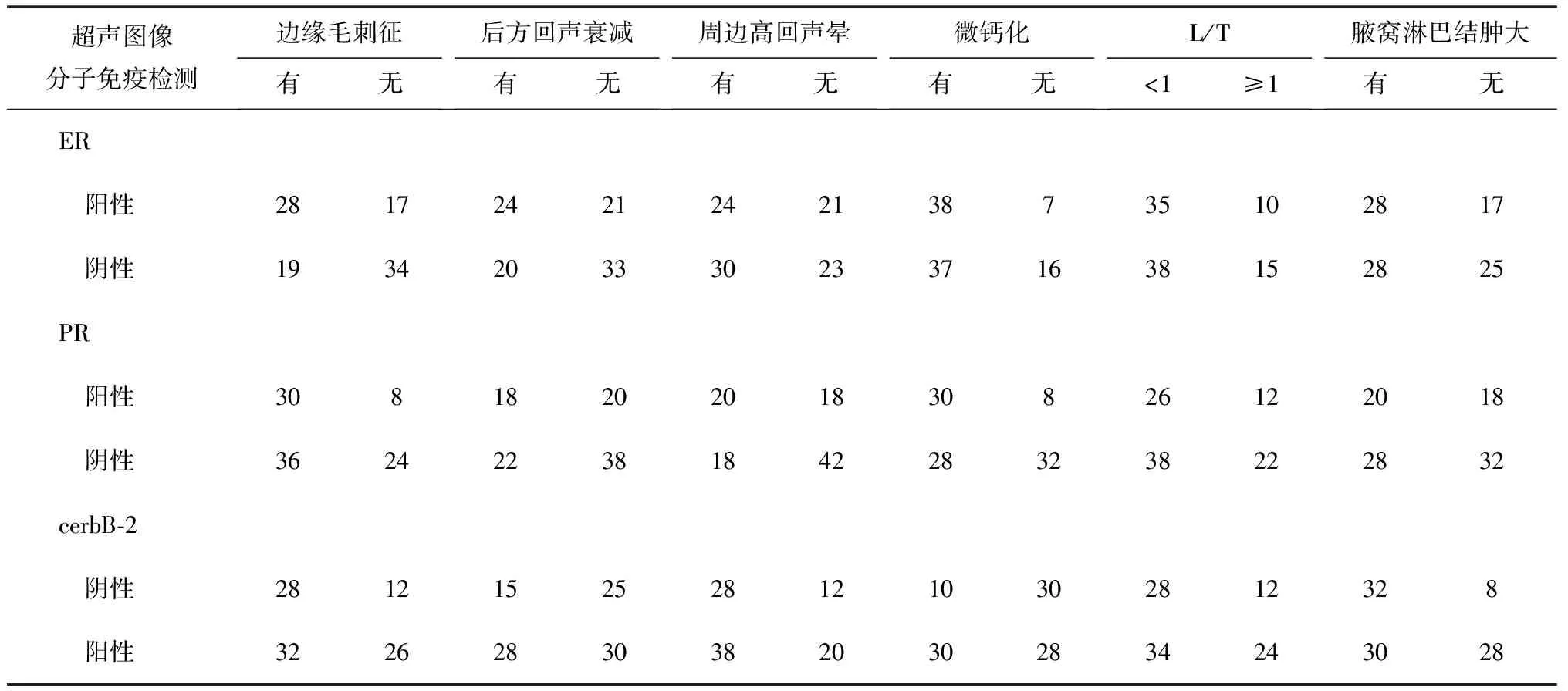
表2 98例乳腺IDC超声图像特征和ER、PR、cerbB-2检测的相互关系
从表2中可见,ER组超声图像肿瘤边缘毛刺征占47.96%(47/98),且有边缘毛刺征的ER表达阳性率显著高于无边缘毛刺征者,差异有统计学意义(P<0.01);有后方回声衰减,周边高回声晕,微钙化,L/T<1及腋窝淋巴结肿大的ER表达阳性率高于无后方回声衰减,无周边高回声晕,无钙化,L/T≥1及腋窝淋巴结肿大组,但差异无统计学意义(P>0.05)。
PR组肿瘤微钙化征占59.18%(58/98),有微钙化征的PR表达阳性率显著高于无微钙化征,差异有统计学意义(P<0.01);有边缘毛刺征占67.35%(66/98),有周边高回声晕征占38.78%(38/98),有边缘毛刺征和周边高回声晕征的PR表达阳性率高于无边缘毛刺征及周边高回声晕组,差异有统计学意义(P<0.05);L/T<1、有腋窝肿大淋巴结及无后方回声衰减征的PR表达阳性率高于L/T≥1、无腋窝淋巴结肿大及有后方衰减征组,但差异均无统计学意义(P>0.05)。
cerbB-2组有微钙化征占40.82%(40/98),有腋窝肿大淋巴结征占63.27%(62/98),其cerbB-2表达阳性率显著高于无微钙化征及无腋窝肿大淋巴结征组,差异有统计学意义(P<0.01)。有边缘毛刺征、周边高回声晕的cerbB-2表达阳性率高于无边缘毛刺征及周边无高回声晕组;无后方回声衰减的cerbB-2表达阳性率高于有后方回声衰减组,但差异均无统计学意义(P>0.05)。
3 讨论
随着分子生物学和免疫组织化学的迅速发展,ER、PR及cerbB-2成为乳腺癌患者确定治疗方案和估计预后较为客观和准确的依据。ER、PR表达阳性的乳腺癌患者对内分泌治疗有效,复发率低,生存率高;表达阴性的患者则相反[2]。cerbB-2表达产物参与了正常乳腺组织生长与发育的调节,其水平高低与患者预后呈负相关,且cerbB-2表达阳性的乳腺癌对内分泌治疗的反应差。本组98例经术前超声引导自动穿刺活检,不但明确了乳腺IDC的诊断,同时还进行了分子免疫学的检测(ER阳性率45.92%,阴性率54.08%;PR阳性率38.78%,阴性率61.22%;cerbB-2阳性率59.18%,阴性率40.82%),由此奠定了早期、快速、准确的分子生物学基础,对治疗尤其是新辅助化疗方案选择有重要指导价值[3]。
高频灰阶超声对乳腺IDC有重要的定性价值,肿块的边缘毛刺征、周边高回声晕征、后方回声衰减征是IDC的特征性超声声像[4]。边缘毛刺征对应病理学改变是肿瘤的实质向周围组织浸润,毛刺远端肿瘤与正常乳腺组织混杂,即肿瘤周围纤维结缔组织反应性增生。限制了癌细胞的扩散。本组边缘毛刺征组的ER表达阳性率显著高于无边缘毛刺征组,PR表达阳性率也高于无边缘毛刺征组,差异均有统计学意义(P<0.01及P<0.05)。预示有毛刺边缘征的肿瘤具有较低的侵袭性,这与Paradiso等[5]的报道相一致。肿瘤组织向周围浸润引起周围炎,渗出或组织水肿及血管新生形成边缘模糊不清的浸润带,在超声声像上显示为周边高回声晕。本组结果显示有边缘高回声晕征的PR表达阳性率高于无边缘高回声晕组,差异有统计学意义(P<0.05)。
超声显示的点状强回声(即微小钙化)在乳腺IDC患者中并不少见。本组结果显示ER组、PR组、cerbB-2组的肿瘤微钙化征为76.53%(75/98),59.18%(58/98),40.82%(40/98),与2002年Thurfjell等[6]报道的乳腺钼钯检查结果相一致。病理提示组织变性坏死钙盐沉积,且相当比例的IDC伴有低分化的导管内癌存在,恶性程度高;坏死明显的病理佐证了微钙化的声像学基础。本组结果显示肿瘤内有微钙化征和有腋窝淋巴结肿大征的cerbB-2阳性表达率显著高于肿瘤内无微钙化征、无腋窝淋巴结肿大征组,差异有统计学意义(P均<0.01)。提示有微钙化征的肿瘤恶性程度高,疗效及预后差,复发早,易早期发生腋窝淋巴结转移[7]。
有报道后方回声衰减为乳腺IDC的特征性超声声像[4]。Osborne等[8]报道乳腺IDC的细胞分化程度中等,且纤维间质丰富。肿瘤内间质胶原纤维成分增多,排列紊乱是超声显示后方回声衰减的直接病理基础,但并不能反映和区分肿瘤实质组织类型和分化程度。本组有后方回声衰减征的ER、PR、cerbB-2的阳性表达率比较差异均无统计学意义(P>0.05)。L/T在判断生长方式上对鉴别良恶性肿瘤有特别的意义,即L/T<1反映恶性肿瘤的膨胀性生长方式。本组病例L/T<1虽有一定的检测结果,但ER、PR、cerbB-2的表达阳性率比较差异均无统计学意义(P>0.05)。
综上分析,乳腺IDC的超声声像特征与分子免疫学指标——ER、PR、cerbB-2的检测结果有一定的相关性:边缘毛刺征、周边高回声晕及微钙化征可提示ER、PR表达阳性的IDC对激素治疗有效及预后好;微钙化征、腋窝肿大淋巴结征可提示cerbB-2表达阳性的IDC预后及疗效差。但超声声像观察者的主观性,分子免疫检测的假阳性和假阴性,样本例数少及方法学不够完善皆可影响研究结果,对于超声声像特征与分子免疫学指标检测之间的关系尚需进一步探讨。
[1] Harris L, Fritsche H, Mennel R, et al.American Society of Clinical Oncology 2007 update of recommendations for the use of tumor markers in breast cancer[J].J Clin Oncol,2007,25(33):5287-5312.
[2] Baqai T, Shousha S. Oestrogen receptor negativity as a marker for high-grade ductal carcinoma in situ of the breast[J].Histopathology,2003,42(5):440-447.
[3] 谭旭艳,吴丹,高志刚,等.超声引导自动活检术在乳腺癌术前病理诊断的价值[J].江苏医药,2009,35(1):12-13.
[4] 何敬海,秦玲,陈东风. 乳腺浸润性导管癌的超声诊断特征[J].济宁医学院学报,2006,29(4):23-24.
[5] Paradiso A, Mangia A, Barlentta A, et al.Mammography and morphobiologic characteristics of human breast cancer[J].Tumori,1993,79(6):422-426.
[6] Thurfjell MG, Lindgren A, Thurfjell E. Nonpalpable breast cancer: mammographic appearance as predictor of histologic type[J].Radiology,2002,222(1):165-170.
[7] Ross JS,Fletcher JA,Linette GP,et al. The Her-2/neu gene and protein in breast cancer 2003: biomarker and target of therapy[J]. Oncologist,2003,8(4):307-325.
[8] Osborne CK,Yochmowitz MG,Knight WA 3rd,et al. The value of estrogen and progesterone receptors in the treatment of breast cancer[J]. Cancer,1980,46(12 Suppl):2884-2888.
