MMP-2和Tiam1蛋白表达与胃癌生物学行为相关性的实验研究
王 伟
侵袭和转移是恶性肿瘤最重要的生物学行为, 常为患者术后复发和死亡的重要原因。研究表明,基质金属蛋白酶-2(MMP-2)和T淋巴瘤侵袭转移诱导因子1(Tiam1)的过度表达与胃癌侵袭转移密切相关,但研究结论并不一致,而且有关胃癌组织中MMP-2和Tiam1蛋白表达的相关性及二者在胃癌侵袭转移过程中的共同作用的报道甚为少见。本研究通过免疫组化方法检测胃癌组织、癌旁组织和手术切缘区正常组织中MMP-2和Tiam1蛋白表达情况,探讨二者之间及二者与胃癌的生物学行为之间的相关性。
1 材料与方法
1.1 研究对象 收集大连大学中山医院普通外科2008年6月至2009年12月手术切除的40例原发性胃癌标本,男27例,女13例。年龄34~78岁,平均59.3岁。所有患者术前均未经任何抗癌治疗。每例均切取癌区、癌旁区(通过肉眼及触摸确定肿瘤边缘,然后取距该边缘1 cm处组织)和手术切缘区(距肿瘤≥5 cm)组织各一块。所有标本经10%福尔马林液固定,石蜡包埋,4 μm切片。复习全组患者的临床和病理资料,按新编常见恶性肿瘤诊治规范[1]对所有病例进行组织分型、区域淋巴结转移分站及TNM分期。
1.2 免疫组化染色 一抗为鼠抗人MMP-2单克隆抗体,购自北京中山生物技术有限公司;兔抗人Tiam1 多克隆抗体,购自美国Santa Cruz公司。SP免疫组化试剂盒、0.5%小牛血清白蛋白、过氧化物酶-链霉菌卵白素、DAB显色试剂,均购自福州迈新生物技术公司。常规采用S-P法进行免疫组化染色,分别检测癌区、癌旁区和切缘区组织中MMP-2和Tiam1表达情况。
1.3 免疫组化结果判断 Tiam1阳性染色者在细胞膜或细胞浆有棕黄色颗粒沉着,MMP-2定位于胞浆,有棕黄色颗粒沉着。两位病理医师独立观察每张切片随机选取的10个高倍视野,采用双评分半定量法,根据细胞膜或浆的染色程度及染色细胞百分率进行评分,基本不着色者为0分,着色淡者为1分,着色深者为2分;着色细胞占计数细胞百分率<5%为0分,5%~25%为1分,26%~50%为2分,>50%为3分。将每张切片着色程度得分与着色细胞百分率得分各自相乘,为其最后得分。0~1分为阴性(-),2~3分为低度阳性(+),4分及其以上为高度阳性(++)。
1.4 统计学处理 两样本间率的比较采用四格表资料的χ2检验,多样本间率的比较采用行X列表资料的χ2检验,相关分析采用列联表资料的χ2检验,当P<0.05时表明有统计学意义。所有统计均由SPSS 10.0统计软件包完成。
2 结果
2.1 MMP-2和Tiam1在胃癌各区组织中的表达(表1)
2.2 癌区组织中MMP-2和Tiam1蛋白表达与临床和病理因素的关系(表2)
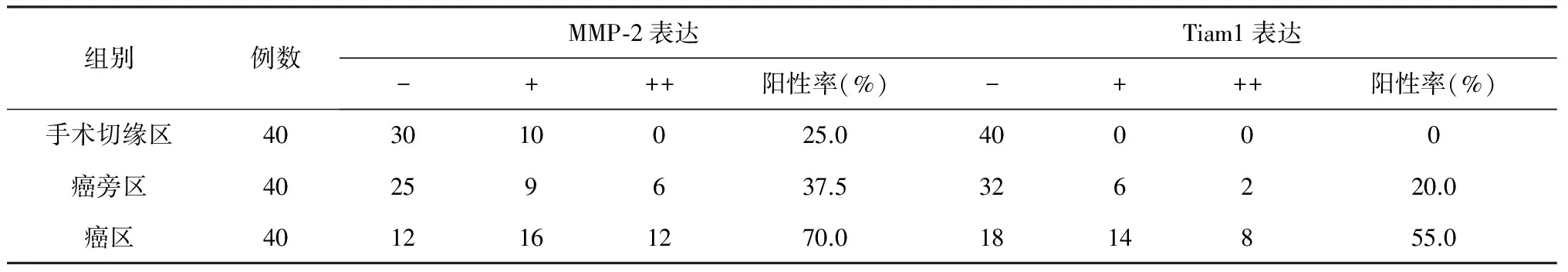
表1 MMP-2和Tiam1在胃组织中的表达
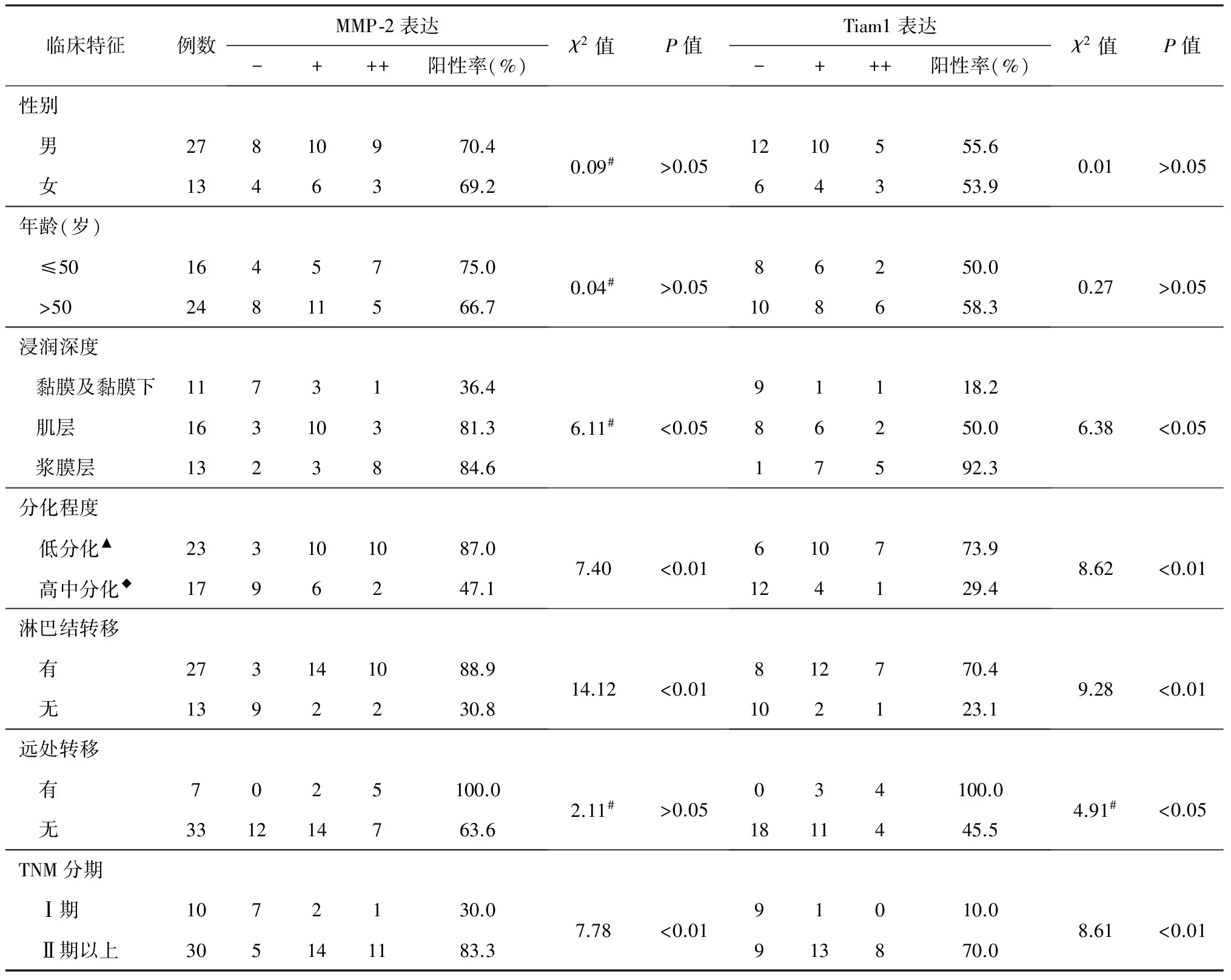
表2 MMP-2和Tiam1表达与胃癌患者临床病理学特征的关系
注:▲为低分化腺癌、印戒细胞癌和黏液腺癌;◆为乳头状腺癌、高中分化管状腺癌;表内所有χ2值均将“+”与“++”合并后进行统计;#表示理论数小于5,采用校正χ2检验值
本研究发现,癌区组织中MMP-2和Tiam1蛋白表达在患者性别、年龄方面无统计学意义(P>0.05);当肿瘤浸润深度由黏膜或黏膜下层→肌层→浆膜层时,随着深度加深,MMP-2和Tiam1蛋白表达阳性率也随之升高,表达率与肿瘤浸润深度呈正相关(均为P<0.01);MMP-2和Tiam1蛋白表达率与胃癌细胞分化程度呈负相关(均为P<0.05),即分化程度越低,此两种蛋白表达率越高;在有淋巴结转移组,MMP-2和Tiam1蛋白表达阳性率分别为88.89%和70.37%,而无淋巴结转移组阳性率仅为30.77%和23.08%,两者比较,差异均有统计学意义(分别P<0.01,P<0.05);本组有7例胃癌发生远处转移,其MMP-2和Tiam1蛋白表达阳性率100%;
而无远处转移组MMP-2和Tiam1蛋白表达阳性率分别为63.64%和45.45%,两组比较,具有统计学意义(分别P<0.05,P<0.01);本研究将40例胃癌按TNM分期分为两组,Ⅰ期为1组,Ⅱ~Ⅳ期为1组,随着临床分期的增加,MMP-2和Tiam1蛋白表达呈上升趋势,两组比较,具有统计学意义(均为P<0.01)。
2.3 MMP-2和Tiam1表达的相关性(表3) 40例胃癌组织MMP-2和Tiam1蛋白表达均阳性者19例(47.50%),2个指标中1个阳性表达者12例(30.00%),MMP-2和Tiam1蛋白表达均阴性者9例(22.50%)。胃癌组织MMP-2和Tiam1表达呈显著正相关(P<0.05)。
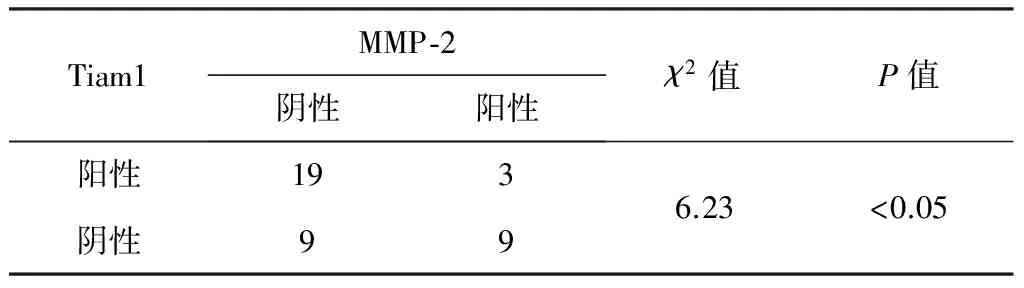
表3 胃癌组织中MMP-2和Tiam1表达的相关性
2.4 MMP-2和Tiam1同时表达与胃癌侵袭和转移的相关性(表4) 随着肿瘤浸润深度的增加,MMP-2和Tiam1同时阳性表达率也随之升高,也就是说,MMP-2和Tiam1同时表达者肿瘤往往浸润深度较一个指标阳性或两者都阴性的胃癌更深一些(P<0.01);低分化癌组织较中高分化癌组织的MMP-2和Tiam1同时阳性表达率明显为高(P<0.01);有淋巴结转移和远处转移胃癌组织的MMP-2和Tiam1 同时阳性表达率明显高于淋巴结转移和远处转移阴性者(均为P<0.01),即MMP-2和Tiam1同时阳性表达者更易发生淋巴结转移和远处转移;TNM分期Ⅰ期胃癌的MMP-2和Tiam1同时阳性表达率显著低于Ⅱ期以上胃癌(P<0.01)。
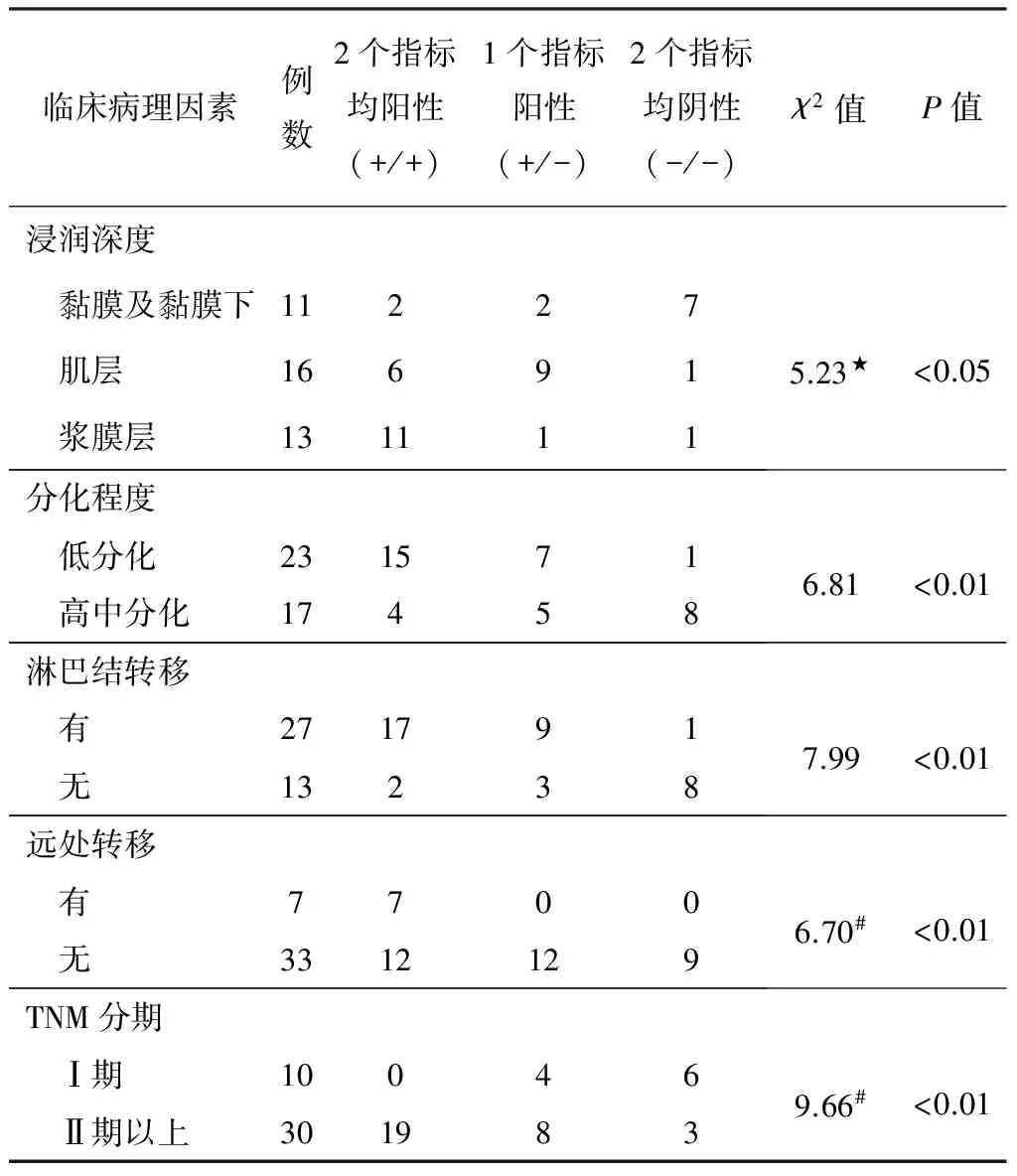
表4 胃癌组织中MMP-2和Tiam1共同表达与临床病理因素关系
注:#理论数小于5,采用校正χ2检验值;★表示肌层和浆膜层合并后进行统计;表内所有χ2值均将“+/-”和“-/-”合并后进行统计
3 讨论
胃癌是我国发病率和死亡率最高的恶性肿瘤之一,及时诊断和阻止其侵袭转移一直是当前研究的热点和难点。研究胃癌侵袭转移的相关因素,寻求准确判断胃癌侵袭转移的分子生物学标志物已成为胃癌研究工作的重点。大量研究工作表明,肿瘤的侵袭转移是一个多步骤的复杂过程,肿瘤细胞首先与基底膜粘附,释放或激活蛋白水解酶,降解基底膜(BM)和细胞外基质(ECM),然后定向运动穿过缺损的空间,以到达宿主组织或器官,实现侵袭和转移。这一过程较为复杂,多种基因及其产物参与这一过程的调控。
3.1 MMP-2在胃组织中的表达 肿瘤侵袭转移时,完善的细胞外基质和基底膜作为主要天然屏障可以限制肿瘤细胞的浸润和转移。基质金属蛋白酶(MMP)为一组Zn离子依赖性内肽酶,几乎能降解细胞外基质的所有成分。MMP按其作用的特异性底物可分为四大类,即胶原酶,明胶酶(MMP-2、MMP-9),基质溶解酶和膜型金属蛋白酶。ECM和BM主要由胶原、蛋白多糖、糖蛋白、糖胺多糖和弹力纤维等五大类物质组成,其中Ⅳ型胶原是ECM和BM的主要结构蛋白,具有独特螺旋结构,只有Ⅳ型胶原酶能降解Ⅳ型胶原成分,破坏基底膜的完整性。Ⅳ型胶原酶有两种分子类型:分子量为72KD的MMP-2和92KD的MMP-9。在肿瘤侵袭和转移过程中尤以MMP-2为重要,它以酶原形式分泌,被激活后形成Ⅳ型胶原酶。一方面降解、破坏靠近肿瘤表面的BM和ECM,使癌细胞可沿着缺失的BM向周围组织浸润,促进肿瘤侵袭和转移,另一方面则通过毛细血管内生、新生血管形成等促进肿瘤侵袭和转移[2-4]。
本研究发现,MMP-2蛋白表达主要位于细胞胞浆,另外在基质中的纤维母细胞、单核吞噬细胞中也有表达,其阳性表达强度以肿瘤与正常组织交界的浸润缘处最明显,这说明MMP-2的表达与肿瘤的浸润密切相关。有关基质中的纤维母细胞、单核吞噬细胞中出现阳性表达的解释,Mrena等[4]认为,肿瘤细胞可能通过可溶性介质或膜结合分子与间质细胞进行信息交换,协同产生和调节MMP,以有利于肿瘤细胞的浸润与转移。
本研究中由切缘区组织→癌旁区组织→癌区组织,MMP-2表达呈上调趋势。MMP-2的表达在癌区组织与切缘区组织、癌旁区组织与切缘区组织之间,差异具有统计学意义(分别P<0.01,P<0.05),癌旁区组织中MMP-2阳性表达率较切缘区组织明显上调,可能是由于正常稳定状态下,组织合成、分泌MMP-2量较少,在炎症、肠化、增生、损伤等刺激下,细胞内部调控平衡机制紊乱,合成分泌MMP-2量增多,提示MMP-2蛋白表达上调可出现在癌前病变和胃癌的早期阶段,与胃癌的发生发展呈正相关,MMP-2基因的激活可能是胃癌发生发展的重要因素,抑制MMP-2的表达或生物活性,有可能是防治胃癌发生发展的重要途径之一。
近年来,对于MMP-2蛋白表达与胃癌的侵袭和转移等生物学行为相关性的研究往往相互矛盾。Wu等[5]和He等[6]研究发现胃癌中MMP-2的活性明显高于邻近组织,且其表达强度与肿瘤浸润深度、淋巴结转移和脉管侵犯以及5年生存率密切相关;然而Shim 等[7]发现MMP-2的表达与胃癌的生物学行为无明显相关性。本研究发现,MMP-2在低分化腺癌的癌细胞和间质中表达高于中高分化的腺癌,有浆膜浸润肿瘤患者的MMP-2表达高于无浆膜浸润患者,两者差异有统计学意义(分别P<0.05,P<0.01)。同时发现Ⅳ型胶原破坏严重,呈碎片状,说明低分化癌的癌细胞和间质有大量的MMP-2分泌,对基底膜中的Ⅳ型胶原有破坏作用,这促进了癌组织的浸润型生长。本研究同时表明,有淋巴结转移和远处转移的胃癌组织MMP-2蛋白表达阳性率与无淋巴结转移和远处转移者相比,差异有统计学意义(分别P<0.01,P<0.05),提示MMP-2高表达有促进癌细胞进入血管淋巴管而发生转移的可能。本组胃癌病例中MMP-2蛋白表达与TNM分期呈显著正相关(P<0.01),分期越晚,表达率越高。
3.2 Tiam1在胃组织中的表达 肿瘤的侵袭与转移是一个多因素共同作用的复杂过程,其中肿瘤细胞的运动迁移是一个重要的先决条件,无论是癌细胞从原发癌上分离、血管壁瘤栓的形成,还是癌细胞游出血管的侵袭和转移过程,Tiam1均在其中起重要的作用。Tiam1基因是由1591个氨基酸残基组成的蛋白质,属于Dbl(diffuse B-cell lymphomaoncogene family)家族,是普遍存在的二磷酸鸟嘌呤核苷酸(GDP)与三磷酸鸟嘌呤核苷酸(GTP)转换因子。可促进Rac1-GDP(失活状态)向Rac1-GTP(激活状态)转变,进而调节细胞骨架重组,影响细胞形态极化,促进细胞运动和迁移[8]。
本研究发现,切缘区组织中Tiam1不表达,癌旁区组织中Tiam1蛋白表达阳性率达20%,而癌区组织中表达阳性率为55%,分别与切缘区组织和癌旁区组织相比差异具有统计学意义(分别P<0.01,P<0.05),提示Tiam1蛋白表达可能与胃癌的发生发展有关。本实验研究发现,Tiam1在癌旁区组织中的表达阳性部位主要在肠上皮化生,在炎性细胞浸润明显处Tiam1染色增强,可能是由于Tiam1蛋白参与炎症过程中白细胞与血管内皮细胞的粘附,从而易于使炎性细胞向炎症部位渗出的缘故。
本组资料显示,Tiam1蛋白在胃癌组织中的表达与患者的性别、年龄无相关性,但与肿瘤的浸润深度、分化程度、淋巴结或远处转移及TNM分期显著相关。本组病例在不同肿瘤浸润深度之间Tiam1蛋白表达阳性率差异有统计学意义(P<0.05),这表明Tiam1阳性表达与胃癌演进、侵犯能力、转移能力的增强有关,Tiam1表达阳性的肿瘤细胞,可能获得了使之易于浸润和转移的特征[9]。本组胃癌病例中低分化者Tiam1蛋白表达阳性率明显高于中高分化者,说明Tiam1在胃癌病理组织学分型中具有一定特异性。Tiam1蛋白表达在有淋巴结转移组的阳性率明显高于无淋巴结转移组(P<0.05),提示Tiam1可能和胃癌的淋巴结转移有关。无淋巴结转移组中仍有23.08%的阳性率,提示可能和某些肿瘤细胞具有潜在的转移能力有关。因此,随TNM分期的增高,Tiam1蛋白表达阳性率亦随之增高,而且有明确远处转移的病例Tiam1阳性率达到100%,表明Tiam1与胃癌组织恶性生长和临床进展之间存在着一种质和量的关系,Tiam1阳性表达与胃癌进展、侵袭、转移能力的增强有关,表达Tiam1的肿瘤细胞具有更强的侵袭性。
3.3 MMP-2和Tiam1共同表达与胃癌侵袭和转移的关系 本研究发现,MMP-2和Tiam1在胃癌组织中的表达呈显著正相关(P<0.05),两者在同一病例中的表达具有协同性。MMP-2和Tiam1均阳性表达的胃癌病例往往有着更为恶性的生物学行为,如肿瘤浸润深度更深,细胞分化程度更低,多伴有淋巴结转移和远处转移等,Ⅰ期胃癌与Ⅱ期以上相比,MMP-2和Tiam1共阳性表达率有显著性差异(P<0.01)。MMP-2和Tiam1在胃癌组织中协同作用机制还不十分清楚,目前所知,主要有以下几点:(1)Tiam1能够活化Rac,活化的Rac可促进细胞表面的整合素的聚集,将信号传递到肌动蛋白细胞骨架,影响细胞骨架的组装和运动,诱导肌动蛋白微丝在质膜上的聚集,产生片足和丝状伪足[10],使肿瘤细胞易于离开原发部位,MMP-2降解细胞外基质,形成局部溶解区,为肿瘤细胞转移提供通路,然后Tiam1影响肿瘤细胞的运动能力,使其发生转移;(2)Tiam1还可能是MMPs的调控因子[8],能够激活MMP-2,促进细胞外Ⅳ型胶原的降解,从而介导肿瘤细胞的浸润和转移;(3)Tiam1可以与CD44[11]、Ras[12]等其他细胞粘附分子发生联系,为 MMP-2在细胞表面提供附着点,降解细胞外基质,以确保Tiam1介导的肿瘤浸润。因此,Tiam1和MMP-2均阳性表达与胃癌的侵袭转移及预后密切相关,这对胃癌治疗的临床实践具有一定的指导意义,即对Tiam1和MMP-2均阳性表达的胃癌患者应采用更为积极有效的治疗措施。
总之,MMP-2和Tiam1基因的表达在预测胃癌的病程进展和转移潜能以及预后估计等方面具有很大的潜在价值。但由于此2种基因功能复杂,其具体作用机理尚不十分清楚,因此还处于研究的初始阶段,许多问题还有待于更深的探索。我们相信,随着分子生物学的不断发展和对该领域的不断研究,它们势必会对胃癌的基础研究和临床治疗提供更大的帮助,从而为将来的抗胃癌转移治疗方案提供更具方向性的目标。
[1] 中国抗癌协会.新编常见恶性肿瘤诊治规范(胃癌分册)[M].第1版.北京:北京医科大学中国协和医科大学联合出版社,1999:1-94.
[2] Zheng H,Takahashi H,Murai Y,et al. Expressions of MMP-2, MMP-9 and VEGF are closely linked to growth, invasion, metastasis and angiogenesis of gastric carcinoma[J]. Anticancer Res, 2006, 26(5A):3579-3583.
[3] Kubben FJ,Sier CF,Meijer MJ,et al. Clinical impact of MMP and TIMP gene polymorphisms in gastric cancer[J].Br J Cancer,2006, 95(6):744-751.
[4] Mrena J,Wiksten JP,Nordling S,et al. MMP-2 but not MMP-9 associated with COX-2 and survival in gastric cancer[J].J Clin Pathol, 2006, 59(6):618-623.
[5] Wu ZY,Li JH,Zhan WH,et al. Lymph node micrometastasis and its correlation with MMP-2 expression in gastric carcinoma[J].World J Gastroenterol, 2006, 12(18):2941-2944.
[6] He Q,Chen J,Lin HL,et al.Expression of peroxisome proliferator-activated receptor gamma, E-cadherin and matrix metalloproteinases-2 in gastric carcinoma and lymph node metastases[J].Chin Med J (Engl), 2007, 120(17):1498-1504.
[7] Shim KN,Jung SA,Joo YH,et al.Clinical significance of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in gastric cancer[J].J Gastroenterol, 2007,42(2):120-128.
[8] Engers R,Springer E,Kehren V,et al.Rac upregulates tissue inhibitor of metalloproteinase-1 expression by redox-dependent activation of extracellular signal-regulated kinase signaling[J].FEBS J, 2006,273(20):4754-4769.
[9] Minard ME,Ellis LM,Gallick GE.Tiam1 regulates cell adhesion, migration and apoptosis in colon tumor cells[J].Clin Exp Metastasis,2006,23(5-6):301-313.
[10] Even-Ram S,Doyle AD,Conti MA,et al. Myosin IIA regulates cell motility and actomyosin-microtubule crosstalk[J]. Nat Cell Biol, 2007, 9(3):299-309.
[11] Singleton PA,Salgia R,Moreno-Vinasco L,et al.CD44 regulates hepatocyte growth factor-mediated vascular integrity. Role of c-Met, Tiam1/Rac1, dynamin 2, and cortactin[J].J Biol Chem,2007, 282(42):30643-30657.
[12] Baines AT,Lim KH,Shields JM,et al.Use of retrovirus expression of interfering RNA to determine the contribution of activated K-Ras and ras effector expression to human tumor cell growth[J].Methods Enzymol,2005,407:556-574.
