Mg-Ni型储氢材料取代改性研究概述
史洪存,孟令鹏,李晓艳,郑世钧
(河北师范大学 化学与材料科学学院,河北 石家庄 050016)
随着诸如煤、石油等矿物能源的日益减少和越来越严重的环境问题,开发寻找一种可以替代碳的绿色能源,是各国科学家研究的重点课题。氢是一种绿色无污染的理想二次能源,在宇宙中含量丰富,并且不污染环境。但是,氢气在常温下易泄漏和发生爆炸,难于储存运输,高性能和高容量储氢材料的研发对氢能的大规模应用和“氢经济”的实现具有非常关键的作用[1]668,[2],[3]353。21世纪也被称为氢能源的时代[4]1-12。
因为Mg2Ni储氢合金储氢含量大(3.6%[5]2254-2256,质量分数)、理论放电容量高(999mA·h/g[6]643-647),资源丰富和良好的吸放氢平台而被认为是最具开发前途的金属储氢材料之一[7]353-358,[8]85-89。所以,国内外众多科研工作者都对镁基储氢合金进行了大量的研究和探索。但是其吸放氢温度高、动力学性能差等缺点导致其实际应用性较差。因此,如何改善镁基储氢材料的缺点,是研究者面临的主要问题。
1 镁基储氢材料的研究历史
美国布鲁克-海文国家实验室早在1968年就开始了对镁基储氢材料的研究,可以说是对镁基储氢材料的最早研究。科学家Reilly和Wiswall[5]2254-2256首先将镁和镍混合熔炼成了Mg2Ni合金,而后再让Mg2Ni合金在2Mpa、300℃下与氢反应生成Mg2NiH4,就此拉开了大规模的镁基储氢材料的研究序幕。此后伴随着Ivanov[9]25-29等人在1987年机械合金化方法成功制备Mg2Ni的出现,镁基储氢材料的研究取得快速发展。
与此同时,人们也开始运用量子力学和分子模拟等理论方法从微观上探讨储氢材料的结构与性质,早在1983年,Westlake[10]275-292对LaNi5,LaNi4Al等镧系氢化物中氢与金属的化学计量关系和氢在金属晶格间隙中占有位置的几何模型进行了量子化学计算。
2 镁基储氢材料的分类
通过大量的研究和归纳总结,镁基储氢材料基本上可以分为单质镁储氢材料、镁基储氢合金和镁基复合储氢材料三大类[11]72-75。
2.1 单质镁储氢材料
单质镁可以直接与氢反应,在300~400℃和较高的氢压下,反应生成MgH2,其理论储氢含量可以达到7.65 %(质量分数),具有金红石结构,性能稳定,在287℃时的分解压为101.3kPa。但是,纯镁的吸放氢反应动力学性能较差,吸放氢温度高,因此很少用纯镁来储存氢气。
2.2 镁基储氢合金
镁基储氢合金大体归结起来可以分为三类,即Mg2Ni系合金、RE-Mg2Ni合金和Mg-RE合金[12]38-41。
Mg2Ni系合金中,根据Miedema规则[13]67,储氢合金最好是由一个强氢化物形成元素和一个弱氢化物形成元素组成,过渡金属、稀土金属和碱土金属是3类主要被考虑的合金化元素。在Mg与Ni形成的合金体系中存在两种金属间化合物 Mg2Ni(图 1a)和 MgNi2,其中MgNi2不与氢气发生反应。Mg2Ni在吸氢后其结构发生变化,在常温状态下以LT-Mg2NiH4[14]3590-3593形式存在(图1b),该晶体为单斜结构,空间群为C12/C1,可以看作微小形变的CaF2结构,在室温下较稳定并且不易脱氢。现在认为Mg2NiH4是一种配位氢化物,其中低化合价过渡金属Ni与H组成[NiH4]4-配位体,而电负性较低的Mg原子贡献两个电子以稳定配位体结构[15]877。

图1 Mg2Ni系合金晶胞模型
Akiba等[16]24在四元金属氢化物Mg119M011(M = B ,Al , Si , Ca)Ni018Cu012H4内发现了氢平衡压与晶胞体积的反比例关系,这些结果表明,同时对Mg和Ni进行合金化可以改变氢和金属的相互作用。
其它两种RE-Mg2Ni合金和Mg-RE合金主要是RE = La,Ce,Nd,Pr[17]l5,[18]129,[19]279元素进行添加,研究得出其最高吸氢量约为31%。[20]1075,[21]3929
2.3 镁基复合储氢材料
最近几年,对镁基储氢复合材料的研究也非常活跃,2000年以来,人们开始重视过渡金属氧化物等化合物对Mg2Ni体系的催化性能研究。添加剂的加入对镁基储氢材料充放氢动力学性能改善比较显著,提高了储氢容量。单质元素与镁基材料的复合掺杂,添加单质元素较多的是Fe、Ni、Pd等[22]584-587,[23]87-843。化合物与镁基材料的制备通常采用机械合金化法进行。常见化合物镁基材复合材料有:Mg-LaNi5、Mg-TiFe、Mg-Mg2Ni等[24]247-252,并且表现出吸放氢容量大,放氢温度低等特点。
3 镁基储氢材料取代改性研究
Mg-Ni系储氢合金主要组成部分是A侧的放热型金属Mg元素和B侧的吸热型金属Ni元素[25]32。其中,A侧元素主要作用是控制储氢合金的吸氢量,其是组成储氢合金不可缺少的元素,而B侧元素主要是控制储氢合金吸放氢的可逆性,来调节生成热与氢化物的分解压。
以Mg2Ni合金的元素取代改性为例,可以总结如下规律:
(1)用不同的元素替代Mg,表达式为MgaXbYcNi(X≠Y,a+b+c≤2)
(2)用不同的元素替代Ni,表达式为Mg2NiaXbYc(X≠Y,a+b+c≤1)。
(3)用同一种元素替代Mg和Ni,表达式为Mg2-aXaNi1-bYb(X=Y);
(4)用不同的元素替代Mg和Ni,表达式为Mg2-aXaNi1-bYb(X≠Y);
其中(1)是A侧取代改性,(2)是B侧取代改性,(3)和(4)是A、B两侧同时取代改性。
3.1 A侧取代改性
在实验上方法上,目前主要是应用Al、Ti、V、Ca、Zr、Re等金属元素进行A侧Mg元素单独取代或者同时利用两种以上元素进行部分取代。Wang[26]297-300等使用Ag元素替代了Mg2Ni合金中的部分Mg元素,使得放氢温度降低了,并且吸氢含量达到了2.2%。李谦[27]864-870等使用了Ag元素和Al元素分别取代Mg元素,在使用Ag元素取代Mg元素的实验中,其合成的Mg1.95Ag0.05Ni,Mg1.9Ag0.1Ni 合金的储氢含量接近于Mg2Ni合金的理论储氢含量3.6 %(质量分数),[28]312-318并且随着温度的升高合金的吸放氢速率加快,同时随着Ag元素含量的增多,其动力学性能也得到了一定改善,使得该取代合金的吸放氢速率明显快于Mg2Ni合金;在使用Al元素取代Mg元素的实验中,比较Mg2Ni/(Mg1.9Al0.1Ni)合金的吸放氢性能,结果显示,取代以后吸放氢速率较取代前明显增大,这说明Al元素取代能够改善材料的动力学性能。Liang[29]286-290等用Ti元素对Mg元素进行取代,制得了纳米Mg1.9Ti0.1Ni合金,吸放氢性能稳定,合金在200℃时没有经过活化的情况下,就可以快速吸氢,半个小时吸氢量就达到了3%,然而,非纳米合金在同等的条件下是很难形成合金氢化物的。Hiroshi[30]2221等也研究了Ti元素对Mg元素的取代,得出在碱性条件下Ti元素在合金表面生成了一层致密的TiO2薄膜,因此抑制了合金表面Mg元素的氧化,达到了延长Mg-Ni合金的循环使用寿命的目的。Yuan[31]556等研究得出了用Al元素部分取代Mg元素,可以有利于H原子在合金中的扩散,合金表面的电化学性能得到提高,又因为Al元素取代以后,同时在合金表面形成了一层致密的Al2O3薄膜,合金耐腐蚀性能也得到了增强,从而延长了合金的循环寿命。Yuan[32]322等还研究了使用V元素和Al元素同时取代Mg元素的合金的电化学性能,得到了制备的合金Mg1.5Al0.3V0.2Ni最大放电容量达到435mAh/g。Chiaki Iwakura[33]2781-2784等研究了Ti元素和V元素取代的Mg0.9Ti0.1Ni,Mg0.9V0.1Ni以及同时取代Mg元素(即Mg0.9Ti0.06V0.04Ni)的合金的电化学性能。得出了用Ti元素或V元素取代部分Mg元素后,可以起到抑制放电容量的衰退的作用;用Ti元素和V元素同时取代部分Mg元素后,可以起到抑制合金表面Mg元素在充放电循环过程中被氧化,提高电极循环稳定性的作用。Sang-Cheol Han[34]167-171等分别使用Ti元素对合金表面进行改性处理以及取代实验,结果得到取代实验效果非常好,而表面改性处理几乎起不到提高循环稳定性的效果。其中在Mg0.7Ti0.3Ni1.0取代合金中,Ti元素在合金表面形成了一层氧化膜,其很好地抑制了Mg元素的进一步氧化。同时还在合金表面形成了一层富镍层,从而也提高了合金的循环稳定性。orowski等[35]283研究了Mg2Ni掺杂Mn、Al的晶格变化,研究表明:同未掺杂Mn、Al的Mg2Ni相比,由于Mn和Al的原子尺寸比Mg要小,因此随Mn和Al含量的增加,Mg1、75M0、25Ni系统的元胞体积减小,当x = 0.5时,Mg2-xMxNi的晶相为CsCl型结构,如表1 。

表1 Mg2-XMXNi(M=Al或Mn) 的晶体结构和晶格常数
3.2 B侧取代改性
实验上主要用Ti、Cr、V、Fe、Cu、Co、Zn、Pd、W、Mn等元素进行单独取代或者两种以上的元素同时进行部分取代Ni元素,以改善Mg-Ni系合金的吸放氢可逆性。Yang[36]640等用M(M=Ti、Mn、Co、Cr、Zn、Cu、Fe)部分取代Ni元素,制得Mg2Ni0.75M0.25合金并研究了其储氢性能,通过X射线衍射图谱分析得到此合金具有六方结构。并且合金经过两次氟化处理后就可以活化,250℃时放氢量达到H/M=1.118-3.3%(质量分数)。其中,Ni元素被Mn、Co、Cr等元素取代以后Mg2Ni的分解平台压明显的降低;而Ti元素和Cu元素的取代却使平台压升高;Zn元素和 Fe元素的取代对结果影响不大。活化过程的缩短原因在于氟化作用使合金比表面积增大(3.8-5.1m2/g)。Shin-ichi Yamaura[37]239研究了不同含量的Pd对Mg67Ni33-xPdx(x=5、10、20)合金性能的影响,研究结果发现3种不同含量的取代合金中,10at%Pd合金的放电容量最大,并且这3种合金经过5次反复充电循环,放电量没有明显下降,这说明Pd能够有效地改善合金的电化学循环寿命。Zhang[38]278等用Zr元素对Ni元素进行部分取代,制得了Mg2Ni1-xZrx合金,研究发现此合金的主相是六方结构,并且随着Zr元素含量的逐渐增加,晶格常数a逐渐增大,但是c轴变化不大。同时在此过程中,氢化物的生成热也逐渐地降低,放氢温度也降低,与Mg2Ni合金进行比较发现,取代后的合金放氢容量是增大的。用V、Zn、Ti、Mn、Co、Fe等元素来部分取代Ni元素,也可以得到同样的实验结果,只是生成热和放氢温度降低的程度不同而已。
3.3 A、B两侧同时取代改性
Mg-Ni系储氢合金同时部分取代A、B两侧元素的实验也有过研究,一般来说会有新相结构生成。Yuan[39]246等合成了晶体合金Mg2-xNi1-xTixMnx,研究发现合金中出现了Mg3TiNi2和Mg3MnNi2两种不同新相,结果显示Mg原子与Ni原子之间的距离是0.2921nm,而在六方结构的Mg2Ni晶体中,Mg原子和Ni原子之间距离是0.2642nm、0.2682nm。由此可以得出结论,双取代以后 Mg原子与 Ni原子之间距离增大,因此更有利于吸氢。合金Mg1.90Ni0.90Ti0.10Mn0.1经过四次活化以后,放氢的容量就达到了 355.26ml H2(S.T.P)·g-1;还有合金Mg1.75Ni0.80Ti0.25Mn0.20的最大放电容量可以达到 335mAh/g,循环十次以后,合金的放电容量还高于 200mAh/g。Cui[40]209等用Al元素对Mg元素进行部分取代,同时用Y部分取代Ni元素制得合金Mg1.9Al0.1Ni0.9Y0.1,双取代结果表明,其电化学性能较Mg2Ni相比有了提高,放电容量达到150mAh/g。Cui[41]164等还用Al元素部分取代Mg元素,同时用Co元素和Mn元素进行部分取代Ni元素,制得了合金Mg1.9Al0.1Ni0.8Co0.1Mn0.1,其放电容量达到了630mAh/g。
4 镁基储氢材料理论研究现状及理论研究方法
4.1 镁基储氢材料理论研究现状
近年来,随着计算机技术的发展,计算速度得到了很大的提高,理论计算因此得到了很快的发展。目前理论计算也主要集中在镧系、镁系、锂氮系等方面。G N Garcıa[42]11746等人采用从头算法的计算方法对Mg2Ni 氢化物(Mg2NiH4)的晶体结构进行了研究,先确定H原子的具体位置,接着依据Mg2NiH4的电荷分布推断体系中各原子之间的成键类型,认为H与Ni之间形成共价键,组成[NiH4]4-阴离子,而该阴离子与Mg2+形成离子键,因此形成具有反萤石结构的Mg2NiH4化合物,并且具有较稳定的结构。Y.Takahashi[43]98等用DV-Xα方法计算了Mg2Ni的氢化物的电子结构,得出Mg-Ni键太弱从而使得晶胞不稳定,并且它的氢化物在温度变化时发生相变,也是因为晶胞的不稳定性。C. P. Broedersz[44]1-10等利用Vasp程序计算研究了Mg2NiH4及其被Ti元素取代以后合金的结构,提出了计算合金生成焓的方法。Vegge[45]35412-35420用更为精确的改进的Perdew-Burke-Ernzerhof (PBE)泛函,重新计算改善了Norskov[46]257-260等采用凝胶模型研究氢气在镁(0001)面上的解离过程,得出Mg储氢材料吸氢过程的速控步骤为氢气的解离。
镁基储氢合金(Mg2Ni)具有高的储氢容量,而实验研究表明其它金属原子取代或掺杂其中的本体金属原子能够有效地改善其储氢性能[47]18-23,[48]601-603。为了了解取代金属原子对镁基储氢材料的作用,人们对取代体系进行了计算。Y Takahashi[49]98等人采用基于分子轨道理论的DV-Xα方法计算了3d过渡金属M(M=V、Cr、Fe、Co、Cu、Zn)合金化Mg2NiH6团簇模型的电子结构,当不同合金化元素M取代Ni后,发现M-Mg之间较弱的成键作用是导致Mg2Ni氢化物结构稳定性降低的主要原因。郭进等[50]89-91,[51]118-123采用第一原理方法对Mg2Ni及其氢化物电子结构进行了计算,他们利用CASTEP软件[52]模拟Sn分别取代Mg或Ni,通过对替代元素周围和其他区域的态密度分析得出了晶胞稳定性降低,放氢温度降低,储氢性能得到一定改善的结论。
4.2 镁基储氢材料理论研究方法
对于理论研究方法,利用量子化学计算可以了解和掌握体系可能存在的状态以及变化规律,揭示储放氢机理,可以为实验上设计新的材料提供新思路、新方法。计算方法主要有第一原理计算方法和电荷自洽离散变分Xα方法。
4.2.1 第一原理计算方法
电子结构决定材料的许多基本物理性质,确定电子结构需要采用基于第一原理的计算方法, 主要应用于固体材料理论研究[53]8769-8776,[54]75-104。基于第一性原理开发的专业性计算软件常见的有:Materials Studio[55]2717(简称MS)、Vasp[56]1758-1775,[57]2824,[58]1688、WIEN2K[59]系列等。电子密度拓扑分析是目前研究分子结构比较流行的一种方法,因其能够对原子间的成健作用、电子密度分布等给出定量描述和清晰的物理图像而得到广泛的应用,[60]893,[61]1530一些成功的实例已经证明电子密度拓扑分析方法可以很好地用于固体材料的理论研究[62]8769,[63]。马树元[51]118-123等采用CASTEP(Cambridge serial total energy package)程序计算了Mg2Ni及其氢化物Mg2NiH4的电子结构和成键特征。C. P. Broedersz[44]等利用Vasp程序计算研究了Mg2NiH4及其被Ti元素取代以后合金的性能。数据分析时,对电子密度的分析应用电荷等密度图(见图 2a),因为其可以一目了然的看出原子间的相互作用和电子云的重叠情况,进而定性说明原子间作用力的强弱;电子态密度图(见图2b)通过分析轨道间的重叠情况,可以得到原子之间成键作用强弱;还可以通过元素替代前后生成焓的计算值对比,分析能否达到改善合金储氢性能的目的。
4.2.2 电荷自洽离散变分Xα方法
利用电荷自洽离散变分 Xα法对 Mg2Ni氢化物的电子结构进行研究,手段多是以团簇构建模型。电荷自洽离散变分 Xα(SCC-DV-Xα)方法,可以探讨储氢合金及其氢化物中原子间的相互作用。
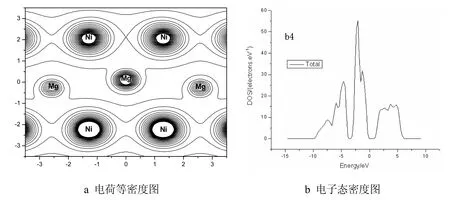
图2 电荷等密度图和电子态密度图
总之,量子化学计算方法可以从电子、原子和分子尺度上研究体系的微观状态和性质,并能定量地解释化学现象、过程和规律。所以,探索镁基储氢材料组份设计中的基本规律和储氢机制中的基本科学问题,应用量子化学方法进行分子设计和材料设计是完全可能的。通过量子化学计算,结合电子密度拓扑分析方法,研究镁基储氢合金及其氢化物的结构,探讨取代元素对合金结构和性质的影响,预测新型储氢材料的结构和性质,为新型储氢材料的设计提供理论依据。
5 总结
镁基储氢材料由于兼具成本低、储氢量大以及添加催化剂改性的优异储氢特性,因此其基础开发及应用研究前景十分广阔,但由于其具有较高的解氢温度、较差的吸放氢动力学和电化学性能,因此有许多问题还需进一步的深入研究和讨论。理论研究比实验研究要相对滞后。针对目前研究现状和发展趋势,未来研究可归纳为以下几点:
(1)元素取代:组元替代(元素取代)法一般是以主族或过渡金属元素部分取代Mg(如Al、Ti、Zr等),通过元素取代可以在保持原有较高吸氢量的基础上,降低其吸放氢温度。Mg2Ni系合金元素取代方法,可以分为A侧Mg元素被取代、B侧Ni元素被取代、A B两侧Mg、Ni元素同时被取代[64]29-33,元素取代被认为是改善镁系储氢合金性能的最根本途径。
(2)加强新型镁基储氢材料的设计研究与模拟:目前镁基储氢材料的设计方法除了在经验规律基础上进行归纳外,另外一个重要的方面就是材料的计算机设计与模拟,运用分子动力学、半经验电子理论和第一原理计算方法等寻找更优体系。
(3)镁基储氢材料的微观结构调制和催化相特性影响。
(4)镁基储氢材料的吸放氢过程的热力学和动力学参数性质、反应历程,此方面需要做很多的工作。
[1]Van den Berg , A.W.C.etal. Materials for hydrogen storage: current research trends and perspectives [J]. Chemical Communications,2008, (6).
[2]Storage target values with footnotes can be accessed at:www.eere.energy.gov/hydrogen and fuel cells/storage currenttechnolog.html.
[3]Schlapbach L , Zuttel A . Hydrogen-storage materials for mobile applications[J]. Nature , 2001,414 (6861).
[4]雷永泉. 新能源材料[M]. 天津:天津大学出版社,2000.
[5]Reilly J J,Wiswall RH.The reaction of hydrogen with alloy of magnesium and nickel and the formation of Mg2NiH4[J]. Inorg Chem,1968,7(11).
[6] Kohno T,YamamotoM,KandaM.Electrochemical properties of mechanically ground Mg2Ni alloy[J]. Alloys Compds,1999,293-295.
[7] SCHLAPBACHL,ZUTTELA.Hydrogen-storage Materials for Mobile Applications [J]. Nature,2001,414.
[8]王方香,闫晓琦,高学平. 镁基复合储氢材料[J]. 化学通报,2002 ,65(2).
[9]Ivanov E,Konstanchuk I,Stepanov A,et al.Magnesium mechanical alloys for hydrogen storage[J]. J Lee Common Met, 1987,131(12).
[10] Westlake D G. A geometric model for the stoichiometryand interstitial site occup ing in hydrides of LaNi5,La-Ni4Al,LaNi4Mn[J]. J. Less-Common Met, 1983,91.
[11]陈玉安,唐体春,张力. 镁基储氢材料的研究进展[J]. 重庆大学学报:自然科学版,2006 ,29 (12).
[12]童燕青,欧阳柳章. 镁基储氢合金的最新研究进展[J]. 金属功能材料,2009,16(5).
[13]Miedema A R. On the heat of formation of solid alloys. II[J]. J lesscommon Metals,1976,46.
[14]P. Zolliker, K. Yvon, J. D. Jorgensen, F. J. Rotella. Structural studies of the hydrogen storage material Mg2NiH4.2. Monoclinic low-temperature structure [J]. Inorg Chem, 1986, 25.
[15]Sandrock G. Iron as catalyst for improving hydrogen absorption in magnesium based materials [J]. J Alloys and Compds , 1999,295.
[16]Tsushio Y, Akiba E. Electrochemical characteristics of Al-substituted Mg2Ni As negative electrode [J]. J Alloys and Compds , 1998,267(1-2) .
[17]Kohno T , et al . Influence of addition of Cu(OH)2toKOH alkaline electrolyte on electrochemical properties ofLa2Mg0.9Al0.1Ni7.5Co1.5hydrogen storage alloy electro de[J]. J Alloys and Compds , 2000,311(2) .
[18]Guenee L , et al . crystalstructure and hydrogenation properties of the ternary compoundsLaNi4Mg and NdNi4Mg[J]. J Alloys and Compds , 2003,348(1-2) .
[19]Wang Z M , et al . Preparation and electrode properties of new ternary system alloy: REMgNi4(where RE=La,Ce,Pr,Nd) [J]. J Alloys and Compds , 2004,384(1-2) .
[20]Ouyang L Z , et al . The hydrogen storage behavior of Mg3La and Mg3LaNi0.1[J]. Scripta Materialia , 2006,55(12) .
[21]Ouyang L Z , et al . A new type of Mg-based metal hydride with promising hydrogen storage properties [J]. Intern J Hydrogen Energy , 2007,32(16) .
[22]袁华堂,宋赫男,李秋荻. Mg1-xTi xNi (0≤x≤0.4)系列合金的合成及性能研究[J]. 高等学校化学学报,2003,24(4).
[23]IMAMURA H,TABATA S,TAKESUE Y. Hydriding dehydriding Behavior of Magnesium Composites Obtainel by Mechanical Grinding with Graphite Carbon [J]. Alloys Compounds ,2000 ,25.
[24] L IANG G, HUOT J ,BOIL Y S. Catalytic Effect of Transition Metals on Hydrogen Sorption in Nancrystalline Ball Milled Mg-H2Tm( Tm = Ti ,V ,Mn ,Fe ,Ni) Systems [J]. Alloys Compounds ,1998 ,292.
[25]PANG Zai-guang, REN Hui-ping, ZHANG Yang-huan etc. Recent Development of Element Partial Substitution to Improve the Characteristics of Mg2Ni-based Hydrogen Storage Alloys [J]. Metallic Functional Materials, 2008, 15, (1).
[26]Wang L B,Yuan H T,Wang Y J,et al . The hydrogenation properties of Mg1.8Ag0.2 Ni alloy [J]. Alloys Comp , 2002 , 336.
[27]LI Qian,J IANG Li-jun,LIN Qin etc. Influence of Ag and Al on hydrogen storage properties of Mg2Ni alloy [J]. The Chinese Journal of Nonferrous Metals,2003,13, (1).
[28]Dehouche Z, Djaozandry R , Goyette J , et al. Thermal cyclic charge and discharge stability of nanocrystalline Mg2Ni alloy [J]. J Alloys Comp , 1999 , 288.
[29]Liang G, Huot J , Boily S , etal . Hydrogen storage properties of nanocrystalline Mg1.9 Ti0.1 Ni made by mechanical alloying[J]. Alloys Comp , 1999 , 282.
[30]Hiroshi Inoue , Shinya Hazui , etal . Preparation and electrochemical characterization of Mg2Ni alloys with different crystallinities [J]. Electrochimica Acta , 1998 , 43 (14 - 15).
[31]Yang H T, Li Q D, et al. Electrochemical characteristies of nanocrystalline ZrCr2 and Mg2Ni type metal hydrides prepared by mechanical alloying[J]. J AlloysComp ,1999 ,293 - 295.
[32]Huatang Yuan , Qiudi Li , etal . Electrochemical characteristicsof Mg2Ni-type alloys prepared by mechanical alloying [J]. Journal of Alloys and Compounds, 2003 , 353.
[33]Chiaki I W,etal. Effects of Ti-V Substitution on Electrochemical and Structural Characteriatics of MgNi Alloy Prepared by Mechanical Alloying [J]. Electrochimica Acta, 2001, 46.
[34]Orimo S,etal. Materials Science of Mg-Ni-Based New Hydrides[J]. Appl Phys A,2001,72.
[35] Gasiorowski A , Iwasieczko W, et al . Hydriding properties of nanocrystalline Mg2 - xMxNi alloys synt hesized by mechanical al2loying (M = Mn , Al) [J]. Journal of Alloys and Compounds ,2004 , 364 (1- 2).
[36]Yang Huabin, Yuan Huatang, etal. Characteristics of Mg2Ni0. 75M0. 25 (M = Ti , Cr , Mn , Fe , Co , Ni , Cu and Zn) alloys after surface t reatment [J]. Journal of Alloys and Compounds , 2002 ,330 - 332.
[37]Yamauar SI,Kim H Y,Kimmuar H,et al.Electrode properties of rapidly solidified Mg67Ni23Pd10amorphous alloy [J].Jalloys Comp,2002,347.
[38]Zhang Yunshi , Yang Huabin , et al. Dehydriding properties of ternary Mg2Ni1 -x Zrx hydrides synthesized by ball milling and annealing [J]. Journal of Alloys and Compounds,1998,269(1-2).
[39]Yuan Huan-tang,Cao Rui,et al . Characteristic of a new Mg-Ni hydrogen storage system:Mg2 - xNi1 - y TixMny (0 < x < 1,0< y < 1) alloys [J]. Journal of Alloys and Compounds,2001,322 (1-2).
[40]Cui N,Luan B,et al . Discharge behaviour of Mg2Ni-type hydrogen-storage alloy electrodes in 6 M KOH solution by electrochemical impedance spectroscopy [J]. Journal of Power Sources,1996,63(2).
[41]Cui N,Luan B,et al. The electrode properties of Mg1. 9Al0. 1Ni0. 8Co0. 1Mn0. 1 alloy by mecha nical grinding withNi powders[J]. Electrochem Solid State Lett,1999,2.
[42]Garcıa G N, Abriata J P, Sofo J O. Phys Rev B[J].1999, 59(18).
[43]Takahashi Y, Yukawa H, Morinaga M. J Alloys Compds[J]. 1996, 242.
[44]C. P. Broedersz, R. Gremaud, B. Dam etc. Highly destabilized Mg-Ti-Ni-H system investigated by density functional theory and drogenography[J]. PHYSICAL REVIEW B,2008,77(2).
[45]Vegge T. Relaxation dynamics of magic clusters [J]. Phys. Rev. B, 2004, 70(3).
[46]Norskov J K, HoumollerA, Johansson P K, eta1. Adsorp tion and Dissociation of H2on Mg Surfaces [J]. Phys. Rev. Lett,1981,46.
[47]黄存可,黄丹,郭进,等. Mg2Ni贮氢合金的结构、性能与改性[J]. 广西物理,2005,26(2).
[48]谢昭明,付安庆,陈玉安,等. Al的添加对Mg2Ni储氢合金结构和氢扩散能力的影响研究[J]. 功能材料,2006,4(37).
[49] Y. Takahashi, H. Yukawa, M. Morinaga. J Alloys Compds [J].1996, 242.
[50]方志杰,梁业广,郭进,等. Mg2Ni氢化物电子结构的研究[J]. 桂林工学院学报,2004,24(4).
[51]马树元,黄丹,郭进,等. Mg2Ni合金及其氢化物的电子结构及成键特性的第一原理计算[J]. 中国有色金属学报,2007,17(1).
[52]黄存可. Mg2Ni基贮氢合金的掺杂和复合的实验及电子结构理论研究[D]. 南宁:广西大学,2006.
[53] ALAPATI S V ,JOHNSON J K,SHOLL D S. Identification of Destabilized Metal Hydrides for Hydrogen Storage Using First Principles Calculations [J]. J Phys Chem B ,2006 ,110.
[54]OHBA N ,AOKI M ,NORITAKE T ,et al. Firstprinciples Study of a Hydrogen Storage Material CaSi [J]. Phys Rew B ,2005, 72.
[55]Segall M D, Lindan P L D, Probert M J et al.J Phys:Condens Matter[J].2002,14(11).
[56]G. Kresse and D. Joubert. From ultrasoft pseudopotentials to the projector augmented-wave method[J]. Phys. ReV. B, 1999, 59 (3).
[57]G. Kresse and J. Furthmüller. Efficient iterative schemes for ab initio total-energy calculations using a plane-wave basis set [J]. Phys. ReV. B 54, Physical ReView B.1996,54(11169).
[58]G. Kresse and J. Hafner. Ab initio molecular dynamics for liquid metals[J].Physical ReView B.1993,47(558).
[59]http://www.imc.tuwien.ac.at/staff/tc_group_e.php.
[60]R. F. W. Bader[J].Chem. Rev. 1991, 91.
[61]Xiaoyan Li, Yanli Zeng, Lingpeng Meng, and Shijun Zheng. Topological Characterization of HXO2(X) Cl, Br, I) Isomerization[J].Phys. Chem. A 2007, 111.
[62]S. V. Alapati, J. K.Johnson, D. S. Sholl.Identification of Destabilized Metal Hydrides for Hydrogen Storage Using First Principles Calculations[J]. Phys. Chem. B, 2006, 110.
[63]N. Ohba, M. Aoki, T. Noritake, K. Miwa and S. Towata, First-principles study of a hydrogen storage material CaSi[J]. Phys. Rew. B, 2005, 72.
[64]陈玉安,苗鹤,丁培道. Mg2Ni系储氢合金元素取代改进的研究进展[J]. 材料导报,2004,18(12).

