海马中一氧化氮对大鼠睡眠-觉醒周期的影响
张 瑾,李春华,汪 凯,王烈成,尹 豆,张景行
(1.安徽医科大学睡眠研究室和生理教研室,安徽合肥 230032;2.南京军区空军机关医院,江苏南京 210018;3.安徽医科大学第一附属医院神经内科,安徽合肥 230022)
早在 20世纪 80年代末,就已证明 NO与心血管、免疫和神经系统的功能调节有关。NO作为一种信使分子,在中枢神经系统中起着神经递质或调质的作用,参与了睡眠-觉醒周期、突触可塑性,激素分泌等功能的调节[1]。近年来我们研究发现,海马是与睡眠密切相关的脑区[2],而海马与 NO的关系亦十分密切:海马的长时程增强(LTP)效应被认为是某些学习和记忆形式的基础,而 NO诱导的 cGMP水平的升高与 LTP有关;在慢性应激状态下,内源性的 NO具有抗抑郁的作用,而这一作用是通过刺激海马的神经发生实现的;当受到神经病理性损害如缺血时,海马是容易损伤的脑区,而 NO与缺血损伤的进程关系密切,且缺血损伤后的大鼠海马 NO含量增加;海马中含有丰富的一氧化氮合酶(NOS)阳性神经元。因此,既然海马与睡眠密切相关,而NO与海马的关系又如此密切,海马中的 NO是否与睡眠-觉醒的周期调节有关,是一个令人十分感兴趣的问题。目前尚未见此方面的研究报道。本研究通过核团内注射不同的工具药,通过自由活动的在体模式下提取动物的脑电波并作出分析,观察了海马中的 NO对大鼠睡眠-觉醒周期的影响。
1 材料与方法
1.1 动物与分组
健康成年 SD大鼠,雄性纯种,体重 200g~250g,SPF级,由安徽医科大学实验动物中心提供,大鼠分为实验组(L-NNA组、SNP组、L-Arg组、SNP+L-NNA组、L-Arg+L-NNA组)和对照组(NS组)。进实验室后置透明有机玻璃圆筒(高 45cm,直径25cm)内单独饲养,活动不受限制,自由摄食与饮水。所有大鼠均置于明/暗各 12h(光照 06∶00~18∶00时)通风环境中,室温维持在 20℃~24℃。
1.2 药品
戊巴比妥钠由上海化学试剂采购供应站分装厂进口分装,临用前用蒸馏水配置成 8 g·L-1溶液。L-NNA、SNP、L-Arg均为 Sigma公司的产品 ,所用剂量为 L-NNA 2.0μg;SNP 0.2μg;L-Arg 0.4μg,临用前用生理盐水配置,调节 pH值至 7.4,以排除溶液的酸碱度变化对实验的干扰。
1.3 手术
大鼠经戊巴比妥钠腹腔注射麻醉后,将其头部固定于 SN-2型脑立体定位仪上,暴露颅骨,双氧水清洁颅骨表面,按 Paxinos和 Watson大鼠脑立体定位图谱确定双侧海马插管位置(AP:-5.8mm、L/R:±5.0mm、H:7.0mm)。将 2根外径为 0.6mm的不锈钢引导管分别插入双侧海马中,引导管顶端距海马 1mm,供海马内微量注射药物用。在冠状缝前1mm及人字缝前 1mm与颅骨中线两侧旁开 1mm交叉点处分别安装铜质螺丝钉,深度以穿透颅骨接触到硬脑膜为度,用于记录皮层脑电活动。在双侧颈肌内插入银丝电极用于记录肌电活动。插管与记录电极均以牙科水泥固定于颅骨上,并将脑电和肌电电极通过电线焊接至微型插座(法国产)上。
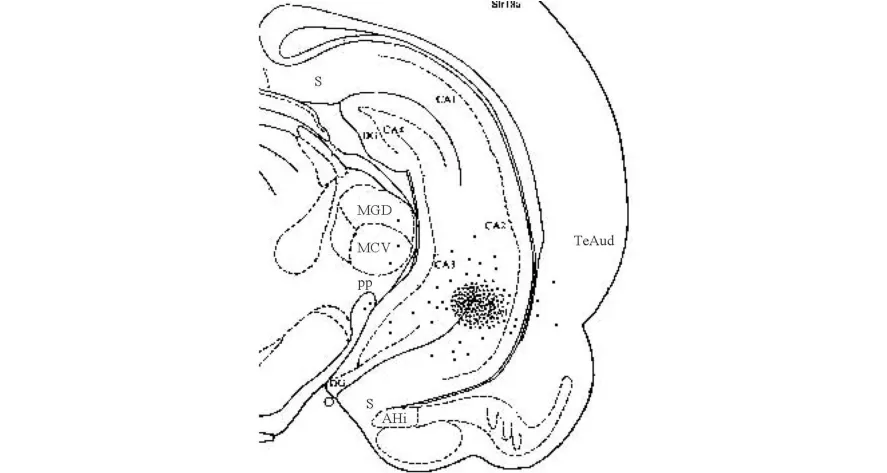
图1 海马内微量注射点和损毁点
1.4 睡眠描记及分析
记录电极通过微型插座连接到 ND-82B型八导脑电仪上,同步记录脑电和肌电活动,采用 30s为一分段时间,将睡眠-觉醒周期分为:①觉醒期(W):以额-顶叶引导出低幅快波脑电和明显的肌电活动为特征;②慢波睡眠(SWS):以睡眠梭形波和高幅慢波为特征,肌电活动明显减少,其中 δ波少于50%属浅慢波睡眠(SWS1),超过 50%属深慢波睡眠(SWS2);③异相睡眠(PS):以低幅快波为特征,除偶尔有肌肉抽动外,无明显肌电活动。总睡眠时间(TST)为 SWS和 PS之和。
1.5 实验步骤
大鼠术后置隔音、自动控制光照记录室中休息1周。记录前 1d将大鼠头部微型插座通过引导线连接脑电仪,以适应记录状态。在清醒待记录状态下进行微量注射,用针尖外径为 0.3mm的微量注射器通过引导管向核团内注射药液(实验组)或生理盐水(对照组)1μl,在 20 s内注射完毕,留针 1min以防药液溢出。每次描记从 09∶00开始,连续记录4h~6h,分析前 4h记录。
1.6 组织学鉴定
大鼠在实验结束后用外径为 0.3mm的单极不锈钢电极插入引导管,通以 2.5mA阳极直流电 10s电损毁被注射的核团,2d后各组大鼠取脑石蜡包埋,行 Nissl法染色,做组织学定位鉴定,观察引导管轨迹顶部是否位于海马,仅对定位准确的大鼠实验数据进行统计。
1.7 统计学方法
2 结果
2.1 海马内微量注射 L-NNA对大鼠睡眠-觉醒周期的影响
海马内微量注射 L-NNA(2.0μg)引起 W减少,SWS增多,睡眠加深。与 NS组相比,L-NNA组 W减少 36.0%(P<0.001),SWS1、SWS2、SWS和 TST分别增加 21.7%(P<0.05)、113.4%(P<0.05)、31.4%(P<0.001)和 25.6%(P<0.001)。
2.2 海马内微量注射 SNP对大鼠睡眠-觉醒周期的影响
海马内微量注射 NO供体 SNP(0.2μg)使 W增多,SWS减少,睡眠变浅。与 NS组相比,SNP组 W增加 34.6%(P<0.01),SWS2、SWS和 TST分别减少 76.1%(P<0.05)、21.2%(P<0.01)和 24.5%(P<0.01)。
2.3 海马内微量注射 L-Arg对大鼠睡眠-觉醒周期的影响
海马内微量注射 NO的前体 L-Arg(0.4μg)对睡眠无直接影响。
2.4 海马内微量注射 SNP+L-NNA对大鼠睡眠-觉醒周期的影响
SNP预处理 30min后再注射 L-NNA,可阻断 LNNA的促睡眠效应。SNP+L-NNA(0.2μg+2.0μg)组与 NS组相比无显著差异,与 L-NNA组相比,SNP+L-NNA组 W增加 56.3%(P<0.01),SWS2、SWS和 TST分别减少 65.0%(P<0.001)、22.7%(P<0.01)和 20.4%(P<0.01)。
2.5 海马内微量注射 L-Arg+L-NNA对大鼠睡眠-觉醒周期的影响
L-Arg预处理 30min后再注射 L-Arg可阻断 LNNA的促睡眠效应。L-Arg+L-NNA(0.4μg+2.0μg)组与 NS组相比无显著差异,与 L-NNA组相比,L-Arg+L-NNA组 W增加 47.4%(P<0.01),SWS2、SWS和 TST分别减少 80.9%(P<0.001)、19.9%(P<0.01)和 17.3%(P<0.01)。
表1 海马内微量注射 L-硝基-精氨酸、硝普钠、L-精氨酸对睡眠的影响(±s,min)
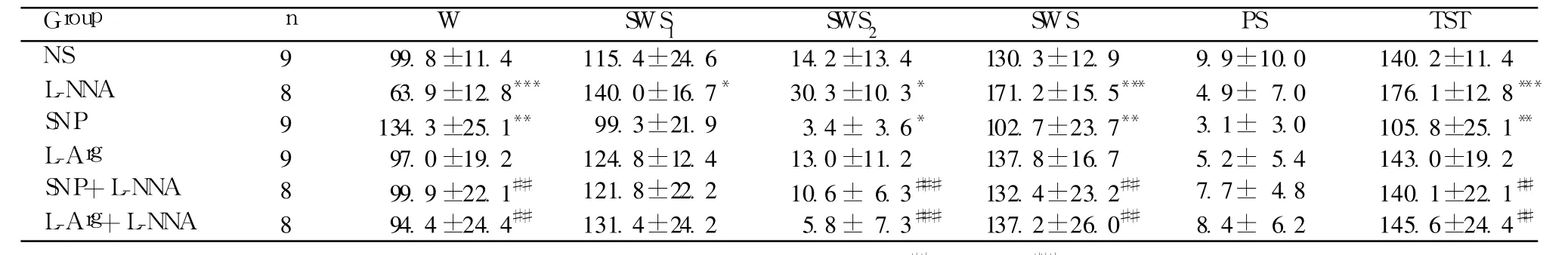
表1 海马内微量注射 L-硝基-精氨酸、硝普钠、L-精氨酸对睡眠的影响(±s,min)
注:与生理盐水组比较:*P<0.05,**P<0.01,***P<0.001;与 L-NNA组比较:##P<0.01,###P<0.001
Group n W SWS1 SWS2 SWS PS TST NS 9 99.8±11.4 115.4±24.6 14.2±13.4 130.3±12.9 9.9±10.0 140.2±11.4 L-NNA 8 63.9 ±12.8*** 140.0±16.7* 30.3 ±10.3* 171.2±15.5*** 4.9± 7.0 176.1±12.8***SNP 9 134.3±25.1** 99.3±21.9 3.4± 3.6* 102.7±23.7** 3.1± 3.0 105.8±25.1**L-Arg 9 97.0±19.2 124.8±12.4 13.0±11.2 137.8±16.7 5.2± 5.4 143.0±19.2 SNP+L-NNA 8 99.9±22.1## 121.8±22.2 10.6± 6.3### 132.4±23.2## 7.7± 4.8 140.1±22.1##L-Arg+L-NNA 8 94.4±24.4## 131.4±24.2 5.8± 7.3### 137.2±26.0## 8.4± 6.2 145.6±24.4##
3 讨论
从 19世纪开始,有关睡眠发生的脑机制以及和催眠有关的物质,截止目前尚有许多问题需要进一步深入研究。本研究室曾系统地对杏仁核、中缝背核、下丘脑腹外侧视前区、丘脑网状核等脑区在睡眠调节中的作用进行过研究。近年来的诸多研究表明,海马与睡眠调节的关系十分密切,如经短期睡眠剥夺的大鼠,其海马中某些蛋白质高度地表达;海马齿状回含有能分化为神经元的祖细胞。有研究发现,剥夺成年大鼠 96h的睡眠(慢波睡眠和快波睡眠均剥夺)后,其海马齿状回的神经发生受到抑制,特异性地剥夺快波睡眠后亦能产生相似的结果;海马与中缝核、杏仁核、蓝斑、丘脑、下丘脑等调节睡眠的神经结构间有着复杂的纤维联系;海马中含有许多与睡眠调节相关的神经递质,如 5-羟色胺(5-HT)、乙酰胆碱(ACh)、去甲肾上腺素(NA)等,本研究室也曾报道过海马参与睡眠调节的相关研究结果。
NO作为一种信使分子,在中枢神经系统中起着神经递质或调质的作用,参与了睡眠-觉醒周期、突触可塑性、激素分泌等功能的调节。SNP为 NO的供体,在体内能自发释放 NO,其释放量与 NOS活性无关。L-Arg为 NO的前体,在 NOS作用下可生成 NO。本研究发现,海马内微量注射 L-NNA可使觉醒减少,慢波睡眠增多,睡眠加深;微量注射 LArg对睡眠无直接影响,但可阻断 L-NNA的促睡眠效应;微量注射 SNP使觉醒增多,慢波睡眠减少,睡眠变浅,并可阻断 L-NNA的促睡眠效应,表明抑制海马中内源性 NO生成具有减少觉醒和增加慢波睡眠的效应,而海马中外源性 NO释放则引起增加觉醒和减少慢波睡眠的效应。结果提示,NO在海马可能发挥着促觉醒的作用。1997年 Burlet等报道用电压感受计检测大鼠脑中 NO的浓度,发现大鼠清醒时信号强度增高,而在慢波睡眠和快波睡眠期明显降低;同年 Williams等用微透析及血红蛋白捕捉技术,测定大鼠丘脑细胞外 NO在睡眠-觉醒周期中的变化,发现 NO在脑电去同步化状态(清醒及快波睡眠)时合成最快,而在慢波睡眠期显著降低;Marino等用伏安发检测大鼠脑内 NO的浓度,亦发现 NO在觉醒期合成最快,而在慢波睡眠及快波睡眠期明显降低,以上报道均支持我们的实验结果。NO参与睡眠调节的另一方面有力证据是:NO激活可溶性鸟苷酸环化酶(sGC),升高细胞 cGMP水平,是 NO多种生物效应的主要信号转导机制,那么海马中 NO对睡眠的调节作用是否与 cGMP有关呢?Ribeiro等研究发现,在大鼠脑室内注射 8-Br-cGMP(一种可透过膜的 cGMP的类似物)可促进觉醒,抑制快波睡眠和慢波睡眠,提示 cGMP参与了睡眠的调节,故我们推测海马中的 NO可能是通过激活鸟苷酸环化酶使 cGMP浓度升高而发挥其抑制 SWS作用的,我们曾报道 cGMP水平升高具有促进觉醒,抑制慢波睡眠的作用,与本研究结果相符合。
有研究表明,NO在衰老过程中发挥了一定的作用,在衰老过程中组织产生的 NO降低,可能是导致老年人容易患记忆减退、老年性痴呆等脑功能障碍性疾病的重要原因之一,提示我们老年人的睡眠质量下降,特别是深慢波睡眠的减少,与组织 NO含量的变化似乎不无关系。而本研究发现,海马中NO含量降低可以使睡眠加深,提示海马中 NO参与了深慢波睡眠的调节,因而本研究在一定程度上从有可能影响 NO和 cGMP代谢的化学物质的角度,为临床寻找到理想、新型的催眠药物提供了可借鉴的思路和一定的实验理论依据。
我们知道睡眠的调节不是单一的某个中枢的功能,它涉及多级脑中枢的相互联系,因此增加了探讨睡眠机制的复杂性。海马中 NO对睡眠-觉醒周期的调节中,NO与其他递质的协同作用也可能参与其中发挥作用。海马内的 NO能调节多种神经递质的释放,如 5-羟色胺、乙酰胆碱、多巴胺等,而本研究室亦曾系统探讨过这些递质在睡眠-觉醒周期调节中的重要作用,具体的相关机制有待我们在今后的工作中做进一步的研究和探讨。
[1]Calabrese V,Mancuso C,Calvani M,et al.Nitric oxide in the central nervous system:neuroprotection versus neurotoxicity[J].Nat Rev Neurosci,2007,8(10):766-775.
[2]李春华,张瑾,赵乐章,等.海马中 5-羟色胺对慢波睡眠的影响[J].中国中医基础医学杂志,2006,12(11):844-845.

