传统鱼露发酵的微生物动态分析*
黄紫燕,朱志伟,曾庆孝,张永丝,简永舜
(华南理工大学轻工与食品学院,广东广州,510640)
鱼露是我国典型的传统调味品之一,其独特的风味是在酿造过程中,由微生物引起的一系列生化变化形成的[2]。目前,我国鱼露的加工生产需要2~3年的时间,生产周期较长,生产成本高,缩短发酵时间是急需解决的问题。以往的研究主要侧重于从物理、化学方面优化加工工艺,生产周期大大缩短,但无法还原鱼露天然风味。
鱼露发酵过程中要对微生物进行选择性培养,生存下来的优势菌可通过发酵赋予产品主要滋味。对鱼露风味有直接关系的微生物是酵母菌和乳酸菌。在黄豆酱、酱油等发酵食品的实际生产中,一些工厂会在发酵后期加入乳酸菌与酵母菌发酵液,以增加其风味物质的形成[3]。鱼露发酵过程中其品质特征形成规律仍不为人们所了解,目前仍未见对鱼露传统发酵过程中微生物的动态分析及优势菌群的分析[4]。
本实验以传统发酵工艺制作鱼露,研究发酵过程中不同阶段的微生物的消长变化,检测pH值、总酸、总酯、乙醇含量、TSN、AAN、TVB-N等理化指标,分析游离氨基酸组成与含量,将这3者结果结合起来综合分析,试图找出加工过程中微生物与游离氨基酸形成、风味形成的关系,明确微生物的作用,初步探讨发酵机理。我们可以以此为理论依据,选择合适时期有目的的添加合适的发酵菌种,保证风味的基础上加快发酵进程,应用在鱼露的实际生产中,科学指导鱼露快速发酵[5]。
1 材料与方法
1.1 原材料及样品准备
发酵鱼露由广东省汕头鱼露厂有限公司提供。以鳀鱼(Engraulis japonicus)为原料,加30%的海盐混匀,在(30±5)℃下自然发酵3年,在不同阶段取出发酵液进行分析。取样时,将鱼露发酵液混匀,取适量混合液,部分用于微生物检测,部分用滤纸(新星,102#定性滤纸Ф12.5cm)过滤,滤液沸水浴10 min后用于理化指标分析。
1.2 微生物检测
计数总菌,用显微镜(CX31RTSF,OLYMPUS,日本)观察;计数菌落总数,采用营养琼脂培养基;计数细菌数,采用牛肉膏蛋白胨琼脂培养基;计数乳酸菌数,采用MRS培养基;计数产蛋白酶乳酸菌数,采用TSA培养基;计数酵母菌数,采用麦芽汁琼脂培养基;计数霉菌数,采用察氏琼脂培养基[4,6]。
选取菌落数在30~300之间的平板作为菌落数测定标准,1个稀释度选用2个平板。
1.3 理化指标的测定
总可溶性氮(TSN),凯氏定氮法[7];氨基酸态氮(AAN),甲醛滴定法[6];挥发性盐基氮(TVB-N),康维皿法(微量扩散法)[8];pH 值,按照 GB/T10786-1989方法,用数字式pH计(pHS-3C,上海精密科学仪器有限公司)测定;总酸,GB/T 12456-1990;总酯,按照GB/T 10345.5-1989测定;挥发性风味物质中乙醇含量的测定,采用气相色谱-质谱联用(GCMS)进行定性定量分析[9]。
所有的试验至少进行3次,计算相应的标准偏差。指标内部的均值比较采用最小显著差异法(Least significant difference,LSD),取 95% 置信度(P<0.05)。
1.4 游离氨基酸组成的测定
游离氨基酸的测定采用高效液相色谱法,采用Waters高效液相色谱仪和PICO.TAG氨基酸分析柱,检测波长为254 nm,柱温为38℃,流速为1 mL/min。标准氨基酸溶液为Sigma产品。数达到最大,其对数值为8.0,而后开始缓慢下降,大部分微生物,尤其是不适盐微生物逐渐被淘汰,直到进入后期保温发酵期(55~60℃)时,无需经杀菌即可得商业鱼露。
2 结果与讨论
2.1 鱼露发酵过程微生物菌系的消长变化分析
对汕头鱼露厂酿造的鱼露进行镜检及平板稀释分离计数,结果见图1。从图1中可以发现,在鱼露传统发酵的整个过程中,各类微生物数量相差很大,显微镜计数结果比倒平板实验结果平均高出2个对数值。发酵前半年,优势菌互相交替,为鱼露发酵主要活动期,而后慢慢稳定。在发酵3~4个月时菌落总
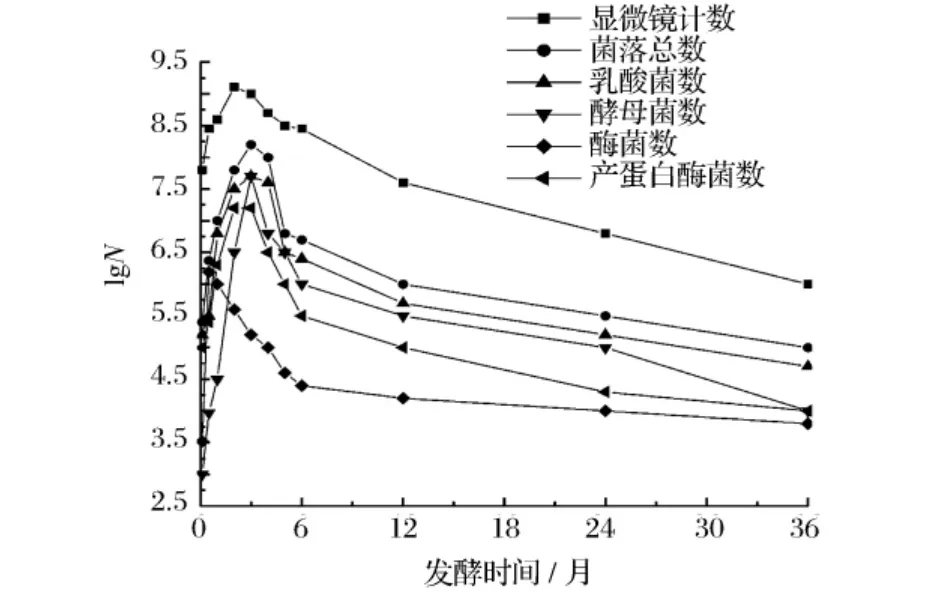
图1 传统鱼露发酵过程主要微生物的消长变化
结合图1、图2可以看出,鱼露中含有丰富的耐盐性乳酸菌,尤其是产蛋白酶乳酸菌。在整个发酵期间,乳酸菌的数量一直高于其他2种菌,是整个发酵期的优势菌,所占比例维持在30%以上。在发酵2~4个月时其数量达到最大值,对数值为7.5~7.6。发酵1年以后,菌相组成相对稳定,乳酸菌占菌落总数的比例维持在60%左右。乳酸菌发酵使环境pH值下降。
在发酵初期,由于海盐尚未渗入鱼体,鱼汁尚未渗出,鱼盐空隙存在空气,大量的霉菌开始生长。发酵至15天时,霉菌最先达到最大量,对数值为6.19,占菌落总数的66%,是发酵初期的优势菌。霉菌分泌出各种蛋白酶,使蛋白质水解成为多肽、氨基酸等,为后阶段其他微生物的生长创造条件。但随着海盐渗入鱼体,鱼汁渗出,鱼盐间空隙被填满,高食盐浓度和缺乏氧气使霉菌生长变缓,霉菌数量减少。
霉菌分泌的酶类发挥作用,乳酸发酵使pH值下降到一定程度,且存在厌氧环境,酵母菌大量繁殖。从发酵开始,酵母菌数量不断增多,从最开始对数值为3.5,发酵3个月时,对数值已达到7.8,占菌落总数的63%,成为该时期的优势菌。在发酵2~4个月时,乳酸菌和酵母菌这两种优势菌体之间引起竞争进行酒精发酵,生成乙醇,进而促进各种香气成分的生成[10]。酵母和乳酸菌的混合发酵能产香、产酒精,与单纯的乳酸发酵相比,酸味适口[11]。而后由于环境pH值的不断下降,酵母菌数量逐渐减少,发酵1年以后,其所占的比例基本稳定,为30%。
2.2 鱼露发酵过程pH值、总酸含量的变化
酸度是反映乳酸发酵进程的一个重要指标,鱼露发酵过程中pH值、总酸含量的变化如图3所示。
结合微生物变化分析,耐盐乳酸菌是整个发酵期间的优势菌,鱼露中的主体酸是乳酸,它使发酵液中pH值下降。由图3可看出,在发酵前0.5个月,由于乳酸菌与其他杂菌相竞争,尚未成为优势菌,发酵过程中腐败菌生长较旺盛,有些蛋白质被分解为挥发性盐基氮,使pH值大幅度上升,发酵15 d,发酵液中pH值高达5.90。发酵2~3个月时,乳酸菌抑制住杂菌,开始成为环境中的优势菌,环境pH值呈缓慢下降状态。
5.仔猪副伤寒。由沙门氏菌引起,多发生于2~4月龄的仔猪,无明显的季节性。急性型:呈败血症症状,突然发病,体温升高,食欲废绝,初便秘,后下痢,排恶臭稀粪,病后2~3 d在鼻端、两耳及四肢下部皮肤发紫,病猪低头呆立,步态摇晃,体温下降,不久死亡。慢性型最多见,病猪呈渐进性消瘦,体温略升高,精神不振,初便秘,后呈持续性或间歇性腹泻,排淡黄色或黄绿色恶臭稀便,混有血液、坏死组织。剖检急性呈败血症变化;慢性肠黏膜呈弥漫性坏死性糜烂。
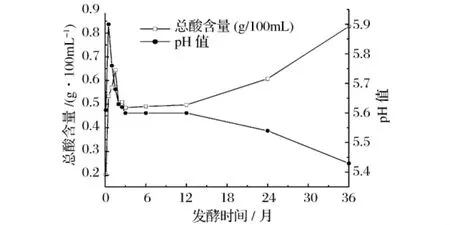
图3 传统鱼露发酵过程中PH及总酸含量的变化
发酵液中总酸的变化与pH值变化基本相反。已有研究认为,酸类来源于脂肪酸的氧化或者微生物对氨基酸发酵作用[12-13];尤其来自那些能耐高浓度盐的菌种,Beddows等研究证明,产挥发性脂肪酸的细菌在鱼和富含蛋白质的培养基上生长良好[14]。故发酵3个月后酸度不断上升,表明鱼露发酵过程中产生挥发性脂肪酸,使得鱼露中酸类物质(如乳酸、琥珀酸、柠檬酸等)含量不断升高,大量低分子量的挥发性有机酸,如乙酸、丁酸、丙酸开始形成,它们是鱼露中的主要风味物质,赋予鱼露干酪的风味[15]。
2.3 鱼露发酵过程TSN、AAN、TVB-N含量的变化
TSN、AAN、TVB-N是能反映微生物群体利用氮源发酵的情况的指标,是反映鱼体蛋白质被分解情况的指标,也是鱼露质量分级的重要指标,其发酵过程的变化如图4所示。

图4 传统鱼露发酵过程中TSN、AAN、TVB-N含量的变化
TSN和AAN含量的变化趋势相一致,随发酵时间的延长而逐渐增加。在发酵前6个月快速增长,随后增长变缓。发酵6个月时,TSN含量已达1.43 g/100 mL,蛋白质转化率为51.8%。这可能是由于发酵初期,各种优势菌相互交替出现,乳酸菌、酵母菌处于活跃期,尤其是乳酸菌能分泌出蛋白酶,原料鱼蛋白质在半年内基本完成水解。
TVB-N是衡量鱼露腐败变质的1个重要指标,其形成主要是由于鱼体在发酵过程中腐败微生物的生长,将蛋白质分解成氨基酸后,再进一步分解为氨、三甲胺等挥发性盐基含氮化合物[16]。图3结果显示,发酵前一个月,发酵液的TVB-N含量增长较快,可以推断优势菌尚未抑制住杂菌,随后在2~4个月时,TVB-N含量基本不增长,可能是由于乳酸菌、酵母菌的迅速繁殖,这与图1结果相吻合。
2.4 鱼露发酵过程总酯、乙醇含量的变化
发酵液中乙醇含量是能反映酵母菌发酵进程的一个指标,发酵过程总酯、乙醇含量变化如图5所示。
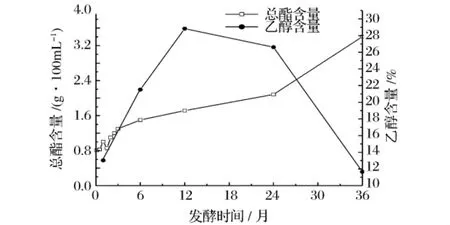
图5 传统鱼露发酵过程中总酯及乙醇含量的变化
在鱼露的挥发性风味物质中,乙醇是最先快速生长的物质。由图5可以看出,在发酵前1年,2大优势菌体竞争引起乙醇的快速生长。从发酵初期开始,由于酵母菌的大量繁殖,乙醇随发酵时间延长不断增长,到发酵1年时达到最大值,含量占挥发性风味物质总量的28.83%。而发酵一年以后,乙醇可能通过被氧化成醛、酮类,进而氧化成酸,慢慢转化为其他风味物质,相对含量逐渐减少,到发酵3年后,乙醇含量仅占11.66%。乙醇是鱼露中主要风味物质生成的前体物。
潮汕鱼露的独特风味在3年的发酵过程中逐渐形成,其间总酯含量不断上升,尤其是第2~3年时上升很快,从2.08 g/100 mL上升到3.40 g/100 mL,增长了49.7%,与乙醇含量的迅速下降形成鲜明对比。酯类中的2-硝基丙酸乙酯、二甲酯、乙酸乙酯等[13]相互协同,共同构成鱼露的特殊风味。
2.5 鱼露发酵过程中游离氨基酸组成与含量的变化

表1 鱼露发酵过程中游离氨基酸的组成与含量mg/100g
游离氨基酸组成与含量测定结果见表1,可以看出,潮汕鱼露中游离氨基酸总量随着发酵时间的延长不断增加(P<0.05),发酵各阶段样液中谷氨酸含量都较高并不断增加,这表明鱼露的鲜味形成需要一定的时间。发酵3年后,终产品的游离氨基酸总量为5 705.79 mg/100 mL,而在发酵半年后其游离氨基酸总量已达到4 866.66 mg/100 mL,说明游离氨基酸的主要形成时间是在发酵的前6个月,其后游离氨基酸总量缓慢上升。这可能是由于发酵初期,各种优势菌相互交替出现,乳酸菌、酵母菌处于活跃期,尤其是乳酸菌能分泌出蛋白酶,原料鱼蛋白质在半年内基本完成水解。但随后环境pH值下降、温度升高,乳酸菌、酵母菌数量减少,鱼露发酵速度下降。这时可以在鱼露中适量添加这2种优势菌,加速发酵,以利于风味和滋味物质的形成,从而缩短鱼露产品的陈化和后熟时间。
色氨酸、丝氨酸、酪氨酸和半胱氨酸的含量在发酵一年期间时而升高时而降低,明显波动,这与发酵初期优势菌体不能稳定有关,也说明氨基酸是鱼露挥发性化合物的重要前体物,例如特征挥发性化合物中的含硫化合物由含硫氨基酸转化而来。
3 结论
(1)鱼露发酵15d时发酵液中霉菌数达到最大值,是发酵初期的优势菌;3个月时酵母菌取代之;乳酸菌是整个发酵期间的优势菌,其含量在2~4个月达到最大,其对数值为7.5。
(2)乳酸菌生长使环境中pH值下降,促进酵母菌生长,两菌竞争使乙醇得到迅速增长,在发酵1年时达到最大,占挥发性风味物质总量的28.83%,随后,乙醇慢慢转化为鱼露中其他挥发性风味物质,而此时总酯含量逐渐增大,最后一年增加了49.7%。
(3)发酵初期微生物生长比较活跃,数量较多,分泌出蛋白酶促使蛋白质降解,TSN、AAN、TVB-N含量在前6个月增长较快,游离氨基酸形成主要在发酵前半年,随着微生物数量下降,其增长速度也减缓,可以适量添加优势菌株,加速发酵,以利于风味和滋味物质的形成,从而缩短鱼露产品的陈化和后熟时间。
[1] 张水华,刘耘.调味品生产工艺学[M].广州:华南理工大学出版社,2000:68.
[2] 黄永.黑龙江地区自然发酵黄豆酱中酵母菌的分离鉴定及筛选[D].哈尔滨:东北农业大学,2006:15.
[3] 曾令彬,熊善柏,王莉.腊鱼加工过程中微生物及理化特性的变化[J].食品科学,2009,30(3):54-57.
[4] 贡汉坤,姚清海.传统酱类自然发酵的微生物学分析[J].中国调味品,2003,10(10):9-12.
[5] 刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社,2006:148.
[6] 张水华.食品分析[M].北京:中国轻工业出版社,2004:156-159,174-175.
[7] Conway E J,Byrne A.An absorption apparatus for the micro-determination of certain volatile substances:The microdetermination of ammonia[J].Biochem J,1936,27:419 -429.
[8] Jiang J J,Zeng Q X,Zhu Z H W.Analysis of volatile compoundsin traditional chinese fish sauce(YuLu)[J].Food Bioprocess Technol,2008,24:173 -178.
[9] 门胁清.酱醪中微生物间的相互作用[J].中国调味品,1988(5):12-14.
[10] 李开雄,唐明翔,蒋彩虹,等.酵母菌在发酵香肠中的运用[J].肉类工业,2002,256(8):14-17.
[11] Beddows C G,Ardeshir A G,Daud W J.Development and origin of the volatile fatty acids in budu[J].Journal of the Science of Food and Agriculture,1980,31:86.
[12] McIver R C,Brooks R I,Reineccius G A.Flavor of fermented fish sauce[J].Journal of Agricultural and Food Chemistry,1982,30(6):1 017 -1 020.
[13] Brain J B Wood主编,徐岩译.发酵食品微生物学[M].北京:中国轻工业出版社,2001:315.
[14] 江津津,曾庆孝,朱志伟,等.耐盐微生物对鯷制鱼露风味形成的影响[J].食品与发酵工业,2008,34(11):25-28.
[15] 刘培芝.谈谈提高鱼露质量的一些技术措施[J].中国调味品,1988(8):15 -18,30
[16] Ottinger H,Soldo T,Hofmann T.Discovery and structure determination of a novel Maillard-derived sweetness enhancer by application of the comparative taste dilution analysis(cTDA)[J].Journal of Agricultural and Food Chemistry,2003,51:1 035 -1 041.
[17] Solms J.The taste of amino acids,peptides,and proteins[J].Food Chemistry,1969,17(4):686 -688.
[18] Jurado A,Garcia,Timon mL,et al.Effect of ripening time and rearing system on amino acid-related flavor compounds of Iberianham[J].Meat Science,2007,75(4):585-594.
[19] Park J N ,Fukumoto Y,Fujita E.Chemical Composition of Fish Sauces Produced in Southeast and East Asian Countries[J].Journal of Food Composition and Analysis,2001,14:113 -125.
[20] Yoshiwa T,Morimoto K,Sokamoto K,et al.Volatile compounds of fishy odor in sardine by simultaneous distillation and extraction under reduced pressure[J].Nippon Suisan Gakkaishi,1997,63(2):222 -230.

