中国近海5个黑鲷地理群体的遗传变异
赵 爽, 章 群, 乐小亮, 彭 博, 许忠能, 韦桂峰, 李贵生
(暨南大学 水生生物研究所, 广东省教育厅水体富营养化与赤潮防治重点实验室, 广东 广州 510632)
中国近海5个黑鲷地理群体的遗传变异
赵 爽, 章 群, 乐小亮, 彭 博, 许忠能, 韦桂峰, 李贵生
(暨南大学 水生生物研究所, 广东省教育厅水体富营养化与赤潮防治重点实验室, 广东 广州 510632)
为有效保护和利用黑鲷(Acanthopagrus schlegeli)资源, 本研究测定了中国近海 5个群体(北方海域的营口与崂山群体, 南方海域的闽清、大亚湾、东兴群体)各 10尾黑鲷线粒体控制区 5′端 722bp序列以分析其遗传多样性和遗传结构。结果发现 42个单倍型, 56个多态位点; 群体单倍型多样性为0.978~1.000, 群体核苷酸多样性为 0.0067~0.0116。中性检测和核苷酸不对称分布分析表明, 中国近海黑鲷在晚更新世(165~41 kaBP)曾经历过种群的快速扩张。北方群体与南方群体之间的Fst值为0.1145(P=0.00), 表明存在中等程度的分化, 建议将中国近海黑鲷作为两个管理单位。
黑鲷(Acanthopagrus schlegeli); 线粒体控制区; 遗传多样性; 群体遗传结构; 种群历史动态
黑鲷(Acanthopagrus schlegeli)隶属鲈形目(Percoiformes),鲷科(Sparidae),棘鲷属(Acanthopagrus), 是分布于中国、韩国和日本近海的底层鱼类。黑鲷肉质鲜美, 生长迅速, 适应能力强, 栖息于河口、海湾, 不作长距离洄游, 是重要的捕捞鱼类和增养殖对象[1]。近年来海洋环境污染与栖息地破坏以及过度捕捞, 导致天然黑鲷资源急剧衰减, 种质资源的保护、恢复和增殖迫在眉睫。了解种群的遗传变异是评估资源现状, 制定野生群体保护与恢复策略,实施养殖群体种质遗传改良的重要前 提[2]。目前中国黑鲷的遗传变异研究主要见于 Jean等[3]对台湾海峡沿岸7个天然群体, 杨慧荣等[4]对青岛、厦门、海南3个天然群体及龚金波等[5]对青岛、深圳、北海3个天然群体的遗传多样性及群体遗传结构的报道,尚未有全面深入分析中国近海各海域种群遗传结构和种群历史动态的报道。
线粒体 DNA(mitochondrial DNA, mtDNA)具有进化速度快、母系遗传、几乎不发生重组等特点[6],是研究动物遗传变异的良好遗传标记。线粒体控制区为非编码区, 其进化速率要比线粒体蛋白质编码基因高 2~5倍, 非常适合分析种群遗传多样性和遗传结构[7], 在鱼类种群遗传研究中应用广泛[8~11]。为了更加有效地保护和利用黑鲷的种质资源, 对中国沿海黑鲷的 5个主要分布区域(包括渤海, 黄海, 东海, 南海广东海域及南海北部湾海域)中天然黑鲷群体线粒体控制区序列进行分析, 期望能较完整地揭示中国沿海黑鲷群体遗传多样性、 遗传结构及种群历史动态, 为黑鲷资源保护、种质改良和开发利用提供科学依据, 也为评估近年来增殖放流效果及其对黑鲷遗传多样性影响提供背景资料。
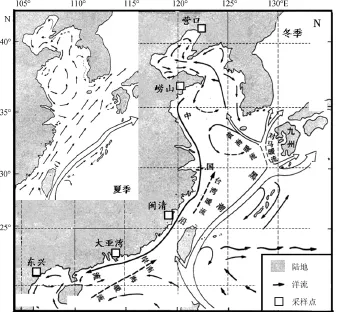
图1 采样点的分布及中国沿海海流和洋流情况(根据孙海平等[12]修改)Fig. 1 Map of the studied area depicting sampled populations and currents(modified from Sun Haiping)
1 材料与方法
1.1 材料
2004年7月~2008年11月间采自辽宁营口(渤海海域)、山东崂山(黄海海域)、福建福清(东海海域)、广东大亚湾(南海广东海域)、广西东兴(南海北部湾海域)(图1)5个地点, 每个地点各取 10尾黑鲷, 用95%的酒精处理并保存。所有样品均为从近海作业的小型渔船上购买的野生鱼类。
1.2 基因组DNA的提取与PCR扩增
取酒精保存的肌肉约 50 mg, 晾干后采用传统酚-氯仿法提取总 DNA, 用 1%的琼脂糖凝胶电泳检测。采用自行设计黑鲷专一性引物CrF:5’-gttggaatcctccctactgctc-3’和 CrR:5’-tcttaacca ccctttacgccga-3’进行PCR扩增。PCR反应及测序参照陈艺燕等[13], 测序引物为CrF。
1.3 数据处理
测定的序列经人工校对后, 用 ClustalX 1.83软件进行序列比对, MEGA4.0软件计算核苷酸组成,碱基变异情况, 转换和颠换值, 采用Kimura2-parameter(K2-p)模型建立单倍型邻接树, 采用1000次bootstrap计算分支支持率。以Arlequin 3.11软件计算两两群体间Fst值, 并以1000次置换分析其统计学显著性。用DNASP4.50统计群体单倍型多样度(h)、核苷酸多样度(π)。以Arlequin 3.11软件计算Tajima’s D和Fu’s FS值, 并进行核苷酸不对称分布分析, 并获得τ值; 用公式τ=2ut估算种群扩张时间[14], 其中τ是扩张时间参数;u=2µk,µ为变异速率,k表示序列长度;t表示自扩张以来所经历的代数; 扩张时间T=t×代时。
2 结果与分析
2.1 序列特征及遗传多样性
人工校对后获得50尾样品长度为722bp的线粒体控制区序列片段。其中, T、C、A、G平均含量分别为31.5%,19.9%,33.8%,14.8%, A+T含量65.3%高于G+C含量 34.7%, 表现出反 G偏倚; 共发现单倍型42个, 多态位点56个, 其中插入缺失为2个, 简约信息位点32个, 转换位点为7个, 没有颠换, 转换远高于颠换[15]; 群体单倍型多样性h为 0.978~1.000,群体核苷酸多样性π为 0.0067~0.0116, 其中营口群体最低, 东兴群体最高。
2.2 群体遗传结构
以 42个单倍型构建的邻接树见图2, 单倍型H8、H9、H14为营口与崂山群体共享, H36为福清与大亚湾群体共享, 其他单倍型为各群体特有。在K2-p模型构建的单倍型邻接关系树上, 不同地理来源的单倍型较散乱无序的分布于各分枝, 没有发现明显的地理聚群; 大部分分支的 Bootstrap(1000次)支持率小于50%,没有发现明显的谱系结构。

图2 基于 K2-p模型建立的黑鲷控制区序列单倍型邻接树与单倍型在5个群体中的分布Fig. 2 NJ tree of 42 haplotypes using kimura-2 parameter model and their distributions in 5 populations of A.schlegeli
两两群体间Fst值见表1。中国北方海域的营口与崂山群体之间, 南方海域的闽清、大亚湾、东兴3群体两两之间Fst值为负值且统计学上没有显著差异(P>0.05), 表明北方海域 2个群体之间, 南方海域的 3个群体之间都没有明显的遗传分化[16];而北方海域的2个群体分别与南方海域的3个群体两两间Fst在 0.0567~0.14025, 且均差异显著(P<0.05), 表明北方海域与南方海域黑鲷间出现了中等程度的分化。若根据以上结果将没有出现分化的地理群体合并为北方群体及南方群体, 两者间的Fst为 0.1145 (P=0.00), 进一步说明其间存在中等程度的分化。

表1 中国近海黑鲷群体样本数、单倍型、单倍型多样性、核苷酸多样性与两两群体间的Fst值Tab. 1 Sample size, number of mtDNA control region haplotypes, haplotype diversity, nucleotide diversity and pair-wiseFst in 5 populations of A.schlegeli in coastal waters of China
2.3 群体历史动态
高的单倍型多样性和低的核苷酸多样性提示历史上黑鲷可能经历过种群快速扩张[20]。将中国沿海5个黑鲷群体作为一个整体, 利用 Tajima’sD和 Fu’sFs中性检验以及核苷酸不对称分布(mismatch distribution)分析种群历史动态。Tajima’sD=-1.5468(P=0.044)和 Fu’sFs=-25.0669(P=0.000)均为负值且显著偏离中性, 表明中国近海黑鲷可能经历过快速扩张[17,18]。核苷酸不配对分布呈单峰型(图3), 与群体扩张模型下的预期分布接近, 同样说明黑鲷种群经历过种群扩张[14]。根据τ的观测值 7.979, 以5%~20%每百万年线粒体控制区变异速率[10], 代时为 3, 可估计出黑鲷种群扩张时间在更新世晚期(约为 165~41 kaBP)。
3 讨论
3.1 黑鲷的遗传多样性与种群历史动态
龚金波等[5]对青岛, 深圳, 北海3个黑鲷群体线粒体控制区序列分析发现群体单倍型多样性h为0.935~0.968, 群体核苷酸多样性π为 0.00702~0.00903, 其中北海群体最高而青海群体最低, 与本研究结果一致。与同域分布的黄鳍鲷(Acanthopagrus latus)(h:09929~0.9952,π:0.0125~0.0187)、二长棘鲷(Evynnis cardinalis)(h:0.9764~1.0000 ,π:0.0120~0.0144)[8]、白姑鱼(Pennahia argentata)(h:0.9130~0.9926,π:0.0073~0.0099)[9]、 花 鲈 (Lateolabrax maculatus)(h:0.96~1,π:0.008~0.015)[11])相比较, 黑鲷具有相似的单倍型多样性h和较低的核苷酸多样性π。

图3 黑鲷线粒体控制区序列核苷酸不配对分布Fig. 3 The mismatch distribution of the mitochondrial D-loop sequences of A. schlegeli
线粒体控制区为非编码序列, 受到较小的选择压力, 其基因频率主要决定于突变率及其有效群体的大小[19]。本研究检测出黑鲷具有高的单倍型多样性, 一方面可归因于线粒体控制区具有高的突变率,另一方面也反映了中国沿海黑鲷具有较大的有效群体。核苷酸多样性积累远比单倍型多样性积累所需的时间漫长, 黑鲷具有高的单倍型多样性, 低的核苷酸多样性, 推测其可能经历过瓶颈效应后的快速扩张[20]; 中性检测和核苷酸不对称分析证实了这种推测。与黑鲷类似, 研究表明中国沿海许多鱼类都可能经历过种群扩张[10~13]。在晚更新世(126~10kaBP)期间, 地球气候剧烈的波动导致海平面经历多次大幅度的下降, 在末次冰盛期一度下降130~150 m, 中国沿海大陆架曾大面积露出[21]。因此, 中国沿海一些鱼类可能经历了冰期分布区的缩减和冰期后分布区的扩张, 这一系列事件对现代种群的遗传格局产生重要的影响[22]。
3.2 黑鲷的遗传结构与管理保护
幼体随海流的扩散是海洋鱼类在较大地理范围内遗传分化较小的重要原因[23]。浮性卵和幼体约20 d的浮游生活期提示黑鲷可随中国沿岸流等海流(图1)扩散较远的距离[3], 因此不难解释黑鲷北方群体之间以及南方群体之间没有遗传分化的发生。但黑鲷北方群体和南方群体之间出现显著的遗传分化, 表明其间可能存在某种阻止黑鲷扩散的障碍。黑鲷的繁育季节的地理变化以及中国沿岸流流向季节性变化使东海和黄海之间的幼体迁移变得困难。由于受温度的影响, 不同海域的黑鲷群体产卵季节明显不同, 如广东为 12月~次年 3月中, 福建为 3月中~5月初, 山东为5月初~6月初[24]; 而在4~5月, 受季风影响的中国沿岸流由向南转为向北(图1); 因此东海以南与黄海以北的黑鲷幼体之间的相互迁移受阻。
确定进化显著单位(Evolutionarily Significant Units,简称 ESUs)和管理单位(Management Units,简称MUs)是开展物种保护的前提。Moritz[25]认为 ESUs是指在历史上受到长期隔离, 以致mtDNA单倍型互为单系, 核等位基因频率具有显著差异的群体, 注重于长期的, 进化上的管理; MUs是指在统计学上独立的群体, 不管等位基因在系统发育上的差异如何,只要求其在核基因或 mtDNA等位基因频率具有显著差异即可, 适用于较短期限的管理。mtDNA控制区单倍型系统发育关系分析显示中国近海黑鲷群体之间并没有形成多个单系群, 因此可将中国近海黑鲷群体应视为 1个 ESUs。两两群体间的Fst值提示应将北方海域与南方海域的黑鲷群体作为2个MUs进行管理。
由于采样范围的限制, 上述研究结果不能排除未采样地区黑鲷群体存在新的ESUs或Mus的可能。另外由于线粒体基因与核基因有着不同的进化特点,有必要进一步采取SSR, AFLP等分子标记技术分析黑鲷群体遗传多样性与遗传结构, 为黑鲷资源的保护和开发利用提供更详尽的信息。
[1]朱德芬. 黑鲷生物学特性及增养殖概况[J]. 水产养殖, 1996, 1:30-32.
[2]Utter F M. Biochemical genetics and fishery management:an historical perspective [J]. J Fish Bio, 1991, 39:1-20.
[3]Jean C T, Lee S C, Chen C T,et al. Variation in mitochondrial DNA sequences of black porgy,Acanthopagrus schlegeli, in the coastalwaters of Taiwan [J]. Zool Stud, 1998, 37 (1):22-30.
[4]杨慧荣, 江世贵, 周发林, 等. 3个不同地理群体黑鲷遗传变异的 RAPD分析[J]. 中国水产科学, 2004,11(3):185-189.
[5]龚金波, 苏天凤, 夏军红, 等. 中国近海黑鲷线粒体DNA控制区序列多态性分析[J]. 南方水产, 2006,2(4):24-30.
[6]Avise J C. Mitchondrial DNA and the evolutionary genetics of higher animals[J]. Philos Trans R Soc Lond B Biol Sci, 1986, 312:325-342.
[7]Aquaro C F, Greenberg B D. Human mitochanodrial DNA variation and evolution:Analysis of nucleotide sequences from seven individuals[J]. Gentics, 1983,103:287-312.
[8]龚金波. 中国近海两种鲷科鱼类的遗传结构及遗传多样性分析[D]. 武汉:华中农业大学, 2006, 13-36.
[9]韩志强. 三种海洋鱼类分子系统地理学研究[D]. 青岛:中国海洋大学, 2008, 16-31.
[10]Liu J X, Gao T X, Wu S F,et al. Pleistocene isolation in the Northwestern Pacific marginal seas and limited dispersal in a marine fish,Chelon haematocheilus(Temminck & Schlegel, 1845) [J]. Molecular Ecology, 2007, 16:275-288.
[11]Liu J X, Gao T X, Yokogawa K,et al. Differential population structuring and demographic history of two closely related fish species, Japanese sea bass (Lateolabraxjaponicus) and spotted sea bass (Lateolabrax maculatus) in Northwestern Pacific[J]. Molecular Phylogenetics and Evolution, 2006, 39:799-811.
[12]孙海平. 中国近海区域海洋[M]. 北京:海洋出版社,2006. 97-98.
[13]陈艺燕, 章群, 任岗, 等. 10种石斑鱼系统发育的线粒体细胞色素 b基因序列分析[J]. 海洋科学, 2006,30(6):12-34.
[14]Rogers A R, Harpending H.Population growth makes waves in the distribution of pairwise genetic differences[J]. Mol Biol Evol, 1992, 9:552-569.
[15]Meyer A. Evolution of Mitochondria DNA in Fishes[A].Hochachka P W, Mommsen T P.Biochemistry and Molecular Biology of Fishes(Vol 2)[C]. New York:Elsevier, 1993, 1-38.
[16]Wright S. Evolution and the Genetics of Population:Variability within and among Natural Population[M].Chicago:University of Chicago Press, 1978, 79-103.
[17]Tajima F. Statistical method for testing the neutral mutation hypothesis by DNA polymorphism[J]. Genetics,1989, 123:585-595.
[18]Fu Y X. Statistical tests of neutrality of mutations against population growth,hitchhiking and background selection[J]. Genetics, 1997, 147:915-925.
[19]Kimura M, Crow J F. The number of alleles that can be maintained in a finite population[J]. Genetics,1964, 49:725-738.
[20]Grant W S, Bowen B W. Shallow population histories in deep evolutionary lineages of marine fishes:insights from sardines and anchovies and lessons for conservation[J]. The Journal of Heredity, 1998, 89:415-426.
[21]Wang P X. Response of western pacific marginal seas to glacial cycles:paleoceangraphic and sedimentological features[J]. Mar Geol, 1999, 156:5-39.
[22]Hewitt G M.The genetic legacy of the quaternary ice ages[J]. Nature, 2000, 405:907-913.
[23]Strathmann R R,Hughes T P,Kuris A M,et al. Evolution of local recruitment and its consequences for marine populations [J]. Bulletin of Marine Science, 2002, 70:377-396.
[24]江世贵, 李加儿, 区又君, 等. 四种鲷科鱼类的精子激活条件与其生态习性的关系[J]. 生态学报, 2000,20(3):468-473.
[25]Moritz C. Defining ‘evolutionarily significant units’ for conservation[J]. Trends Ecol Evol, 1994, 9:373-375.
Genetic variation among 5 stocks ofAcanthopagrus schlegeliin China’s coastal waters
ZHAO Shuang, ZHANG Qun, YUE Xiao-liang, PENG Bo, XU Zhong-neng, WEI Gui-feng, LI Gui-sheng
(Institute of Hydrobiology, Jinan University, Key Laboratory for Water Eutrophication and Redtide Control,Department of Education of Guangdong Province, Guangzhou 510632, China)
Oct. ,27, 2009
Acanthopagrus schlegeli;mtDNA control region; genetic diversity; stock genetic structure; demographic history
Acanthopagrus schlegeliis an economically important marine fish endemic in East Asia, and natural resource had been reduced dramatically. To protect and exploit the valuable fish effectively, 722 bp at the 5’ of mitochondrial DNA control region of 50 individuals collected in Yingkou(YK), Laoshan(LSH), Dayawan (DYW),Dongxing(DX) were sequenced to analyze the genetic diversity and population genetic structure ofAcanthopagrus schlegeliin the coastal waters of China. Total 42 hapoltypes and 56 variable sites were detected. Genetic diversity analyses showed high levels of haplotype diversity (h:0.978~1.000) and low levels of nucleotide diversity(π:0.0067~0.0116) inA.schlegeli. The demographic history was examined by using neutrality tests and mismatch distribution analysis, which indicated a Pleistocene population expansion at about 165 000-41 000years. Climatic oscillations during the Pleistocene ice ages might have had an important impact on this species. In the Neighbor-Joining tree (NJ tree) based on Kimura 2-parameter distances, neither obvious genealogical nor geographic clusters were found. Although pair-wise comparisons ofFstindicated that there was no geographic divergence among southern FQ-DYW-DX stocks,as well as between northern YK and LSH stocks, significant geographic divergences were found between the two groups. The genetic divergences between northern and southern populations might partly be due to the different breeding seasons of different populations and seasonal changes of China coastal currents. Two Management Units (MUs) were recognized on the basis of the populations ofA.schlegeliin the coast of China.
Q173 文献标识码:A 文章编号:1000-3096(2010)02-0075-05
2009-10-27;
2009-12-01
国家自然科学基金资助项目(30770415); 留学归国人员科研启动基金资助项目(2005)
赵爽(1980-), 男, 湖南浏阳人, 硕士, 主要从事分子生态学研究; 章群, 通信作者, 电话:020-85220239, E-mail:tqzhang@jnu.edu.cn
谭雪静)

