超声波辅助提取RP-HPLC法测定浒苔中的叶绿素a、b
程红艳, 陈军辉, 张道来, 赵恒强, 郑 立, 臧家业, 王小如,2
(1. 国家海洋局 第一海洋研究所 海洋生态研究中心, 山东 青岛266061; 2.厦门大学 化学化工学院 化学系,福建 厦门 361005)
超声波辅助提取RP-HPLC法测定浒苔中的叶绿素a、b
程红艳1, 陈军辉1, 张道来1, 赵恒强1, 郑 立1, 臧家业1, 王小如1,2
(1. 国家海洋局 第一海洋研究所 海洋生态研究中心, 山东 青岛266061; 2.厦门大学 化学化工学院 化学系,福建 厦门 361005)
建立了一种反相高效液相色谱法(RP-HPLC)测定浒苔(Enteromorpha prolifera)中叶绿素a和b含量。采用的色谱条件:Diamonsil-C18(4.6 mm×150 mm)柱, 流动相为甲醇(含0.2%的乙酸)和丙酮, 梯度洗脱, 流速为0.8 mL/min, 进样量10 μL, 检测波长430 nm。在此条件下, 叶绿素a和叶绿素b与浒苔中的其他化合物分离良好, 叶绿素a、b质量浓度为0.50~500 mg/L具有良好的线性关系(R2=0.999 9),能对浒苔提取液中的叶绿素a、b进行准确定量。
浒苔(Enteromorpha prolifera); 叶绿素; 高效液相色谱法
随着经济的发展, 人民生活水平的提高和健康保健意识的增强, 人们对食品的营养价值和标准提出了更高的要求。由于天然色素不但无害无毒, 还具有食品本身的色泽, 促进食欲, 增加消化液的分泌,对人体有医疗和保健作用。因此寻找和开发天然色素已成为食用色素发展的必然趋势。叶绿素是绿色植物中广泛存在的一类脂溶性色素, 其结构与人类和大多数动物体内血液中红色素结构及其相似, 在某种意义上讲, 也是维持生命不可缺少的物质, 具有抗突变、促愈创伤、抗变应性、降低胆固醇、改善便秘等作用[1]。因此天然叶绿素的开发具有广阔的前景。
海洋植物中叶绿素和其他辅助色素的含量高于陆生植物, 而且海洋植物生长快、产量大, 是天然叶绿素开发的良好原料[2]。浒苔作为海洋中的藻类植物,可以作为开发天然叶绿素的资源之一。然而目前国内还没有关于绿潮藻浒苔中最主要的叶绿素a、b含量测定的报道, 也缺乏浒苔中叶绿素 a、b快速测定的有效方法。叶绿素的测试方法主要有三类, 分别是分光光度法、荧光法和高效液相色谱法(HPLC)[3]。其中 HPLC法能对色素粗提物中的叶绿素单体及其衍生物分离, 是目前叶绿素单体准确测定最有效的方法[4]。吴振斌等[5]发展了微囊藻中叶绿素-a、β-胡萝卜素及脱镁叶绿酸-a同步测定的 HPLC法, 戴荣继等[6]采用HPLC法对饮用水中藻类叶绿素a、b的含量进行了测定, Huang等[7]采用高效液相色谱-质谱法对绞股蓝中的叶绿素及其衍生物进行了分析测定,而采用HPLC法测定绿潮藻浒苔中叶绿素a、b的研究未见报道。本研究首次采用现代提取技术——超声波辅助提取法对浒苔中的叶绿素进行高效快速提取,通过对色谱条件的系统优化,建立了适用于绿潮藻浒苔中叶绿素a、b快速测定的RP-HPLC法。
1 实验部分
1.1 主要仪器、试剂与原料
Agilent 1200高效液相色谱仪, 配有二极管阵列检测器(DAD)、自动进样器、四元梯度泵等(美国Agilent公司); KQ-400KDE 型高功率数控超声波仪(昆山市超声仪器有限公司); R201 型旋转蒸发仪(上海申生科技有限公司); FA1104型电子天平(上海精天电子仪器厂); Milli-Q(18.2 MΩ) 超纯水处理系统(美国 Millipore 公司)。
Diamonsil-C18色谱柱 (4.6 mm×150 mm, 5 μm,中国 Dikma); Zorbax Bonus-RP C18色谱柱 (4.6 mm×250 mm, 5 μm), Extend-C18色谱柱 (4.6 mm ×200 mm, 5 μm), Eclipse XDB-C18(4.6 mm×150 mm, 5 μm)皆为美国Agilent公司生产。
甲醇、乙腈、乙酸、丙酮(Merck, 色谱纯), 及其他试剂均为国产分析纯; 叶绿素 a、b标准品(美国Fluka公司, 纯度为95%); 实验中所用溶液均用超纯水配制, HPLC用所有试剂均经过0.45 μm微孔滤膜过滤及超声脱气处理。浒苔样品为2008年7月份采自青岛近岸, 在超低温冰箱中冷冻保存。
1.2 色谱条件
迪马 Diamonsil-C18(4.6 mm×150 mm, 5 μm)色谱柱; 流动相为:甲醇含有 0.2% 乙酸(A), 丙酮(B),梯度洗脱程序见表1, 柱温 25℃, 流速 0.8 mL/min, DAD 430 nm检测, 进样量为10 μL。
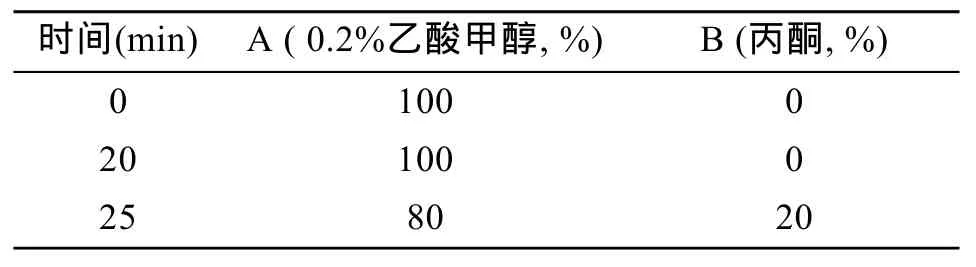
表1 流动相的梯度洗脱程序Tab. 1 Gradient program of mobile phase
1.3 标准溶液的配制
分别取叶绿素a、b标准品(1.0 mg包装), 置于10 mL容量瓶中, 用色谱纯甲醇定容至10 mL得到浓度为100 mg/L的叶绿素a、叶绿素b标准储备液, 取少量标准品储备液稀释至合适浓度, 并配制混合标准品溶液, 用于色谱条件的优化和标准曲线的绘制,标准品储备液密封后置于超低温冰箱中冷冻保存。
1.4 供试品溶液的制备
平行精密称取6份新鲜浒苔样品各0.1 g, 其中3份置于15 mL玻璃离心管中, 加入5 mL甲醇, 超声波提取5 min, 用0.45 μm微孔滤膜过滤, 置于棕色进样瓶中, 待测。另外3份置于玻璃表面皿, 然后置于干燥箱中, 在60℃条件下烘干至恒质量。
2 结果与讨论
2.1 色谱条件的选择
据文献报道[4~7], 反相HPLC技术较常用于叶绿素的分析测定, 而甲醇-水-丙酮以及甲醇-丙酮混合液多作为分离叶绿素的流动相; 考虑到叶绿素是一种极性较小、易于被反相柱保留的化合物, 而浒苔粗提物所含的化合物又较为复杂, 因此以不同比例的甲醇-丙酮混合液为流动相, 对 4根不同特点的反相C18柱进行了比较优化, 结果发现, 不同特点的色谱柱对浒苔中叶绿素及其衍生物的分离结果差异较大(特别是浒苔中叶绿素部分降解后生成了系列叶绿素衍生物), 4根色谱柱当中迪马公司的 Diamonsil-C18所获得的分离结果最为理想(各峰分离度高, 峰型对称), 这就说明在浒苔中叶绿素及其衍生物的 HPLC分析中, 选择合适的色谱柱是非常关键的。
在选定色谱柱之后, 对以甲醇-丙酮以及甲醇-水-丙酮为流动相进行了比较, 结果表明以甲醇-丙酮为流动相时分离效果较好; 据文献报道[4], 流动相中添加一定量的酸或缓冲盐可以改善叶绿素及其衍生物的峰型及分离效果, 在本研究中分别将 0.2%磷酸、0.2%乙酸、5 mmol/L乙酸氨、5 mmol/L磷酸盐加入流动相中, 结果显示, 流动相中添加 0.2%的乙酸能获得理想的分离结果, 并且使用乙酸配制流动相简单方便、不损坏柱子和仪器硬件, 乙酸具有挥发性与质谱检测器兼容, 利于液相色谱-质谱联用分析叶绿素方法的开发。
叶绿素在可见光区有较强的特征吸收峰, 但是叶绿素a和b的最大吸收波长不同, 为了使叶绿素a和b均能获得较高的灵敏度, 本研究通过DAD全波段扫描(400~800 nm), 考察了不同检测波长对叶绿素a、b测定灵敏度的影响(图1), 结果表明430 nm为检测波长时, 叶绿素a、b检测的灵敏度均较高, 并且能排除其他化合物的干扰, 与文献[8]的结果一致,因此, 选择430 nm作为浒苔中叶绿素a、b同步测定的最佳检测波长。
作者主要根据标准品的保留时间对叶绿素a和b的色谱峰定性, 将样品测定色谱图与标准品色谱图进行比较, 以确定叶绿素a和b的相应峰位。此外,实验中还分别以适量的标准溶液加入样品溶液中同步分析, 通过对比各峰的峰面积值, 进一步确认峰面积明显增大的峰为叶绿素a和b峰。按1.2色谱条件测定对照品溶液和供试品溶液, 色谱图如图2所示, 比较图2 A和B可知, 在选定的色谱条件下叶绿素a、b色谱峰对称性好, 与其他组分达到基线分离,可准确测定其峰面积, 并以峰面积进行定量分析。
2.2 超声波辅助提取条件的优化
超声波辅助提取是利用超声场强化提取天然产物中目标化合物的现代提取方法, 其原理[9]是:存在于物质中的微气核(空化核)在超声场的作用下产生振动、生长和崩溃的过程(即超声空化效应), 从而产生局部的高温高压, 增强物质在溶剂中的溶解能力。采用超声波辅助提取法提取叶绿素的研究已有报道[10,11],均获得了较为理想的提取效率, 但未见用于浒苔叶绿素的提取。在本研究中选用丙酮为提取剂, 将超声提取法与冷浸法、回流法、索氏提取法进行了比较,结果表明超声辅助提取法方便、快捷(处理一个样品仅需5 min)、提取效率高、便于操作, 是最佳提取方法。由于叶绿素不溶于水, 易溶于醇、丙酮等有机溶剂, 在本实验中应用超声提取法, 比较了甲醇、乙醇、丙酮、乙醇-丙酮(v/v=50:50)及甲醇-丙酮(v/v=50:50)作为提取液的提取效果, 结果表明, 上述几种溶剂为提取溶剂时新鲜浒苔中的叶绿素a、b均能得到充分提取, 由于采用甲醇做提取溶剂时利于后续色谱分析, 可以简化样品前处理过程, 所以选择甲醇为提取溶剂。对提取溶剂用量、不同提取时间的提取效果进行了比较, 结果表明, 称取 0.1 g鲜浒苔,以5 mL甲醇超声提取5 min为宜。超声提取过程中,温度发生一定波动, 经考察对实验基本没有影响,故提取过程中无需严格控温。在以上最佳条件下, 提取一次即可获得 99%以上的目标化合物, 故无需多次提取。
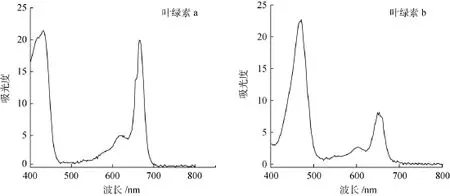
图1 叶绿素a、b的DAD扫描光谱图Fig. 1 The DAD scan spectrums of chlorophyll a and chlorophyll b

图2 叶绿素a、b混合标准品(A)及浒苔提取液(B)高效液相色谱图Fig. 2 HPLC chromatograms of mix standards for chlorophyll a, b (A) and the extract of Enteromorpha prolifera (B)
2.3 试验方法考察
2.3.1 标准曲线的绘制及检出限
本研究采用外标法对浒苔中叶绿素 a和 b进行定量, 用峰面积对质量做工作曲线, 由试样峰面积求出其实际含量。按1.2所述的色谱条件, 取叶绿素a和b的混合标准液(质量浓度均为50 mg/L)分别进样 0.1、0.2、0.4、1.0、4.0、10、40、100 μL, 以测定的峰面积为纵坐标, 标准品的质量(μg)为横坐标绘制标准曲线, 得线性回归方程分别为:
叶绿素a的标准曲线方程为:y=5 373.3x-21.775 1,R2=0.999 9
叶绿素b的标准曲线方程为:y=4 903x-117.15,R2=0.999 9
说明本方法测定叶绿素 a和 b均在 0.50 ~500 mg/L范围内线性关系良好。将标准溶液逐级稀释进样, 测其峰高响应值及基线噪音强度, 以3倍信噪比计算检出限。检测波长为430 nm时绿素a和b的检测限分别为 0.25 μg /L 和 0.75 μg/L。
2.3.2 精密度
按1.2所述的色谱条件, 取1份供试品溶液, 重复测定5次(进样量为10 μL), 记录各次的峰面积和保留时间, 叶绿素 a和 b峰面积的 RSD值分别为1.23%和2.34%, 保留时间的RSD值分别为0.42%和0.38%, 这表明仪器的精密度良好。
2.3.3 重复性
精密称取同一样品5份, 按1.4处理方法将其制成供试品溶液, 按1.2液相色谱条件, 分别进样测定,测得叶绿素a和b的峰面积和保留时间, 计算其相对标准偏差, 叶绿素 a和 b峰面积的 RSD值分别为5.02%和5.46%, 保留时间的RSD值分别为 0.49%和0.41%, 表明该方法重复性良好。
2.3.4 稳定性
由于叶绿素稳定性较差, 本研究对浒苔甲醇提取液中叶绿素a、b的稳定性进行了系统考察, 按1.4处理方法制备供试品溶液, 制备完成后立即按1.2液相色谱条件, 分别在0、0.5、1、1.5、2、2.5、3、8、16、24 h进样测定, 结果显示浒苔甲醇提取液叶绿素a、b峰面积在3 h内均无明显变化, 峰面积的减小率均小于5.00%, 但是8 h之后进行测定(样品瓶一直放在HPLC色谱仪上, 室温), 叶绿素a和b的峰面积明显减小, 而24 h之后的测定结果显示, 叶绿素b几乎完全降解。以上结果表明, 浒苔提取液中的叶绿素a、b在3 h内其化学性质稳定, 为了获得准确的测定结果, 样品制备完成后, 尽量在3 h以内完成HPLC测定。
2.3.5 回收率
精密称取已知叶绿素a、b含量的同一浒苔样品3份, 分别加入一定量的叶绿素a和b标准品溶液(放置30 min), 然后按1.4供试品溶液的制备方法处理,用1.2所述色谱条件测定加样回收率, 结果见表2。由表2结果可以看出, 该方法回收率较高, 进一步说明本方法可用于浒苔样品中绿素a、b含量的测定。

表2 浒苔叶绿素a和b加样回收率实验结果(n=3)Tab. 2 Results for recovery of chlorophyll a and chlorophyll b(n=3)
2.4 浒苔样品中叶绿素a和b的含量测定
取 5个不同采集地点的浒苔样品, 每个样品取质量相等的6份, 按1.4所述处理方法将其中3份样品制备成供试品溶液, 另外3份浒苔样品经干燥箱烘干, 称质量, 得出每份浒苔样品的干质量, 用以计算浒苔中叶绿素a和b的实际含量。按1.2所述仪器条件测定供试品溶液, 将测得的峰面积代入2.3所得出的回归方程,计算单位质量干浒苔中叶绿素a和b的含量, 5个不同采集地点浒苔样品中叶绿素a和b的测定结果见表3。
由表3的数据结果可以看出, 浒苔中叶绿素a和b的含量占浒苔干质量的1%左右, 而浒苔中叶绿素a和叶绿素b的含量比约为3:1, 表明新鲜浒苔中的绿色素以叶绿素 a为主; 此外, 由图2B可以看出, 浒苔提取物中除了含有丰富的叶绿素 a、b之外, 还含有一系列叶绿素衍生物(与叶绿素a具有相似的可见光吸收图谱), 进一步表明浒苔中含有丰富的天然叶绿素, 至于这一系列衍生物分别是什么化合物, 有待采用液质联用技术进行分析鉴别。
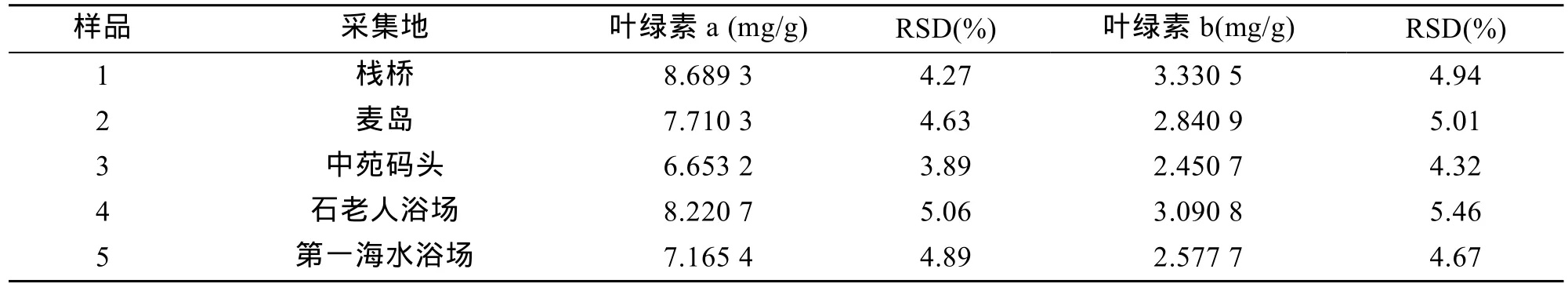
表3 浒苔样品中叶绿素a和b的含量(n=3)Tab. 3 Contents of chlorophyll a and chlorophyll b in different Enteromorpha prolifera(n=3)
3 结论
本研究所发展的超声波辅助快速提取RP-HPLC测定浒苔中叶绿素a和b含量的方法, 样品前处理简便易操作、提取效率高; 在选定的色谱条件下, 叶绿素a和b分离度高, 方法重复性好、回收率高, 可作为浒苔中叶绿素 a和 b含量快速测定的有效方法。浒苔中含有丰富的天然叶绿素, 说明浒苔是天然叶绿素开发的良好原料, 为绿潮藻浒苔资源化利用提供了科学依据。
[1]蔡秋声.叶绿素及其衍生物的特性和生理功能[J].粮食与油脂, 1997, 3:38-40.
[2]谌素华, 王维民, 蔡清.绿藻石莼叶绿素提取工艺的研究[J].食品科技, 2008, 2:172-175.
[3]丛海兵, 黄廷林, 周真明, 等.藻类叶绿素测试新方法[J].给水排水, 2007, 33(6):28-32.
[4]Almela L, Fernandez-Lopez J A, Roca M J. High-performance liquid chromatographic screening of chlorophyll derivatives produced during fruit storage[J]. Journal of Chromatography A, 2000, 870:483-489.
[5]吴振斌, 张兵之, 张丽萍, 等.叶绿素-a、β-胡萝卜素及脱镁叶绿酸-a的高效液相色谱检测[J].分析化学,2006, 34(9):1 359-1364.
[6]戴荣继, 佟斌, 黄春, 等.HPLC 测定饮用水中藻类叶绿素含量[J].北京理工大学学报, 2006, 26(1):87-89.
[7]Huang S C,Hung C F,Wu W B,et al.Determination of chlorophylls and their derivatives inGynostemma pentaphyllumMakino by liquid chromatography–mass spectrometry[J]. Journal of Pharmaceutical and Biomedical Analysis, 2008, 48:105-112.
[8]Koca N, Karadeniz F, Burdurlu HS. Effect of pH on chlorophyll degradation and color loss in blanched green peas [J]. Food Chemistry, 2006, 100:609-615.
[9]郭孝武.一种提取中草药化学成分的方法——超声提取法[J]. 天然产物研究与开发, 1999, 11(3):37-40.
[10]张静平.超声波辅助提取毛竹叶中叶绿素的研究[J].资源开发与市场, 2008, 24(6):488-489.
[11]郭艳华, 匡毅.超声波法制取叶绿素铜钠盐的工艺研究[J].江汉大学学报(自然科学版), 2007, 35(4):41-43.
Determination of chlorophyll a and chlorophyll b inEnteromorpha proliferaby ultrasound-assisted extraction with RP-HPLC
CHENG Hong-yan1, CHEN Jun-hui1, ZHANG Dao-lai1, ZHAO Heng-qiang1,ZHENG Li1, ZANG Jia-ye1, WANG Xiao-ru1,2
(1. Research Center for Marine Ecology, First Institute Oceanography of SOA, Qingdao 266061,China; 2. College of Chemistry and Chemical Engineering, Xiamen University, Xiamen 361005,China)
Mar. ,12, 2009
Enteromorpha prolifera; Chlorophyll; HPLC
A convenient and user-friendly reverse phase-high performance liquid chromatography (RP-HPLC)analysis method was established for the determination of chlorophyll a and chlorophyll b inEnteromorpha prolifera.The following HPLC conditions are follows:Diamonsil-C18(4.6 mm×150 mm) column is used; MeOH-0.2% acetic acid and acetone as the mobile phase with linear gradient elution are used; flow-rate is 0.8 mL/min, detection length of Vis is 430 nm; injection volume is 10 μL. The results indicated that the developed method can be used for the determination of chlorophyll a and b inE. proliferawith a good resolution and linearity between 0.50~500 mg/L(R2=0.999 9).The method is specific, simple, fast, sensitive and feasible for the determination of chlorophyll a and chlorophyll b, which can eliminate the interference of chlorophyll derivatives inE. prolifera.
Q503; O657.7+2 文献标识码:A 文章编号:1000-3096(2010)02-0023-05
2009-03-12;
2009-07-25
国家自然科学基金项目 (20905017, 20602009); 海洋公益性行业科研专项项目(200705011, 200805039); 国家海洋局 第一海洋研究所基本科研业务专项项目(GY-022008T32, GY-022008G47)
程红艳(1983-), 女, 山东济宁人, 硕士研究生, 主要从事海洋天然产物化学研究, E-mail:chenghongyan710@163.com; 陈军辉, 通信作者, 电话:0532-88966705, E-mail:jhchen@fio.org.cn
康亦兼)

