高岭土对Fe2+的吸附及其对高岭土中Fe3+生物还原的影响研究
黄晓晨,许旭萍*,林玉满,李金凤,陈祖亮
(1.福建师范大学生命科学学院,福建福州 350108;2.福建师范大学化学与材料学院,福建福州 350007)
高岭土是一种用途十分广泛的非金属矿物,被广泛地应用于陶瓷、建筑生产、核废物处理、造纸以及化妆品等行业[1]。但是高岭土中一般都含有铁矿物等杂质,这些杂质会影响高岭土白度从而影响其商业价值和产品的耐溶性[2]。因此需要去除高岭土中的含铁杂质,以提高高岭土的性能。许多物理和化学提纯法如泡沫浮集法、高梯度磁选法、选择性絮凝法以及化学去除法等能够有效地从高岭土中去除Fe3+[3-5]。但是,这些方法除铁普遍存在着能量消耗大、操作成本高和造成环境污染等缺点[6],而利用微生物还原铁离子的生物学方法是一种具有发展前景的高岭土脱铁新方法[7-8]。在高岭土微生物除铁过程中,众多因素影响微生物的活性及高岭土表面的铁位点的活性从而使铁还原效率降低[9]。因此需要将高岭土对Fe2+的吸附以及微生物对Fe2+的吸附进行研究,从而了解高岭土表面Fe3+位点以及生物活性对高岭土中Fe3+生物还原的影响。
1 材料与方法
1.1 材料
1.1.1 高岭土 实验所用的高岭土为福建龙岩高岭土公司提供。高岭土粒径为46μm,水洗325目,其中Fe3+的含量为6.16 mg/g高岭土。主要成分见表1。

表1 高岭土主要成分Table 1 Components of kaolin
1.1.2 主要试剂 盐酸羟胺,Fe2O3,葡萄糖,结晶乙酸钠,邻菲啰啉,冰乙酸,硫酸,NaOH,硫酸亚铁铵,牛肉膏,蛋白胨,NaCl。
1.1.3 微生物以及培养基 实验所用的微生物分离自福建龙岩高岭土公司提供的泥浆样品。将含有铁还原微生物的25 g泥浆样品加入100 mL含有葡萄糖10 g/L以及Fe2O30.01 g/L的培养基中。向锥形瓶内充氮气,瓶口用橡胶塞密封,在橡胶塞上插一只注射器收集产生的气体,将锥形瓶置于生化培养箱内恒温培养。待注射器收集到了足够的气体表明富集了一定的微生物。所获得的铁还原菌的混合菌种,经过16S rRNA测序鉴定为蜡状芽胞杆菌(Bacillus cereus)、球状芽胞杆菌(Lysinibacillus sphaericus/B acillus sphaericus)、蕈状芽胞杆菌(B acillusm ycoides)3种混合。取5 mL的菌液接种到100 mL LB培养基中,经培养即为实验用的铁还原菌菌液。LB培养基的成分为:蛋白胨10 g/L,NaCl 5 g/L,牛肉膏5 g/L。
1.2 方法
1.2.1 铁的测定 采用邻菲啰啉分光光度法[10]测定溶液中Fe2+。取样品3 mL,经3 500 r/min离心5 min,吸取一定量的上清液至25 mL的比色管中。加入盐酸羟胺1 mL、NaAc-HAc缓冲溶液5 mL、邻菲啰啉2 mL,加水至刻线,摇匀。显色10~15 min后,在510 nm波长处测量吸光度,根据工作曲线计算出高岭土中铁的去除量。
1.2.2 高岭土吸附Fe2+试验 称取一定量高岭土于锥形瓶中,加入一定量的Fe2+溶液,并用一定浓度的HNO3或NaOH调节pH,用1.2.1中的方法测定溶液中Fe2+的初始浓度C0,置于摇床上,在30℃的条件下振荡至吸附达到平衡,再用离心机对溶液进行离心,取上清液用1.2.1中的方法测定Fe2+的残余浓度C,按下面的公式计算吸附量q(mg/g)。
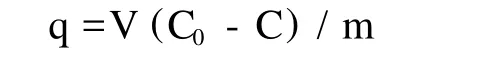
式中:V为Fe2+溶液的体积(mL);m为高岭土的用量(g);C0和C为吸附前后Fe2+离子的浓度(mg/L)。
1.2.3 微生物吸附Fe2+的试验 一定浓度的Fe2+溶液中加入一定数量的铁还原菌,其他步骤与1.2.2一样,按下面的公式计算吸附量q(mg)。
1.2.4 Fe2+对高岭土中Fe3+的生物还原的影响研究 将1.1.3中的菌液接入新鲜的LB培养液中,置30℃培养箱内振荡培养24 h,此培养液经离心,收集菌体。在菌体中加入无菌水调节至所需的菌数。并以定量的菌体作为以后的高岭土除铁的接种菌。取高岭土、碳源和水按不同的试验条件装入锥形瓶中,灭菌后,加入菌液30℃恒温厌氧培养。定时取上清液测定溶液中的Fe2+浓度,得到Fe3+去除量随时间的变化结果,了解Fe2+对微生物还原高岭土中Fe3+的影响。
1.2.5 动力学模型拟合Fe2+及温度对高岭土中Fe3+的生物还原特征 异化铁还原是微生物介导的生物学过程,与微生物的生长密切相关,可用描述微生物生长动力学的Logistic方程对不同处理的Fe3+还原过程中,Fe2+累积浓度和时间的关系进行拟合[11]。用Curve expert 1.3软件进行拟合分析。Logistic方程的表达式为:
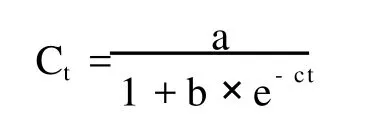
式中,Ct为不同时刻的Fe3+的浓度;t为反应时间;a、b、c均为参数。通过方程拟合,可求出Fe3+还原的最大潜势,即Fe2+的最大累积量(数值等于参数a),反应速率常数(数值等于参数c),Fe3+最大还原速率(Vmax)(数值等于0.25 ac)和最大还原速率对应的时间(Tvmax)(数值为lnb/c),R表示相关度系数。
2 结果与讨论
2.1 高岭土吸附Fe2+的影响因素
2.1.1 pH对高岭土吸附Fe2+的影响 高岭土对重金属的吸附大致都分为2个阶段,第1个阶段为快速过程,大约10~20 min;第2个阶段为慢速过程。随着时间的增加,吸附速率减缓,直至达到吸附平衡,平衡时间为30~60 min[12]。将一系列装有40 mL高岭土悬液(其中高岭土量为0.5 g,Fe2+的初始浓度为40 mg/L),pH分别为3、4、5、6和7的锥形瓶,置于30℃,150 r/min条件下振荡吸附1 h,结果见图1。
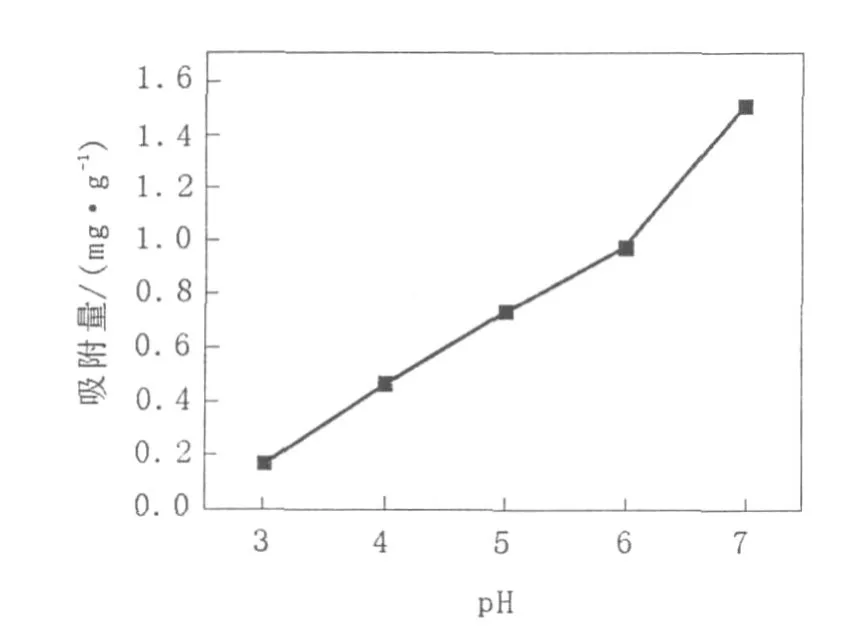
图1 pH对高岭土吸附Fe2+的影响Fig.1 Effect of pH on the adsorption of Fe2+on kaolin
由图1可知,高岭土对Fe2+的吸附量随着pH的增大而增加。在pH较小时,高岭土对Fe2+的吸附量较小,这是因为H+与Fe2+竞争吸附高岭土,从而影响了高岭土对Fe2+的吸附性能。而当pH>6时,Fe2+容易与OH-形成沉淀而黏附在高岭土表面,吸附量比较高[13]。所以,Fe2+最易被吸附的pH范围为6~7,在pH为7时高岭土对Fe2+的吸附量达到1.51 mg/g。
2.1.2 高岭土量对高岭土吸附Fe2+的影响 将一系列装有40 mL高岭土悬液(其中高岭土量分别为0.1~0.5 g,pH为4.5,Fe2+的初始浓度为40 mg/L)的锥形瓶,置于30℃,150 r/min条件下振荡吸附1 h,结果见图2。

图2 高岭土量对高岭土吸附Fe2+的影响Fig.2 Effect of amount of kaolin on the adsorption of Fe2+on kaolin
由图2可以看出,随着高岭土用量的增加,高岭土对Fe2+的吸附量逐渐减少。这是由于高岭土浓度越大,越容易发生团聚,接触Fe2+的高岭土表面积减小,从而使高岭土对Fe2+的单位吸附量降低。当高岭土加入量为0.1 g时,吸附量为2.45 mg/g。
2.1.3 不同Fe2+浓度对高岭土吸附Fe2+的影响
将含高岭土量为0.5 g,Fe2+的初始浓度为10~50 mg/L的40 mL悬液,调节pH4.5,置于30℃,150 r/min振荡吸附1 h,结果见图3。
Fe2+初始浓度是影响高岭土吸附的另一重要因素。从图3可以看出,在不同初始浓度条件下吸附量不同,初始浓度在10~30 mg/L时吸附量随着浓度的增加而增加,在Fe2+初始浓度为30 mg/L时吸附量最大,Fe2+初始浓度超过30 mg/L时吸附量有所下降。当吸附达到饱和时,高岭土对Fe2+的吸附量保持不变,为0.60 mg/g。
2.1.4 温度对高岭土吸附Fe2+的影响 将一系列含高岭土量为0.5 g,Fe2+的初始浓度为20 mg/L的40 mL悬液,调节pH 4.5,分别置于20~40℃,150 r/min的条件下振荡吸附一定时间,结果见图4。
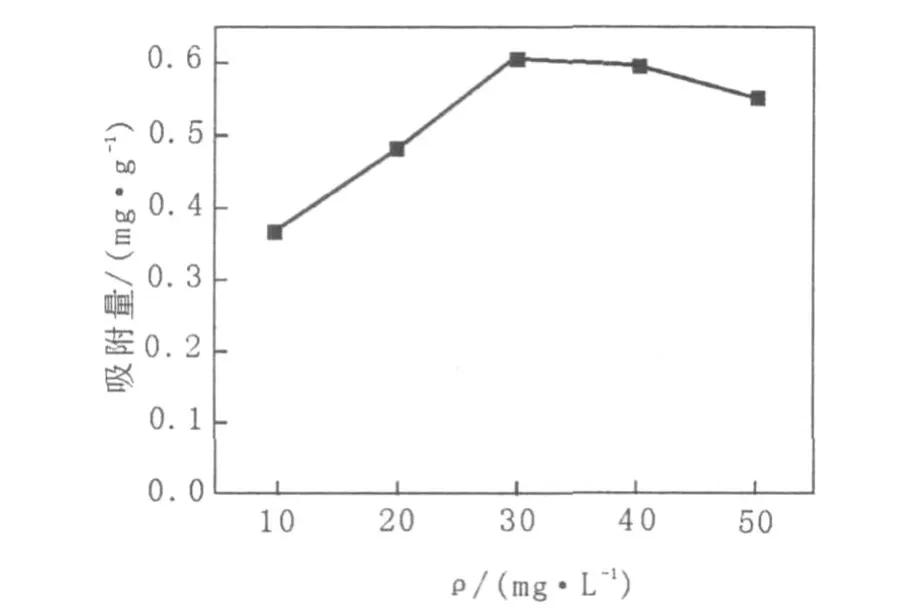
图3 初始Fe2+浓度对高岭土吸附Fe2+的影响Fig.3 Effect of initial Fe2+concentration on the adsorption of Fe2+on kaolin

图4 温度对高岭土吸附Fe2+的影响Fig.4 Effect of temperature on the adsorption of Fe2+on kaolin
从图4可以得出:高岭土对Fe2+的吸附量与温度有较大关系,在温度为20~40℃范围内,高岭土对Fe2+的吸附量随着温度的升高而增加,20℃时吸附量最低,40℃时吸附量最高。而且随着吸附时间的增加,吸附量也逐渐增加并趋于饱和。这可能是因为温度升高可使溶液中Fe2+运动速度加快[14],增加了Fe2+与高岭土接触和被吸附的机会。
2.2 接种量对微生物吸附Fe2+的影响
在含Fe2+初始浓度为20 mg/L,pH为4.5的40 mL高岭土悬液中,加入铁还原菌0.5×106~5×109个,置于30℃,150 r/min振荡吸附1 h,结果见图5。
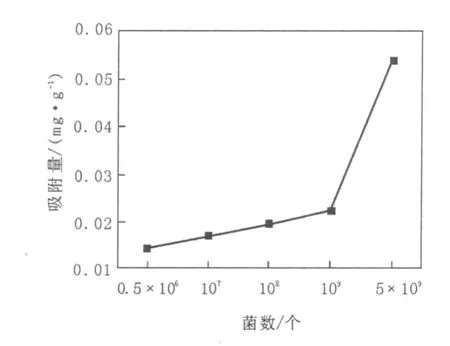
图5 接种量对微生物吸附Fe2+的影响Fig.5 Effect of inoculum density on the adsorption of Fe2+on microbial
由图5可以看出,铁还原菌对Fe2+有一定的吸附能力,随着菌数增加,对Fe2+的吸附量逐渐增加。铁还原菌吸附Fe2+可能是因为Fe2+是微生物生长所需的必须元素之一[11]。
2.3 Fe2+及温度对高岭土中Fe3+的生物还原特征
铁还原菌可以把高岭土中不溶的Fe3+还原成可溶的Fe2+,达到高岭土增白的目的。但是这个过程需要较长的时间,而且到了后期,高岭土中还有1/2的铁没有被铁还原菌所还原。对于该结果有2种解释:一是高岭土中的Fe3+处于晶格度高的状态而不能被微生物还原[15];二是高岭土被还原的过程中吸附了Fe2+,使其表面Fe3+位点被覆盖不能被微生物接触还原[9],同时铁还原菌吸附了Fe2+使菌体的还原活性下降[16]。通过设计6个实验来说明Fe2+及温度对高岭土中Fe3+的生物还原特征。①A1:取5 g高岭土、1 g葡萄糖和100 mL蒸馏水装入锥形瓶中,灭菌后,在洁净工作台中加入109个菌体,30℃恒温厌氧培养;②B2:取吸附Fe2+饱和的高岭土5 g、1 g葡萄糖和100 mL蒸馏水装入锥形瓶中,灭菌后,在洁净工作台中加入109个菌体,30℃恒温厌氧培养;③C3:取5 g高岭土、1 g葡萄糖和100 mL蒸馏水装入锥形瓶中,灭菌后,在洁净工作台中加入109个吸附Fe2+菌体,30℃恒温厌氧培养;④D4:取5 g增白后的高岭土(取A1反应后的土样经过洗涤,表面没有Fe2+)、1 g葡萄糖和100 mL蒸馏水装入锥形瓶中,灭菌后,在洁净工作台中加入109个菌体,30℃恒温厌氧培养;⑤E5:取5 g高岭土、1 g葡萄糖和100 mL蒸馏水装入锥形瓶中,灭菌后,在洁净工作台中加入109个菌体,20℃恒温厌氧培养;⑥F6:取5 g高岭土、1 g葡萄糖和100 mL蒸馏水装入锥形瓶中,灭菌后,在洁净工作台中加入109个菌体,40℃恒温厌氧培养。
Fe2+对高岭土中Fe3+生物还原的影响见图6,温度对高岭土中Fe3+生物还原的影响结果见图7。
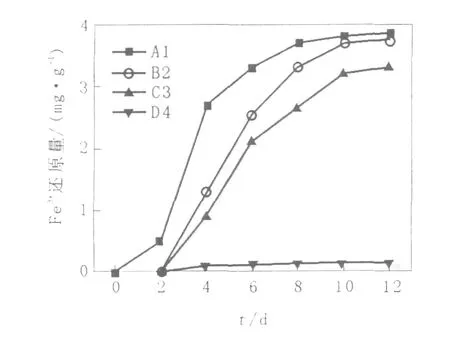
图6 Fe2+对高岭土中Fe3+生物还原的影响Fig.6 Effect of Fe2+on iron bioreduction in kaolin
由图6可知,与空白对照相比,Fe2+对高岭土Fe3+的生物还原以及微生物活性均有影响。从曲线A1可以看出,高岭土中Fe3+经铁还原菌还原达到平衡的时间是8 d,后期Fe2+的减少可能是由于少量Fe2+被高岭土吸附,导致高岭土表面的Fe3+位点被Fe2+覆盖,影响微生物与高岭土中的Fe3+接触,高岭土的Fe3+不能被微生物继续还原。从曲线B2可以看出,吸附过Fe2+的高岭土对高岭土中Fe3+的还原速率影响较大,达到平衡的时间需要10 d。从曲线C3可知,由于菌体吸附了Fe2+,其活性受到抑制,对高岭土铁的生物还原能力降低,使平衡时间达到了10 d,而且溶液中Fe2+量低于其他的平衡终点。从曲线D4可知,增白后的高岭土,由于经过洗涤处理,除去覆盖在其表面的Fe2+,当加入新鲜的菌液,高岭土中残留的Fe3+依然能够被微生物所还原,由此说明,高岭土表面吸附的Fe2+抑制了高岭土中Fe2+的生物可利用性。
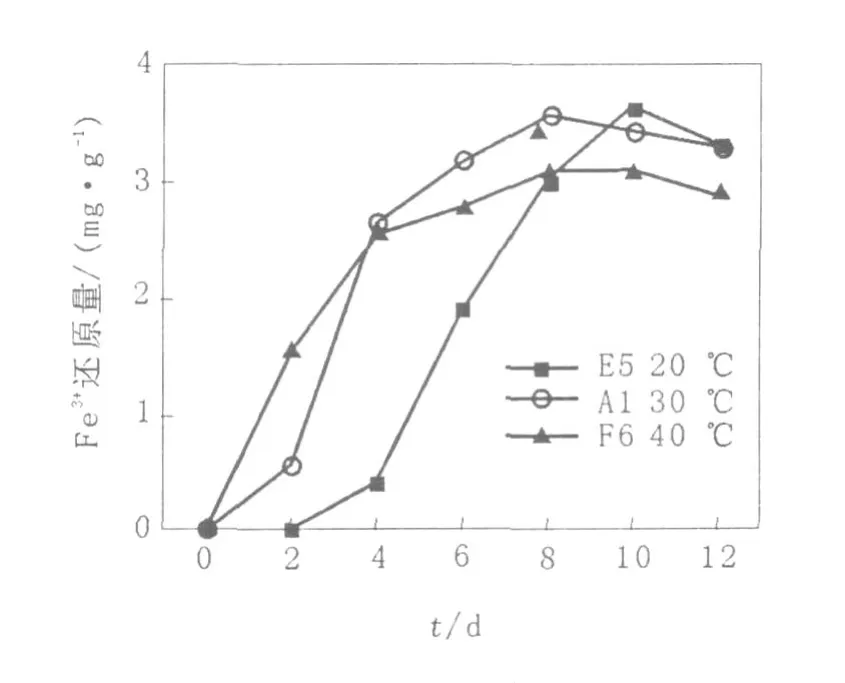
图7 温度对高岭土中Fe3+生物还原的影响Fig.7 Effect of temperature on iron bioreduction in kaolin
由图7可以看出,温度是影响微生物酶活性的一个重要因素。30℃是微生物还原高岭土中Fe3+的最佳温度,30℃时不仅达到平衡的时间最快,而且铁的还原量达到最大,为3.578 mg/g。而20℃达到平衡的速度最慢,40℃虽然能提高酶的催化效率,但可能后期生物活性降低,导致铁的还原量减少。
2.4 动力学模型拟合Fe2+及温度对高岭土中Fe3+的生物还原特征
为了能直接表征Fe2+对微生物还原Fe3+能力影响情况,进一步比较Fe2+对高岭土中Fe3+的生物还原特征,用Logistic方程对单位时间的Fe3+还原量进行拟合,结果见表2。
从表2可以看出,Logistic方程对单位时间Fe3+还原量拟合的吻合度较高,相关系数r均能达到0.99以上,说明采用这个方程的参数可以较好地反映Fe2+对高岭土中Fe3+的生物还原特征。其中A1、B2所对应的最大还原速率Vmax分别为1.194 mg/(g·d)和0.763 mg/(g·d),出现最大反应速率的时间Tvmax分别为3.135 d和4.945 d,可知吸附Fe2+高岭土要比普通高岭土铁还原时间推迟1.7 d,这表明当高岭土吸附Fe2+以后其表面的Fe3+的活性位点被Fe2+覆盖,导致高岭土表面Fe3+的生物可利用性降低,从而使最大反应速率降低。C3还原的最大反应速率Vmax为0.604 mg/(g·d),出现最大反应速率的时间更晚,Tvmax为5.3 d。分析其原因可能是铁还原菌吸附Fe2+后,生物活性降低,生长受到抑制。从D4可以看出,经过洗涤增白后的高岭土加入新鲜的菌液,还原反应速率较慢,Vmax仅为0.050 mg/(g·d),Tvmax达到4.071 d。这是由于高岭土表面被还原的Fe2+吸附,减少了微生物与其表面Fe3+活性位点接触的机会,使还原速率降低。
由于高岭土中铁的微生物还原是一个酶的催化过程,因此不同温度对高岭土中铁的还原特征也不同。从温度对高岭土中Fe3+的生物还原动力学参数来看,20、30、40℃条件所对应的最大反应速率Vmax分别为0.92、1.194和0.955 mg/(g·d),在30℃时Vmax最高。这说明铁还原酶的最佳作用温度为30℃,在30℃下酶对铁的还原有良好的催化效果,因此最大反应速率最高。20、30、40℃条件所对应的Tvmax分别为6.152、3.135和2.359 d。20℃条件下反应时间最长,说明低温不利于酶的催化,使出现最大反应速率的时间延长。40℃条件下,Tvmax为2.359 d,比30℃快0.776 d,说明升高温度可能提高了酶的活性,使出现最大反应速率的时间提前。但由于升高温度使微生物的代谢增快,生物活力降低,导致铁还原能力下降。这些结论与已有的报道一致[17]。
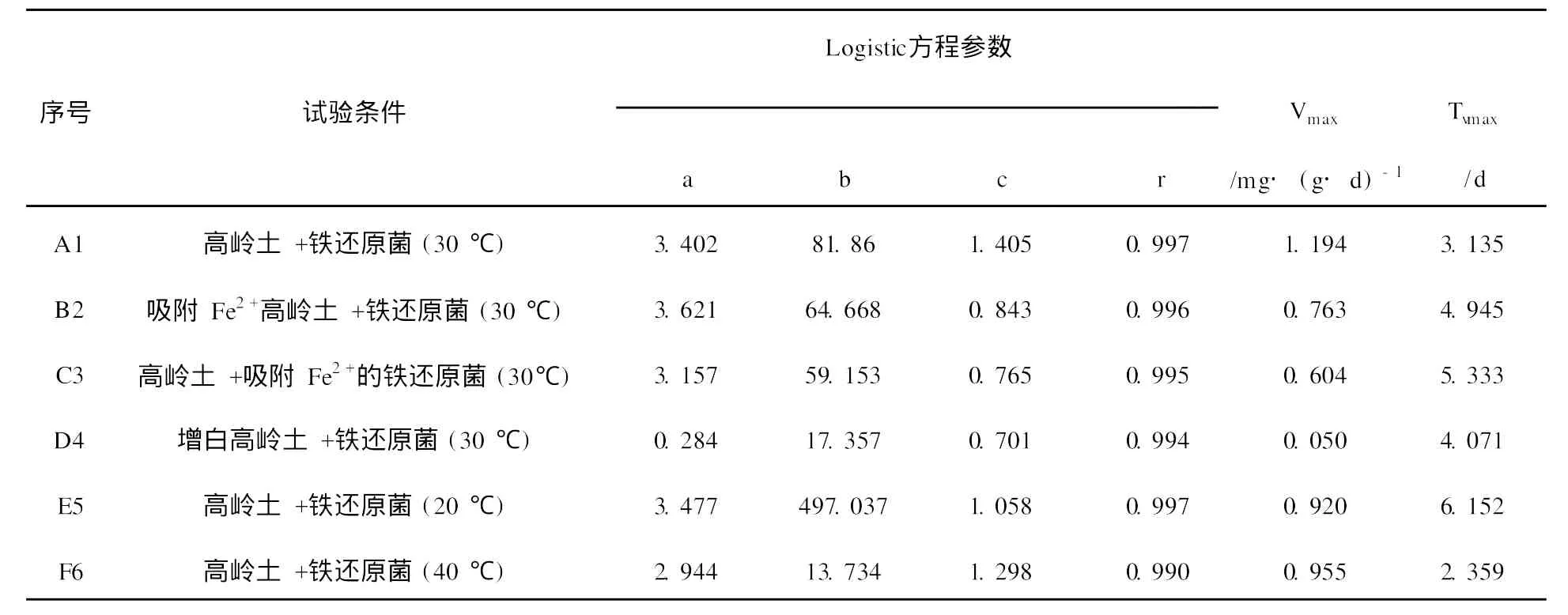
表2 Fe2+及温度对高岭土中Fe3+的生物还原动力学参数Table 2 Parameters for the logistic models of Fe3+bioreduction in kaolin with different treaments of Fe2+and temperature
3 结 论
pH、高岭土量、Fe2+浓度、温度4个条件对高岭土吸附Fe2+均有影响。当pH为6~7,初始Fe2+浓度为30 mg/L时,高岭土最易吸附Fe2+。一定范围内,高岭土对Fe2+的吸附量随着温度的升高而增加,随着高岭土量的增加而减少。为了提高高岭土中Fe3+的还原效率,实验的过程中应该尽量避免高岭土吸附Fe2+的最适条件。另外实验结果表明铁还原菌对Fe2+有一定的吸附能力。随着微生物量的增加,Fe2+的吸附量逐渐增加。采用Logistic方程能够较好地拟合Fe2+及温度对Fe3+生物还原特征曲线。根据Logistic方程拟合结果,Fe2+会影响高岭土表面Fe3+位点的生物可利用性和微生物的活性,使Fe3+生物还原的最大速率降低。温度也是影响高岭土中Fe3+生物还原的重要因素,其中30℃是铁还原酶催化作用的最佳温度。
[1] Lee E.Y.,Cho K.S.,Ryu H.W.Microbial refinement of kaolin by iron-reducing bacteria[J].Appl.Clay Sci,2002,22:47-53.
[2] Styriakova I.,Styriak I.Iron removal from kaolins by bacterial leaching[J].Ceram.-Silik,2000,44:135-141.
[3] Inoue K.,Yoshida A.Iron leaching of Shirasu by acid treatment[J].Ceram.Soc.Jpn,1984,92:520-524.
[4] Kimura K.,Tateyama H.Refinementof the low-grade Amakusa pottery stone by hydrothermal treatment[J].Ceram.Soc.Jpn,1989,97:439-446.
[5] Otsuka N.,Hayashi T.,Okanishi K.,et al.The removal of iron oxide from clay by sodium dithionite-sulfuric acid system in Japanese[J].Nendo Kagaku,1974,14:45-57.
[6] S.K.Mandal,P.C.Banerjee.Iron leaching from China clay with oxalic acid:effect of different physico-chemical parameters[J].Miner.Process,2004,74:263-270.
[7] Ryu H.W.,Cho K.S.,Chang Y.K.,et al.Refinement of low-grade clay by microbial removal of sulfur and iron compounds using Thiobacillus ferrooxidans[J].Fer ment.Bioeng,1995,80:46-52.
[8] Hints I.,Kiss S.,Papacostea P.,et al.Application ofmicrobiological method for diminution of Fe2O3content of kaolins[J].4th Symposium of SoilBiology.Rumanian National Society for soil Science,Bucharest,1977:387-391.
[9] Y-Su Luu,Juliana A.Ramsay.Review:microbial mechanis ms of accessing insoluble Fe3+as an energy source[J].World Journal of Microbiology&Biotechnology,2003,19:215-225.
[10] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法(第4版)[M].北京:中国环境科学出版社,2002:368-370.
[11] HE Jiangzhou,QU Dong.Dissimilatory Fe3+reduction characteristicsofpaddy soil extract cultures treatedwith glucose or fatty acids[J].Journal of Environmental Sciences[J].2008,20:1103-1108.
[12] 徐玉芬.粘土矿物对废水中Cu2+、Cd2+、Cr3+的吸附实验研究[J].矿产综合利用,2008,(3):28-31.
[13] 胡振琪,杨秀红,高爱林.粘土矿物对重金属离子的吸附研究[J].金属矿山,2004,(6):53-55.
[14] 丁述理,彭苏萍,刘钦甫,等.膨润土吸附重金属离子的影响因素初探—以Zn2+为例[J].矿物岩石学杂志,2001,20(4):579-582.
[15] LovleyD.R.,Phillips E.J.Availability of Ferric Iron for Microbial Reduction in Bottom Sediments of the Freshwater Tidal Potomac River[J].Appl.Environ.Microbiol,1986,52:751-757.
[16] JaisiD.,Dong H.,Liu C.Kinetic analysis of microbial reduction of Fe3+in nontronite[J].Environ.Sci.Technol,2007,41:2437-2444.
[17] 魏德洲.资源微生物技术[M].北京:冶金工业出版社,1996:1-171.

