沼泽红假单胞菌富硒发酵条件的研究
刘丽梅,赵红卫,傅春蓉,黄 亮,狄姗姗,方为茂
(四川大学化学工程学院,四川成都 610064)
以微生物为载体富集人体及动物所必需的微量元素以求有机形态、制造成本较低廉而富有多种营养的微量元素产品越来越引起人们的关注。研究表明,许多光合细菌具有一定的耐硒和富硒能力,如深红红螺菌(Rhodospirillum rubrum)、沼泽红假单胞菌(Rhodopseudom onas palustris)等[1-4]。其中沼泽红假单胞菌具有富集多种微量元素的能力,是发酵工业中比较常用的菌种之一,又是优质的光合细菌饲料添加剂,是目前作为微量元素载体可能性比较大的菌种。沼泽红假单胞菌本身营养丰富含有多种活性成分,并且是唯一由国家农业部批准作为饲料添加剂使用的光合细菌。研究表明,沼泽红假单胞菌具有较高的蛋白质含量,是一种高效优质的蛋白源[5]。同时,沼泽红假单胞菌中氨基酸种类齐全且消化率高,必需氨基酸总含量达40.92%,必需氨基酸与总氨基酸的比值为44.30%。另外,沼泽红假单胞菌富含B族维生素及类胡萝卜素,同时还含有多种免疫因子和促生长因子,均有利于个体生长,增强抗病性[6]。因此,从营养角度可以认为沼泽红假单胞菌是一种十分优质的饲料营养源。研究表明,沼泽红假单胞菌具有较高的富硒能力并能将无机硒转化为有机硒。细胞硒含量的高低是菌体富硒能力的基本指标,但硒含量与沼泽红假单胞菌的生物量是一对相互联系和制约的因素,单纯追求高硒含量意义不大[7]。从原料利用与转化上来看,如何提高菌体浓度及硒的转化率,对工业化生产更具有实际指导意义。从促进沼泽红假单胞菌生长及对硒的富集效率来看,硒的添加方式、培养基初始pH、装液量等因素[8],均对其有重要影响,通过对这些条件的优化可以有效地提高富硒菌体的生物量及富硒效率。本文采用单一变量法,对富硒沼泽红假单胞菌富硒发酵条件进行研究,为其以后工业化生产打下基础。
1 材料与方法
1.1 材料
1.1.1 实验仪器 电子天平,分析天平,酸度计,紫外分光光度计,无菌操作台,台式高速离心机,恒温鼓风干燥箱,数显恒温水浴锅,聚四氟乙烯消化罐(50 mL),自制光照培养箱。
1.1.2 实验材料 ①菌种:沼泽红假单胞菌BL菌株(由前期实验驯化筛选后所得的具有较强耐硒能力及富硒能力的沼泽红假单胞菌菌株);②发酵培养基:NaHCO32.0 g,CH3COONa 2.0 g,NH4Cl 1.0 g,K2HPO40.5 g,NaCl 2.0 g,MgCl20.2 g,酵母膏0.5 g,玉米浆0.8 g,添加亚硒酸钠至所需浓度,定容至1 L。121℃下高压蒸汽灭菌20 min,并用H3PO4调节pH至7.0;③硒标准溶液:溶解分析纯亚硒酸钠2.190 g于蒸馏水中,小心转入1 000 mL棕色容量瓶中,用蒸馏水稀释至刻度,摇匀,取上述溶液1.0 mL,加蒸馏水稀释1 000 mL,此溶液每毫升含硒1μg;④4%NaF溶液:称取分析纯NaF 4.1 g溶于少量蒸馏水中,定容至100 mL;⑤0.1 mol/L EDTA-Na2溶液:称取分析纯EDTA-Na23.722 g溶于少量蒸馏水中,定容至100 mL;⑥0.2%邻苯二胺溶液:称取分析纯邻苯二胺0.1 g,溶解于少量蒸馏水中,定容至50 mL棕色容量瓶内,用前现配;⑦氢氧化钠、乙醇、亚硒酸钠、盐酸、液体石蜡等。
1.2 方法
1.2.1 培养方法 光照恒温培养箱中,培养条件为30℃,1 500~2 000 lux光强度下光照培养7 d,接种量为5%,250 mL锥形瓶装液量为200 mL,8层纱布牛皮纸封口,液面铺1层无菌液体石蜡隔绝氧气,培养基初始pH调为7。
1.2.2 分析方法 ①细胞浓度测试方法:比浊法测定菌液浓度,使用752型紫外可见分光光度计以蒸馏水为参比测定菌液的OD660值;②富硒菌体中总硒含量的测定:准确吸取1.00 mL定容后的消解菌液于50 mL锥形瓶中,加水至35.00 mL,加入0.2 mL 4%NaF溶液,2 mL 0.1 mol/L EDTANa2,以掩蔽消除Ti4+、Fe3+干扰[6-7],3 mL硒试剂,用1 mol/L HCl调pH至2.0,45℃下反应50 min,转入125 mL分液漏斗中,加入10 mL甲苯萃取,震荡3 min,静置分层,弃去下面水层,将甲苯部分转移至1 cm石英比色皿中,于334 nm下测定吸光度(Ax),由标准曲线查得相应浓度(Cx),按下式计算样品中的硒含量(X)。处理样品的同时,用为富硒菌体作为空白样对照。

式中:Cx为硒标准曲线查得硒浓度(μg/mL);m为样品的质量(g);③富硒菌体中无机硒硒含量的测定:准确取0.100 0 g富硒沼泽红假单胞菌样品于50 mL蒸馏水中,小火微沸30 min,抽滤得到滤液,定容至50 mL,然后按总硒含量的测定方法进行测定,即可得样品中的无机硒的含量;④发酵培养液中残留无机硒含量的测定:取适量样品菌液,无菌操作台上用移液枪量取上清液1 mL加水至35 mL,以下同标准曲线的测定;⑤有机硒含量的测定:有机硒含量=总硒含量-无机硒含量;⑥富硒能力(有机硒转化率):有机硒转化率/%=(有机硒含量/总硒含量)×100%。
1.2.3 富硒沼泽红假单胞菌生长曲线的测定通过测定耐硒菌生长曲线,确定最佳加硒时间和培养时间。从斜面上挑取已驯化菌株制成菌悬液,活化12 h后,按照5%的接种量接种于液体培养基的锥形瓶中,在恒温光照培养箱中光照培养每隔24 h于净化操作台上取样测定660 nm处菌液的吸光度。因为吸光度与细胞密度成线性相关,由此可确定耐硒菌的生长曲线。
1.2.4 富硒发酵条件的优化 ①温度与沼泽红假单胞菌生长量及富硒的关系:配制硒含量100 μg/mL的液体培养基,以5%接种量接种,分别在17、25、30、35、40℃的温度下培养7 d,测定富硒沼泽红假单胞菌生物量及富硒量,分析温度对富硒沼泽红假单胞菌生物量和含硒量的影响;②培养基初始pH对菌株生长及富硒的影响:做发酵培养基中初始pH的单因素实验,配制液体培养基,分别调pH为5、6、7、8、9,记为1#~5#,培养基中硒含量100μg/mL,以5%接种量接种,光照恒温培养7 d,每隔24 h检测菌体生物量及发酵液残留硒含量,分析培养基初始pH对富硒沼泽红假单胞菌生物量与富硒过程的影响;③装液量对于菌株生长及富硒的影响:250 mL的锥形瓶中,分别加入100、150、200、250 mL液体培养基,接种后恒温光照培养7 d,记录样品生物量以及菌液中硒浓度,分析装液量对富硒沼泽红假单胞菌生物量和含硒量的影响;④硒的添加方式对菌株富硒情况的影响:在富硒发酵过程中,实验发现不同的添加硒方式对沼泽红假单胞菌生长具有不同的影响,硒的添加方式主要有两种:一种是一次性加入;另一种是梯度添加法,也就是在发酵初期菌体生长缓慢阶段,培养基中硒浓度保持在较低水平,随着菌体生长繁殖加快,在菌体生长达到稳定期之前,培养基中硒浓度逐步提高至实验确定的水平。
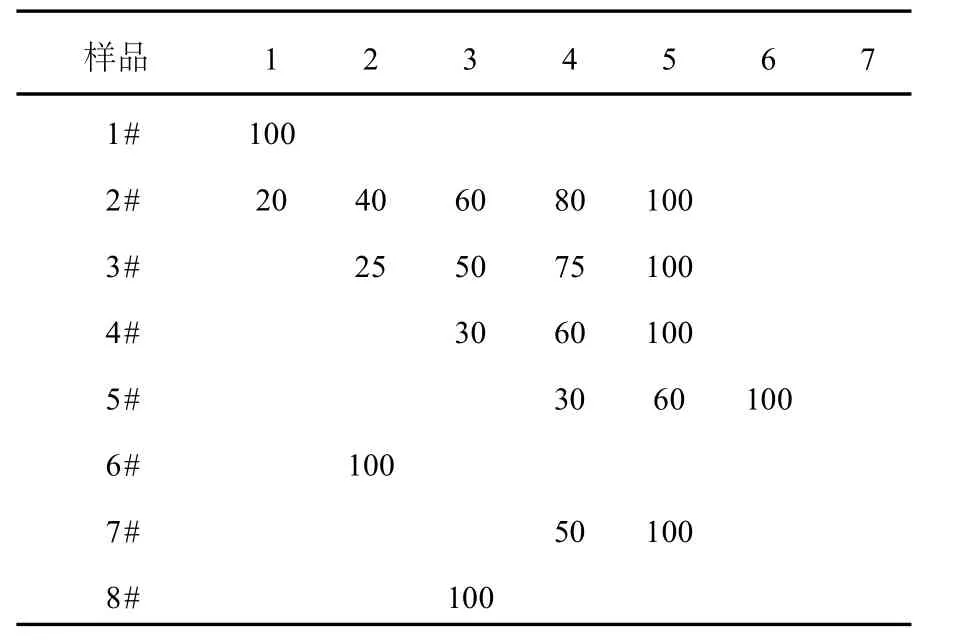
表1 培养基中硒添加方式Table 1 Different add methods of Se in the medium
培养基初始pH为7.0,装液量200 mL/250 mL三角瓶,接种量按照5%进行接种,光照恒温培养7 d,按照表1中的方式进行硒胁迫处理,分别记为1#~8#,最终菌液中总硒浓度达到100 μg/mL,每天测定菌液生物量。
1.2.5 富硒沼泽红假单胞菌富硒量的测定 根据得到的优化条件对富硒沼泽红假单胞菌进行培养,按照1.2.2方法测定菌体总硒含量和菌体内无机硒含量,测定培养液中无机硒残留量并计算有机硒量和硒转化率。
2 结果及分析
2.1 富硒沼泽红假单胞菌生长曲线
测定富硒沼泽红假单胞菌,可以根据其生长周期初步确定加硒时间和培养时间。富硒沼泽红假单胞菌生长曲线如图1所示。

图1 富硒沼泽红假单胞菌生长曲线Fig.1 Growth curve of Se-enriched Rhodopseudomonas palustris
结果表明,富硒菌体生长基本无延迟,这是因为驯化后的菌株对硒有了很好的耐受性,因此在低硒浓度的培养基中能较快的适应环境,生长加快。沼泽红假单胞菌在第2天进入生长对数期,5~7 d处于生长稳定期。由于对数期菌体代谢旺盛,硒转化量大,而衰亡期菌体会大量自溶,转化率低,而且早期加硒对菌株的代谢活动抑制较强,不利于高效率富硒,从转化率和生产周期考虑,如果是一次性加硒,第5天、第6天加硒比较好。
2.2 富硒发酵条件的筛选
2.2.1 温度与菌株生长及富硒的关系 微生物的生命活动是由一系列生化反应组成的,而这些反应受温度的影响十分明显,不同微生物最适生长温度各不相同。按照1.2.4①操作,得到温度与菌株生物量及菌液中硒含量的关系如图2及表2所示。

图2 温度对富硒沼泽红假单胞菌生物量的影响Fig.2 The impact of temperature on the growth of Se-enriched strain

表2 第7天菌液中的残留硒浓度Table 2 Residual Se-content in the medium on the 7th day
结果表明,温度对富硒沼泽红假单胞菌的生物量和含硒量有较大的影响。从图2可以看出硒含量以及富硒率均是先升高后降低,其中生物量和富硒率都是在30℃达到最高值,选择30℃作为富硒沼泽红假单胞菌发酵培养时的最适温度。
2.2.2 培养基初始pH对菌株生长和富硒的影响 在沼泽红假单胞菌富硒培养的过程中,培养基初始pH与培养周期结束时菌液中的pH相差较大,不同的pH会影响菌株生长及富硒的过程。培养基初始pH与生物量和硒含量的关系如图3和图4所示。
结果表明,发酵培养基的初始pH对富硒沼泽红假单胞菌和菌液中硒含量的影响是很大的,随着pH由5到9逐渐升高,富硒沼泽红假单胞菌的生物量先升高再降低,呈“钟形”。而菌液中硒含量与pH呈“倒钟”形。由此可见,在pH为7左右时,富硒沼泽红假单胞菌的生长与富硒效率最高,选择pH=7作为富硒沼泽红假单胞菌的发酵培养基的初始pH。

图3 培养基初始pH对富硒沼泽红假单胞菌生物量的影响Fig.3 The impact of initial medium pH on the growth of Se-enriched strain

图4 培养基初始pH对富硒沼泽红假单胞菌富硒的影响Fig.4 The impact of initial medium pH on the Se enriching of strain BL
2.2.3 装液量对于菌株生长及富硒的影响

图5 装液量对沼泽红假单胞菌生物量的影响Fig.5 The impact of culture volume on the growth of Se-enriched strain
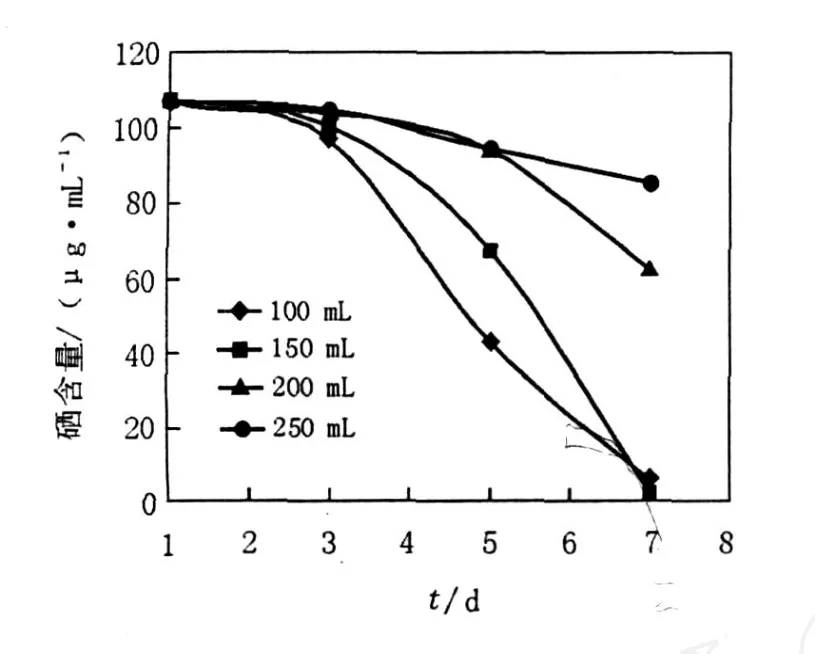
图6 装液量对沼泽红假单胞菌富硒的影响Fig.6 The impact of culture volume on the Se enriching of the strain
在沼泽红假单胞菌的培养过程中,发现在同样的生长条件下,由于装液量不同,样品之间的生物量、富硒率之间会有一些差异。因此,设计了装液量的实验对其进行验证,看三者之间是否有因果联系。装液量对菌株生长及富硒的影响如图5和图6所示。结果表明,装液量为100 mL时,富硒沼泽红假单胞菌的生物量最高,且菌液中硒浓度最低,150 mL的样品次之,培养时选择装液量为100 mL。
2.2.4 硒的添加方式对菌株富硒情况的影响富硒沼泽红假单胞菌的培养一般采用在第1天开始加硒的方法,以期在长时间硒胁迫中获得高富硒量沼泽红假单胞菌,但各实验所得沼泽红假单胞菌硒含量一般,并且生物量不是很高。这是由于高浓度的硒对微生物生长具有抑制作用,在富硒沼泽红假单胞菌发酵过程中,如果一次性将硒添加到培养基中,通常硒的量不能过高,但是这样会造成微生物富集到的硒含量较低[9-10]。按照1.2.4中④操作,亚硒酸钠不同添加方式对富硒沼泽红假单胞菌生物量如表3所示。
1#、6#、8#3个样品是一次性将菌液中硒浓度增加到100μg/mL,三者比较,1#、6#生物量相差不大,8#生物量高于前两者,说明在富硒沼泽红假单胞菌生长初期加入高浓度亚硒酸钠,会抑制沼泽红假单胞菌的生长。但是当经过驯化的沼泽红假单胞菌生长到一定程度时,加入高浓度的亚硒酸钠并未对其生长产生非常强的影响,证明经过驯化培养的菌株对亚硒酸钠有着很强的抗性;2#与3#相比,2#第1天培养基中硒浓度被加至20 μg/mL,3#第2天浓度被加至30μg/mL,后面几天3#生长比2#要理想,可能是因为2#加入的亚硒酸钠抑制菌株生长,而3#经过多1 d的生长,进入对数期后迅速生长,故生物量比2#大;4#、5#处于富硒沼泽红假单胞菌的对数生长期,而且每次加入的硒浓度只有30μg/mL,不会对沼泽红假单胞菌的生长产生强烈的抑制作用,所以在所有的样品中,3#与4#的生物量是最高的;7#虽然也是在对数生长期加硒,但是由于一次加硒量过高,达到每次加硒浓度为50μg/mL,对菌株的生长产生了抑制作用。

表3 不同硒添加方式样品的生物量Table 3 The impact of different add methods of Se in the medium on the growth of the strain
可以看出,一次添加方式富硒沼泽红假单胞菌的生物量相对较小,是因为亚硒酸钠是一次性加入,起始的环境硒浓度较高,对富硒沼泽红假单胞菌生长的抑制作用相对较强,不利于沼泽红假单胞菌进行分裂生殖,进而影响总生物量。梯度添加方式则是根据沼泽红假单胞菌生长的不同阶段,采用硒浓度梯度增加法。其起始的环境硒浓度保持在较低水平,基本上不会影响沼泽红假单胞菌的生殖过程,故生长量也较高。
梯度加硒法中,3#、4#、5#未出现红硒沉淀,是因为在沼泽红假单胞菌生长缓慢阶段处于环境硒浓度较低的水平中,对沼泽红假单胞菌的生长抑制作用不是很强。随着沼泽红假单胞菌的生长,虽然环境中硒浓度升高,但同时沼泽红假单胞菌的生物量不断增加,富硒能力也逐渐增强,沼泽红假单胞菌可以顺利地吸收转化环境中的无机硒,并转化为有机硒。
结果表明,在沼泽红假单胞菌的对数生长期采用梯度加硒的方式,沼泽红假单胞菌的生物量最高,硒转化率最高。
2.2.5 最优条件下富硒沼泽红假单胞菌菌体内硒含量的测定 最优条件培养下,梯度加硒使培养液中硒浓度最终为100μg/mL,培养1个周期后,测定菌体内总硒含量及无机硒含量,结果如表4所示。

表4 富硒沼泽红假单胞菌菌体内硒含量Table 4 Se-content in the Se-enriched Rhodopseudomonas palustris
结果表明,菌体硒转化率为89.1%,有机硒含量为97.1%,说明菌体具有较高的富硒能力。
3 结 论
首先对实验室保藏的沼泽红假单胞菌菌株进行筛选,获得耐硒、富硒能力强的菌株为出发菌株,对其进行了选育和条件优化,探讨该菌富硒发酵的特性并对其发酵工艺进行优化,为进一步应用于工业生产打下了良好的基础。
①优化了富硒工艺:通过单一变量法对富硒沼泽红假单胞菌发酵条件进行优化,其中,可变因素包括培养温度、培养时间、硒添加方式、培养基初始pH、装液量、接种量等。对于沼泽红假单胞菌富硒培养条件的优化如下,培养温度为30℃,环境硒浓度100μg/mL,硒添加方式应为梯度分次添加,添加时间应为培养周期的第3天、第4天左右,培养基初始pH为7;②富硒沼泽红假单胞菌的富硒量:利用得到的富硒菌种,在最优条件下培养7 d后,测得硒浓度下降为10.9μg/mL,硒的转化率为89.1%,菌体富硒量可达到73.54 mg硒每克干菌种,有机硒含量为97.1%;③利用沼泽红假单胞菌生产有机硒是可行的。而通过本实验的研究,从提高菌体浓度及硒的转化率的角度,为富硒菌体作为动物饲料添加剂或者人类食用营养品的工业化生产提供了指导意义。
[1] Roux M,Sarret G,Pignot-Paintrand,et al.Mobilization of selenite by Ralstonia metallidurans CH34[J].Appl Environ Microbiol,2001,67(2):769-773.
[2] Kessi J.Enzymic systems proposed to be involved in the dissimilatory reduction of selenite in the purple non-sulfur bacteria Rhodospirillun rubrum and Rhodobacter capsulatus[J].Microbiology,2006,152:731-743.
[3] Kessi J,Kurt WH.Similarities between the abiotic reduction of selenite with glutathione and the dissimilatory reactionmediated by Rhodospirillun rubrum and Escherichia coli.[J].Biol chem,2004,279(49):50662-50669.
[4] Kessi J,Ramuz M,Wehrli E,et al.Reduction of selenite and Detoxification of Elemental Selenium by Phototrophic Bacterium Rhodospirillun rubrum[J].Appl Environ Microbiol,1999,65(11):4734-4740.
[5] 吴向华,杨启银,刘五星,等.沼泽红假单胞菌的营养成分与评价[J].江苏农业科学,2005,1:86.
[6] 杨官娥,张肇铭,熊琦.光合细菌化学成分和生理活性研究进展[J].中草药,2005,36(7):1089-1092.
[7] 杨志,洪厚胜,陶慧,等.高生物量富硒酵母的选育及发酵条件的研究[J].武汉生物工程学院学报,2006,2(4):198-202.
[8] 何晓丽,傅晓雪,向少能,等.光合细菌富硒颗粒剂的研究[J].西南师范大学学报(自然科学版),2008,33(3):105-108.
[9] 陈福生,杨清华.不同添加时间和添加量组合对酵母富硒效果的影响[J].中国酿造,2004,(9):14-16.
[10] 陈填烽,崔小峰,杨芳,等.分次加硒法培养高富硒量螺旋藻及其对藻体光合色素和蛋白质含量影响的研究[J].食品与发酵工业,2005,31(8):48-51.

