CTGF反义寡核苷酸对体外培养人晶状体上皮细胞转分化的影响
庄 华 徐国兴 白 月 谢茂松 郭 健 王婷婷 胡建章
CTGF反义寡核苷酸对体外培养人晶状体上皮细胞转分化的影响
庄 华 徐国兴 白 月 谢茂松 郭 健 王婷婷 胡建章
福建医科大学附属第一医院,福建省眼科研究所
目的:研究结缔组织生长因子(connective tissue growth factor, CTGF)反义寡核苷酸对体外培养人晶状体上皮细胞(human lens epithelial cells, HLECs)合成CTGF与а-SMA表达的影响。方法:测算CTGF反义寡核苷酸对体外培养HLECs的转染率;应用CTGF反义寡核苷酸直接转染第三代HLECs进行细胞生长曲线的测定;采用RT-PCR检测细胞CTGF和α-平滑肌动蛋白(α-smooth muscle actin,α-SMA) mRNA水平。结果:直接导入法反义寡核苷酸进入较慢,但导入72h后未出现细胞毒性。CTGF反义寡核苷酸直接导入HLECs培养细胞72h后可见对细胞增殖的抑制作用。直接导入法处理48h后,TGF-β1能显著增加CTGF以及α-SMA mRNA的表达,但却可被CTGF反义寡核苷酸所抑制。而错义寡核苷酸却没有这种作用。结论:CTGF反义寡核苷酸直接转染HLECs能抑制TGF-β1诱导的CTGF与α-SMA表达上调,提示CTGF反义寡核苷酸可能为防治后发性白内障提供新途径。
结缔组织生长因子 晶状体上皮细胞 反义寡核苷酸
后发障又称为后囊膜混浊(posterior capsule opacification, PCO),是白内障术后最常见的并发症,亦是白内障术后视力下降的主要原因。白内障术后残留的HLECs在囊膜上转分化、增生、移行,产生胶原,是发生后囊膜混浊的主要原因。这些转分化的HLECs产生大量的细胞外基质(extracellular matrixc, ECM),ECM是构成纤维化混浊的重要成分,导致了纤维化斑块的形成,最终导致后发性白内障。在此过程中,残留的LECs表达α-SMA。α-SMA正常表达于平滑肌与心肌,晶状体中出现α-SMA为后发障的标志,因此,α-SMA可作为HLECs转分化的指标。转化生长因子-β1(transforming growth factor-β, TGF-β1)能促进HLECs发生纤维化。TGF-β1除了致纤维化作用外,尚有抗增殖,抗炎等重要功能,长期抑制TGF-β1的活性将对机体产生不利影响。TGF-β1下游的效应因子作为治疗的靶点将更具有实用价值。CTGF作为TGF-β1的下游因子,特异地受TGF-β1诱导表达,介导了TGF-β1部分的促纤维化效应。CTGF诱导HLECs转分化为肌成纤维细胞,并表达а-SMA。转分化的LECs可分泌大量细胞外基质,进而导致囊下混浊的发生。
反义寡核苷酸技术是近年来出现的一种根据碱基互补原理,通过抑制mRNA的转运、成熟和翻译、诱导特异性核酸酶产生等机制对特定的靶基因表达产生阻滞,从而抑制或封闭异常或高表达的基因,使其丧失活性,达到基因调控的目的。本研究通过体外细胞实验,CTGF反义寡核苷酸干预细胞生长,初步探讨CTGF在白内障发生中的作用机制。
1 材料与方法
1.1 材料
1.1.1试剂
逆转录试剂盒(美国Fermentas公司),Trizol Reagent(美国Fermentas公司),Taq PCR MasterMIX(美国Fermentas公司),PCR引物(上海英骏生物技术有限公司),人重组转化生长因子β1(TGF-β1)(美国Pepro Tech INC公司),阳离子脂质体转染剂Lipofectamine 2000(美国Invitrogen公司),CTGF反义寡核苷酸和错义寡核苷酸(上海英骏生物技术有限公司),CCK-8试剂盒(碧云天生物技术公司),HLECs来自HLEC-B3细胞株(美国ATCC细胞库)
1.1.2引物及寡核苷酸序列
1.1.2.1 PCR引物
根据Pubmed上各因子mRNA全长序列由Invitrogen Biotechnology公司设计、合成(上海英骏生物技术有限公司),序列如下:
CTGF:上游5’- AAATCTCCAAGCCTATCAAG -3’;下游5’- TTCATGCCATGTCTCCGTACA-3’;扩增cDNA片段长度为270bp。
α-SMA:上游5’- AGGTAACGAGTCAGAGCTTTGGC-3’;下游5’- CTCTCTGTCCACCTTCCAGCAG-3’;扩增cDNA片段长度为199bp。
β-actin:上游5’-GCATCCTGACCCTGAAGTACC-3’;下游5’- GCTCATAGCTCTTCTCCAGGG -3’;扩增cDNA片段长度为523bp。
1.1.2.2 寡核苷酸序列
CTGF反义寡核苷酸(antisence oligonucletide, ASON)和错义寡核苷酸(scrambled oligonucletide, SC):
根据人CTGFmRNA的全长序列和文献由上海英骏生物技术有限公司合成,全部硫代磷酸化修饰,寡核苷酸还进行5’-异硫氰酸荧光素(5’-FITC)标记,序列如下:CTGF反义寡核苷酸(AS):5’-TACTGGCGGCGGTCAT-3’全部硫代磷酸化修饰,部分5’-FITC标记;CTGF错义寡核苷酸(SC):5’-GGTCTAGCTTGCGGAC-3’全部硫代磷酸化修饰。
1.2 方法
1.2.1反义寡核苷酸的导入:将HLECs按1×105/mL的密度接种于6孔板,用含5% FCS的DMEM/HIGH GLUCOSE培养,待细胞亚融合时,改为含2% BSA的培养液培养24h。(1)脂质体包裹法:将4μg的反义寡核苷酸与10μL的脂质体混合,室温放置15 min后加入到培养液中,作用3h、6h。(按Lipofectamine2000使用说明书进行操作)。(2)直接导入法:将4μg反义寡核苷酸直接加入培养液中混匀,作用24h,48h,72h。上述两法的细胞液避光。用无血清DMEM/高糖洗细胞数次,荧光显微镜观察FITC绿色荧光,随机选择20个视野计算阳性细胞数,以同一视野下荧光显微镜与光镜观察到的细胞数之比计算导入率。(3)反义寡核苷酸以30μg/mL的浓度直接导入HLECs中,测定反义寡核苷酸导入48h后的导入率。
1.2.2 CCK-8比色实验检测反义寡核苷酸直接导入法对体外培养的HLECs增殖活力的影响
细胞以每孔5000个细胞的密度接种于96孔板,细胞贴壁后实验组加入含浓度为30μg/ml无5’-FITC标记反义寡核苷酸的、含8%FCS的DMEM/高糖培养基,分别培养24h、48h、72h后,吸去培养液,每孔加100μL的8%FCS的DMEM/高糖培养基以及10μL的CCK-8溶液,37℃细胞培养箱孵育2h,酶标仪测450nm光吸收值。
1.2.3 RT-PCR检测CTGF反义寡核苷酸对体外培养的HLECs CTGF及α-SMA基因表达的影响
将体外培养的第三代HLECs按2×105/mL的密度接种于25cm2培养瓶,用含10%胎牛血清的DMEM/高糖培养基培养,待细胞80%融合时,改为无血清DMEM/高糖培养基培养24h,使细胞达到同步。
分组:(1)正常对照组(C组):用DMEM/高糖培养基培养,作用48h;(2)TGF-β1组(T组):用含TGF-β110ng/mL DMEM/高糖培养基培养,作用48h;(3)反义寡核苷酸组(T+AS组):用含TGF-β110ng/mL和30μg/mL反义寡核苷酸的DMEM/高糖培养基培养,作用48h;(4)错义寡核苷酸组(T+SC组):用含TGF-β110ng/mL和30μg/mL SC的DMEM/高糖培养基培养,作用48h。
RT-PCR(两步法):PBS洗涤各组细胞,在培养瓶中加入TRIzol RNA提取液,按说明书步骤提取总RNA,按RT-PCR试剂盒操作,总反应体积为20μL。CTGF反应参数:94℃预变性5min,扩增94℃ 30s,53℃ 45s,72℃ 45s,30个循环,最终延伸72℃ 7min。α-SMA反应参数:94℃预变性5min,扩增94℃ 30s,60℃ 45s,72℃ 45s,30个循环,最终延伸72℃ 7min。β-actin反应参数:94℃预变性5min,扩增94℃ 30s,59℃ 45s,72℃ 45s,30个循环,最终延伸72℃ 7min。取PCR产物,1.5%的琼脂糖凝胶电泳,凝胶成像系统成像,用图像分析处理系统(美国BIO-RAD公司)进行灰度扫描,以灰度值代表其表达量。用β-actin的量校正,将二者灰度值的相对量进行分析。
2 结果
2.1 Lipofectamine-反义寡核苷酸复合物的导入效率的检测结果
脂质体导入法6h见此时细胞变圆,贴壁不良,显示出脂质体的毒性作用。脂质体导入法3h,6h导入细胞阳性率分别为41%,85%。脂质体导入6h,可以显著增加反义寡核苷酸的导入(P<0.05),但已对细胞有毒性作用。
2.2 反义寡核苷酸直接导入法效率的检测
直接导入法24h的导入率较低,为23%,表现为多数细胞仅仅细胞膜染色。48h和72h组导入率增加,分别为63%和66%,后两者之间无显著性差异(P>0.05)。直接导入法培养72h后,细胞形态正常,未见明显毒性作用。30μg/mL反义寡核苷酸48h转染率达75%。
2.3 CCK-8比色实验检测反义寡核苷酸直接导入法对体外培养的HLECs增殖活力的影响
SPSS软件统计分析:24h组对照组与实验组无显著性差异(P>0.05);48h组对照组与实验组无显著性差异(P>0.05);72h组对照组与实验组有显著性差异(P<0.05),实验组细胞增殖受明显抑制;见表1。

表1 反义寡核苷酸对HLECs增殖活力的影响
2.4 RT- PCR检测CTGF反义寡核苷酸对体外培养的HLECs CTGF及α-SMA mRNA表达的影响
CTGF反义寡核苷酸作用48h,可以大部分抑制CTGFmRNA与α-SMAmRNA的表达,而错义寡核苷酸不能抑制CTGFmRNA与α-SMAmRNA的表达(图1、图2,表2、表3)。

图1 CTGF mRNA在HLECs的表达

表2 不同处理组HLECs CTGF mRNA的表达情况(%,± s)
注:与FSM组比较:*P<0.05;与T+AS组比较:#P<0.05;与T组比较:◆P>0.05。
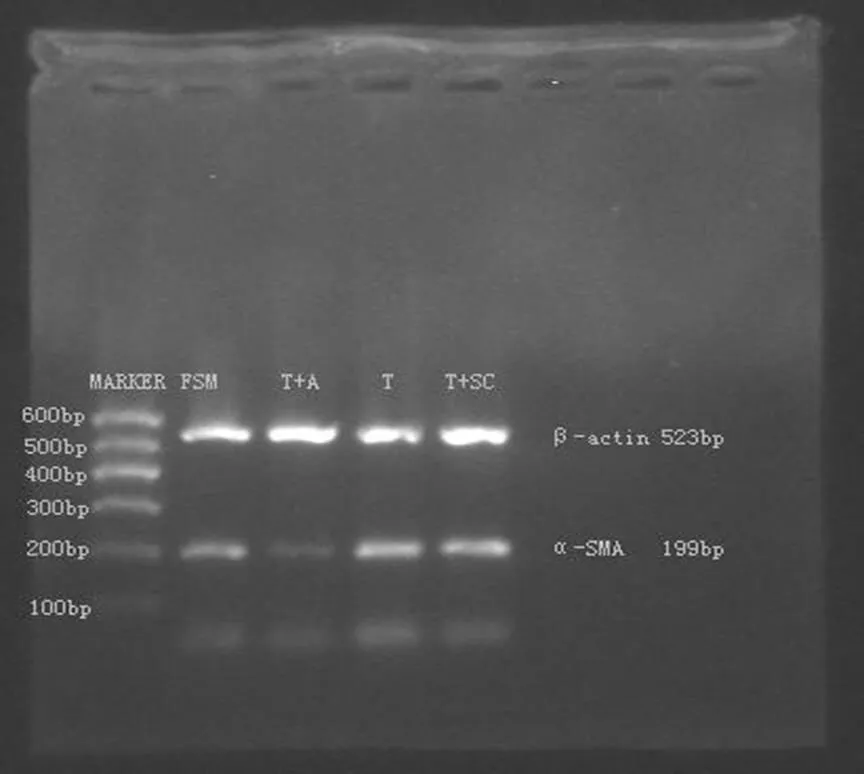
图2 α-SMA mRNA在HLECs的表达
表3 不同处理组HLECs α-SMA的表达情况(%,± s)
注:与FSM组比较:*P<0.05;与T+AS比较:#P<0.05;与T组比较:◆P>0.05。
3 讨论
后囊膜混浊是当前白内障摘除术后影响视力恢复的最主要并发症之一[1-2],其发生率一般在术后5年成人为50%,婴幼儿可达100%。目前后发障的治疗包括药物治疗和手术治疗。药物可使用多种抗代谢药物如:秋水仙碱、裂霉素C(MMC)、5-Fu、柔红霉素等,抗代谢药能明显抑制LECs生长,但由于这些药物缺乏细胞特异性,对周围组织毒性较大,给临床使用带来不便。随着反义寡核苷酸进入PCO治疗研究领域中,国内学者刘宏伟、李长福等分别进行了bFGF和bcl-2的反义寡核苷酸对HLECs增殖活性的影响研究。Kampmeier等利用反转录病毒载体将反义细胞周期蛋白G1与反义MAT1分别转染体外培养的人胚胎HLECs,通过特异性下调细胞周期蛋白G1与MAT1的表达来抑制细胞的增殖活性,并观察到细胞停滞于G1期,而且凋亡细胞的数目有显著性增加,提示反义基因治疗防治PCO可能是一种新的有效的治疗方法。
在RT-PCR实验中,我们用10ng/mL TGF-β1直接转染48h可引起CTGF mRNA、α-SMA mRNA表达显著升高,说明TGF-β1可以显著诱导CTGF和α-SMA mRNA的表达。但是这种诱导作用在反义寡核苷酸组中,被30μg/ml的CTGF反义寡核苷酸所阻断,表明反义寡核苷酸可以在mRNA水平上阻断TGF-β1对CTGF与α-SMA表达的诱导作用[3];在错义寡核苷酸组中,CTGF mRNA、α-SMA mRNA的表达水平与TGF-β1组无显著性差异(P>0.05)。实验结果说明CTGF反义寡核苷酸特异地抑制了TGF-β1促HLECs转分化的作用。TGF-β1刺激细胞转分化通过了CTGF途径,CTGF介导了TGF-β1诱导的α-SMA合成,是TGF-β1的部分生物学功能的下游调节因子。
在对HLECs进行体外实验时,我们发现脂质体短时间就可以提高HLECs的转染率,然而培养6h后出现了细胞毒性反应,细胞贴壁不良,形态变圆,少数细胞已死亡并漂浮于培养基中。直接转染法24h转染率偏低;然而48h转染已可接近高峰,63%细胞的细胞质内可见细小荧光颗粒。CCK-8测定反义寡核苷酸(30μg/mL)对细胞生长的影响可发现24h组和48h组对照组与实验组并无显著性差异(P>0.05),提示反义寡核苷酸(30μg/mL)小于48h的转染对细胞生长并无太大影响;72h对照组与实验组有显著性差异(P<0.05)说明在转染达72h后,该浓度的反义寡核苷酸开始抑制HLECs的增殖。
通过体外实验,我们证实了CTGF反义寡核苷酸在抑制HLECs增殖的作用和抑制TGF-β1的转分化作用。由于CTGF生物学效应相对单一,主要介导促细胞增生和ECM合成以及组织纤维化作用[4]。CTGF反义寡核苷酸可能为防治后发性白内障提供新途径。
[1] 徐国兴.眼科学基础[M].北京:高等教育出版社,2005:1-210.
[2] Meacock WR, Spalton DJ, Stanford MR. Role of cytokines in the pathogenesis of posterior capsule opacification[J]. Br J Ophthalmol, 2000,(84): 332-336.
[3] Guo Haike. Effect of TGF-β1on proliferation of rabbit lens epithelial cells and expression of connective tissue growth factor[J]. Chin Ophthal Res, 2006,(24): 5-8.
[4] Abou-Shady M, Friess H, Zimmermann A, et al. Connective tissue growth factor in human liver fibrosis[J]. Liver, 2000, 20 (4): 296-304.
1.国家自然科学基金重点项目(基金编号:60827002);2.福建医科大学教授发展基金课题(基金编号:2006-js6033)。
徐国兴,zjfmuxgx@pub5.fz.fj.cn。

