壳聚糖酶、纤维素酶降解壳聚糖的研究
肖丽娜
(嘉兴职业技术学院)
壳聚糖酶、纤维素酶降解壳聚糖的研究
肖丽娜
(嘉兴职业技术学院)
研究了壳聚糖酶和纤维素酶催化降解壳聚糖,讨论了温度、pH等因素对壳聚糖降解的影响,并得到最佳的反应条件.研究了壳聚糖酶和纤维素酶的热稳定性,以及pH对酶的稳定性的影响.讨论了底物浓度和酶浓度对壳聚糖降解的影响,适当增加底物浓度和酶的浓度,能够加速壳聚糖的降解.
壳聚糖;壳聚糖酶;纤维素酶;壳低聚糖;降解
0 引言
甲壳低聚糖是壳聚糖经化学降解和酶降解生成的一类低聚物.壳聚糖的低聚糖是指2~10个单糖以糖苷连接而成的糖类总称.近年来,随着研究的深入,壳低聚糖展现出独特优越的生理活性和功能性质,因此用途很广.
最新研究表明,壳聚糖的低聚糖具有抗肿瘤转移的生理功能以及增强机体免疫力的作用,达到抑制癌细胞转移的目的.它生物相容性良好,有治愈创伤效果,能防止感染,形成良性肉芽,与伤口亲合力强,可被人体吸收利于正常组织再生.并可制成人工皮肤或血管等,大面积用于创伤面,促进细胞活化,产生胶原纤维,使皮肤愈合良好,不会留下疤痕.具有调降血压、消除脂肪肝、降胆固醇、增强免疫力功能,它还能提高食品的保水性及水份活性的调节等[1,2].
壳低聚糖很少在自然界存在,通常是由壳聚糖和甲壳素经降解生成.由于壳聚糖或甲壳素分子中乙酰氨基和氨基集团的存在,使糖链中的β-1,4-糖苷键的水解有特殊性.降解的方法通常有酶降解法和化学降解法,此外,还有物理法;利用糖转移反应;利用转基因合成;化学合成法等[3,4].
酶降解法通过特异的开裂壳聚糖的β-1,4-糖苷键来达到降解的目的,反应中不须加入其他试剂,不会对环境造成污染.由于壳聚糖和纤维素在糖苷键的连接上有相似之处,选用壳聚糖酶和纤维素酶对壳聚糖进行降解,研究反应条件对降解的影响,并对这两种酶的最佳降解反应条件进行比较[5,6].
1 材料与方法
1.1 材料
壳聚糖,浙江玉环生物制品有限公司(脱乙酰度90%以上);
壳聚糖酶(浙江大学材料化工学院自制);
纤维素酶(浙江大学材料化工学院自制).
1.2 方法
1.2.1 底物制备方法
将壳聚糖(粉未状)溶于蒸馏水,浸半小时,再加1.0M 的 HAc溶液,搅拌2h,加 pH=4.8的缓冲液,制成1%可溶性壳聚糖.
1.2.2 还原糖浓度测定
DNS 法[7]
(1)DNS试剂的配制
将7.5 g 3,5- 二硝基水杨酸和 14.0 g 氢氧化钠充分溶解于1000 mL水中,加入216.0 g酒石酸钾钠,5.6 mL预先在50℃水中溶化的苯酚和6.0 g偏重亚硫酸钾钠,充分溶解后,盛于棕色瓶中,放置5 d稳定后,即可使用.此试剂有效期为1个月.
(2)标准曲线的制作
①精确配制浓度为 0.2、0.4、0.6、0.8、1.0 g/L的标准葡萄糖溶液1组.
②在试管中加入1 mL标准葡萄糖溶液,3 mL DNS试剂,沸水浴中保持5 min,冷却到室温后,加水至25 mL,摇匀.以水为空白,在540 nm处测吸光值.
③以浓度对吸光值作标准曲线.
(3)样品的测定
取适当稀释的样品1 mL,加3 mL DNS试剂,沸水浴中保持5 min,冷却至室温,加水25 mL,摇匀.以水为空白测定540 nm处的吸光值,按标准曲线计算,得出样品浓度,再乘以稀释的倍数,就得到样品中的糖浓度.
1.2.3 酶活力测定[8]
把1 mL 1% 可溶性壳聚糖(用醋酸缓冲液配制)和1 mL适当稀释的酶液在50℃反应10 min,然后将反应液煮沸3 min,10 μL 10 N NaOH溶液终止反应.然后离心10 min,取上清液,采用Elson-Morgan[5]法测定氨基糖的含量,即可得到反应产生的氨基糖量.一个壳聚糖酶的国际单位(IU)表示为在上述条件下每分钟释放1 μmol氨基葡萄糖量.
2 实验结果和讨论
在降解壳聚糖的各种方法中,笔者选择酶法来降解壳聚糖.由于酶法反应条件温和,成本低,控制酶解条件可以获得所需的低聚糖产品,笔者选用壳聚糖酶和纤维素酶进行降解,并对这两种酶的降解情况进行比较.
2.1 壳聚糖酶和纤维素酶最适反应温度的测定
分别选择反应温度为 30、37、40、45、50、55、60℃ 进行实验.取壳聚糖液,加入缓冲液,加入酶液(壳聚糖酶和纤维素酶),记时反应,完毕后,煮沸,并加NaOH终止反应.离心沉淀.测糖,以蒸馏水代替酶液作空白对照.
2.1.1 温度对壳聚糖酶活性的影响
由图1可见,酶活力随温度的升高而升高,在37℃左右,酶活力最高.超过这一温度,酶活力便随之下降.这与许多研究者作过的实验比较一致.
2.1.2 温度对纤维素酶活性的影响
纤维素酶也能水解糖苷键,因此,用纤维素酶在不同温度下水解壳聚糖.如图2.

图1 温度对壳聚糖酶降解壳聚糖的影响
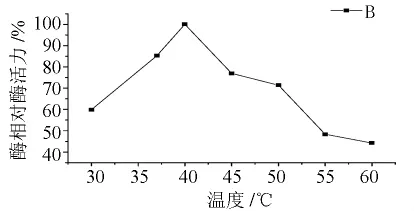
图2 温度对纤维素酶降解壳聚糖的影响
由图2可知,在40℃,纤维素酶活力最高.超过这一温度,酶活力便下降.在实验条件相同情况下,壳聚糖酶和纤维素酶在降解壳聚糖时,最佳反应温度比较接近,分别为37℃和40℃.从所测得酶活性及还原糖量来看,纤维素酶比壳聚糖酶的酶解效果要好的多,纤维素酶的酶活比同体积的壳聚糖酶的酶活高3倍.
2.2 pH对壳聚糖酶和纤维素酶活性的影响测定
配制pH为3~8的几个不同pH的缓冲液.取壳聚糖液,加入缓冲液,加入酶液(壳聚糖酶和纤维素酶),40℃反应.测糖.以蒸馏水代替酶液作空白对照.
2.2.1 pH对壳聚糖酶活性的影响

图3 pH对壳聚糖酶活性的影响
由图3可见,壳聚糖酶降解壳聚糖时,体系的pH约为5.5,此时,壳聚糖酶活性最高.过酸或过碱都使壳聚糖酶活性急剧下降.
2.2.2 pH对纤维素酶活性的影响
由图4可见,纤维素酶的最适pH=4.8.从图上还可看出,纤维素酶在pH大于4.8时,失活速度很快.

图4 pH对纤维素酶活性的影响
2.3 酶的热稳定性测定(失活曲线)
选择4个不同温度点,测定在不同温度下酶保温不同时间后,精确反应,测定剩余的酶活力,以不保温的酶液作空白对照.
2.3.1 壳聚糖酶和纤维素酶的热稳定性曲线
以直接反应的酶活力为100%,其余所得数据折合成剩余酶活力的百分数,再对保温时间作图,得图5.

图5 壳聚糖酶的热稳定性曲线
由图5可知:壳聚糖酶在30℃时,活性下降较平缓,在40℃和50℃,活性下降比较迅速,50℃,2 h以后,酶基本失活.
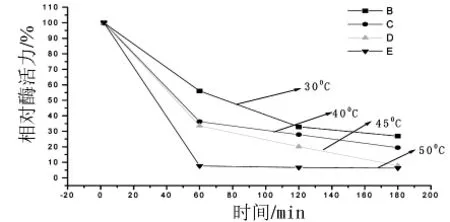
图6 纤维素酶的热稳定性曲线
由图6曲线可知,纤维素酶在1 h之后失活很快,说明纤维素酶耐热性能不好,3 h之后已基本失活.
2.4 不同底物浓度变化对降解的影响
选择底物浓度分别为1%、1.5%、2%、5%,加入三角瓶中,恒温水浴预热,加热到所要求的温度时,加入已准备好的酶液.经不同时间15、30、60 min,分别用壳聚糖酶(调pH=5.5)和纤维素酶(调pH=4.8)进行降解,测定产糖量,酶活力.
2.4.1 壳聚糖酶活力与底物浓度关系

图7 壳聚糖酶活力与底物浓度关系曲线
2.4.2 纤维素酶活力与底物浓度关系

图8 纤维素酶活力与底物浓度关系曲线
底物的浓度不同,酶对底物的适应性也有很大区别.由图7、8可见,降解产糖量随着底物浓度的增大而增加.实验在1 h范围内降解,发现随时间的增加,产糖量增加.
2.5 不同酶液浓度对降解的影响
测试了相同底物浓度,但酶加量不同时,酶液对降解的影响.使酶加入量分别为5 U/g底物(B线),10 U/g底物(C 线),20 U/g底物(D 线),经30,60,90,120 min 降解,测定吸光值.

图9 不同酶液浓度对降解的影响
由图9可见,酶加入量对壳聚糖的降解影响较大,在2 h的实验中,酶的量为20 U/g时,吸光值大,产糖量也高.可见,增大酶用量能够加速壳聚糖的水解.
2.6 微量元素对酶活性的影响
许多酶在高度纯化状态下并没有活力,这是因为在纯化过程中将酶活非蛋白成分——辅酶或无机离子分离掉了,如果加入少量的辅酶或无机离子,活力又会表现出来,通常把这些无机离子称为激活剂.还有一些物质,使酶蛋白活性部位的结构和性质发生改变,从而引起酶活力下降或丧失的一种效应,称这种物质为抑制剂.该实验室,对以下一些无机金属离子的激活及抑制作用进行了测试.配制的金属离子浓度为0.5M.在壳聚糖酶反应液中分别加入不同的金属离子,然后按标准方法测定酶活力,结果列于表1.

表1
由表 1 可见 Ag+、Pb2+、Cu2+,Mn2+对壳聚糖酶有很强的抑制作用.
2.7 关于壳聚糖分子量的测定
该实验应用的壳聚糖为脱乙酰度为90% 的壳聚糖,采用粘度测定法测定分子量.粘度的测定采用粘度计,该实验采用乌氏粘度计,溶液的粘度与溶剂的粘度的比例值称为相对粘度ηr=η/η0,用在乌氏粘度计中的流出时间的比值T/T0来表示.当高聚物的浓度较稀时,其相对粘度的对数值与高聚物溶液浓度的比值,即为该高聚物的特性粘数[η].根据高聚物的特性粘数可以计算其平均相对分子质量.
经测量计算,壳聚糖的粘平均相对分子质量为1.651 ×105.
3 结论
(1)壳聚糖酶和纤维素酶催化降解壳聚糖时,壳聚糖酶最佳的反应条件为:37℃,pH=5.5;在30℃时,活性下降较平稳,反应3 h失活,最适反应温度较高.
纤维素酶最佳的反应条件为:40℃,pH=4.8;在30℃时,反应1 h失活加快,说明纤维素酶的耐热性能不好.
(2)底物浓度和酶的浓度对壳聚糖的降解均有影响.适当增加底物浓度,能够加速壳聚糖的降解;适当增加壳聚糖酶和纤维素酶的浓度,也能够加速壳聚糖的降解.
[1]夏文水,吴淼楠.甲壳低聚糖功能性质[J].无锡轻工大学学报,1996(4).
[2]夏文水,魏新林.甲壳低聚糖制备研究进展[J].应用化学,2004,4.
[3]郑莲英.壳聚糖水解酶的筛选[J].材料研究学报,2004,4.
[4]周桂,何子平等.纤维素酶与淀粉酶降解壳聚糖的动力学研究[J].海洋科学,2003,27(11):59-62.
[5]林强,马可立.利用纤维素酶催化水解壳聚糖的研究[J].日用化学工业,2003,2.
[6]周孙英,余萍,陈盛.溶菌酶对壳聚糖降解的研究[J].中国海洋药物,2002,6:25-28.
[7]Miller G L.Use of dinitrosalicylic acid regent for determination of reduciing sugar[J].Anal.Chem.,1959,3;426-428.
[8]Uchida Y,Ohtakara A.Chitosanase from Bacillus species[J].Methods Enzymol.,1988,36:501-505.
The Study of Chitosan by Chitinase and Cellulas Degradation
Xiao Lina
(Jiaxing Vocational Technical College)
In this paper,a new approach in preparing low-molecular chitosan by chitinase and cellulas degradation is introduced.The optimum reaction conditions for both chitinase and cellulas are summarized in comparing to the conventional methods.This paper also explored how to controll the reaction dynamics by the ratio of substrate and enzyme concentration in the system.
Chitosan;Chitinase;Cellulas;Low-molecular weight chitosan;Degrade
2010-09-01
(责任编辑:李佳云)

