坛紫菜配子体离体细胞发育研究*
王 莉,孔凡娜,茅云翔,杨 惠
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东青岛266003)
坛紫菜配子体离体细胞发育研究*
王 莉,孔凡娜,茅云翔**,杨 惠
(中国海洋大学海洋生物遗传育种教育部重点实验室,山东青岛266003)
本文以坛紫菜(Porphyra haitanensis Chang et Zheng)雌雄配子体为材料,酶解得到单细胞并再生培养,研究雌雄配子体体细胞发育途径以及不同部位(根丝段、基部、中部、顶部、成熟区)单细胞发育途径。结果表明,坛紫菜雌雄配子体体细胞发育途径大致相同,但存在一定差异,表现为雌性配子体体细胞发育成果孢子囊,少数体细胞直接发育成类孢子囊枝;而雄性配子体体细胞发育成精子囊,并能释放精子,极少数体细胞发育成类果孢子囊。单细胞再生研究显示,配子体体细胞发育方向受细胞所处部位影响,不同部位体细胞由于其分化程度不同,发育成不同类型的再生体。随着细胞所在藻体部位的上移,正常叶状体和根丝细胞叶状体比例均下降,畸形叶状体的比例下降或无明显差异,丝状体的比例逐渐增加。
坛紫菜;雌雄配子体;单细胞;发育分化
坛紫菜(Porphyra haitanensis Chang et Zheng)是我国特有的大型经济海藻,在福建、浙江、广东北部沿海被大规模栽培,经济和社会效益显著。坛紫菜生活史为异型世代交替类型,由大型配子体(叶状体)世代和微型孢子体(丝状体)世代构成的;绝大多数配子体个体是雌雄异体,少数为雌雄同体[1]。雌雄配子体成熟后分别产生果胞和精子,通过有性生殖产生果孢子,果孢子萌发成为孢子体;孢子体成熟后释放出壳孢子,经减数分裂发育成配子体[1]。一般认为,壳孢子在萌发时进行减数分裂[2],而且分裂形成的细胞不分离,因此其配子体不同部位细胞基因型存在差异,为遗传学上的嵌合体。开展坛紫菜雌雄配子体不同部位细胞发育分化差异研究,不仅对进一步阐明海藻生长发育和细胞分化理论有重要意义,而且为开展坛紫菜遗传学研究提供重要参考。通过分离紫菜配子体细胞在离体条件下培养,观察再生体的形态结构、发育形式以及趋势是研究紫菜配子体细胞发育分化途经的有效方法之一。由单个细胞发育而来的再生体,无论是配子体还是孢子体都具有纯合性高、可稳定遗传的特性,因此酶解单细胞获得纯系材料可为坛紫菜的杂交育种工作提供优质的亲本材料。
关于紫菜配子体体细胞或原生质体发育和分化的研究,国内外均有报道[3-7]。赵焕登等[8]用研磨法分离出条斑紫菜(P.yezoensis Ueda)的配子体体细胞,经培养获得新的叶状体,证明了紫菜细胞发育的全能性。唐延林[9]用海螺酶分离出圆紫菜(P.suborbicu lata Kjellm)配子体体细胞和原生质体,并进一步培养成正常的叶状体。Waaland等[10]分离出P.nereocystis Anderson原生质体,发现其再生形成丝状体、愈伤组织以及在愈伤组织边缘萌发形成叶状体。曾庆国[7]利用酶法分离坛紫菜叶状体单细胞发现有3种不同的发育途径,并探讨了单细胞发育成丝状体的情况。严兴洪等[11]系统地研究了坛紫菜雌雄配子体的细胞发育分化过程,发现雌雄配子体体细胞再生体中,均出现9种不同发育类型,再生体发育类型的数目和比例与种藻日龄密切相关。但上述研究未对坛紫菜单性配子体不同部位的细胞发育分化途径差异进行深入的探讨。本文以实验室单株隔离培养的坛紫菜雌雄配子体为材料,通过酶解法获得不同部位的单细胞进行再生培养,研究坛紫菜雌雄配子体的细胞发育分化异同点,以及配子体单细胞发育分化与细胞所在部位的关系,在细胞水平上为坛紫菜遗传育种研究提供实验依据。
1 材料与方法
1.1 材料
坛紫菜为本实验室培养的品系,株名为AGB-PHFD-1。利用贝壳丝状体采集壳孢子以及室内配子体培养方法同文献[2],其配子体长到1~2 cm后分别在相同条件下单独隔离培养,培养到成熟后阴干保存于中。实验前挑选藻体体长15 cm以上的雌性和雄性配子体各10株,分别复苏培养3 d进行酶解。
1.2 配子体的单细胞分离和再生培养
分离细胞所用的工具酶是粒嵘螺(Turbocoronatus granulatus Gmelin)粗酶液,酶解方法参照[12]略作修改。取一定数目的细胞于培养皿中,加入M ES培养液进行培养。培养条件为温度20℃,光照密度前期为5μmol·m-2·s-1,光周期12L∶12D。培养1周后,将光照密度提高到20μmol·m-2·s-1,其余条件不变。每周更换1次培养液。
1.3 配子体不同部位单细胞再生植株培养
从藻体的固着器向上依次划分成5个区段,即根丝段(0~1 cm)、基部(1~4 cm)、中部(4~7 cm)、顶部(7~10 cm)、成熟区(10~15 cm),剪取5个区段分别进行酶解获得单细胞进行培养。细胞培养方法和条件同上。
2 结果
2.1 雌配子体离体细胞发育分化类型
根据配子体单细胞再生植株的形态、细胞排列形式和大小、细胞色素体的形态、有无假根、发育分化趋势,坛紫菜雌配子体体细胞发育分化可分为以下6种类型:
第一种类型是发育成叶状体
Ⅰ.形态正常叶状体。单细胞经第1次极性分裂产生2个极性细胞(见图1-1),然后进行第2次分裂形成线性四分子(见图1-2),其中位于基部的细胞色素体较小而液泡较大,并逐渐伸长长成假根;另一细胞经过几次横分裂形成单列细胞组成的叶状体,再经过纵分裂发育成多列细胞组成的正常叶状体小苗(见图1-3)。叶状体多数为红褐色,细胞大小一致且排列规则,叶片边缘光滑,细胞色素体呈现星状,具有较粗壮的透明状假根且附着牢固。这种发育方式类似于壳孢子发育。
Ⅱ.具假根的畸形叶状体。其叶状体形状不同于正常叶状体,细胞大小不一致且排列不规则,叶片边缘光滑或不光滑,具有单根或多根粗壮且内含色素的类假根或假根(见图1-4和图1-5),附着不牢固,生长一段时间后多数脱落漂浮生长,长到一定大小时整个叶片边缘卷曲。
Ⅲ.不具假根的畸形叶状体(见图1-6)。单细胞经过多次分裂后发育成无假根的畸形叶状体,细胞大小不一致且排列不均匀,少部分细胞色素体呈现黄绿色,叶片形状不规则但边缘较光滑,均漂浮于水中。此类型的叶状体较难长成大的叶状体,部分叶片在生长后期逐渐死亡。
第二种类型是发育成细胞团
Ⅰ.红色细胞团(见图1-7),细胞团内的细胞大小不一致,排列无序呈堆积状,色素体为红褐色且呈弥散状,外缘细胞突起。其发育趋势是部分细胞团的细胞继续分裂形成畸形叶状体;少数细胞团其中一端的细胞直接萌发长出细长的丝状体,另一端少数细胞由红褐色变为黄绿色(见图1-8),其余细胞团逐渐变白死亡。
Ⅱ.黄绿色细胞团(见图1-9),细胞比正常叶状体细胞稍大,多为卵圆形,色素体为黄褐色且呈弥散状。多数细胞团继续分裂形成畸形叶状体;少数细胞团在发育过程中细胞色素体凝集,细胞变红且变圆,被释放出来的细胞萌发成丝状体(见图1-10),其中多数在萌发后不久失去色素然后死亡;其余细胞团逐渐变得透明随后裂解死亡。
第三种类型是发育成果孢子囊。离体单细胞在培养大约1~2周开始分裂成3~16个细胞组成的细胞团,细胞排列不规则,细胞色素体红褐色,然后细胞全部释放出来并以单极萌发方式形成丝状体或直接在囊内萌发成丝状体(见图1-11)。
第四种类型是直接发育成丝状体(见图1-12)。培养一周后,单细胞变圆,色素体颜色加深并凝集成块状,然后从细胞边缘多极萌发长出丝状体,长到一定大小形成丝状体藻落。
第五种类型是发育成类孢子囊枝(见图1-13)。经过一周的培养,细胞色素体由最初的黄褐色转为红色,细胞边缘萌发长出膨大且颜色更深的藻丝,分支多,细胞之间的间隔较明显,最终长成类孢子囊枝。
第六种类型是发育成根丝细胞叶状体。根丝细胞位于叶状体的根丝段和基部,刚解离下来时多为梨形,在较细的一端具有1条根丝(见图1-14)。此类型细胞分裂较慢,培养大约1~2周才开始发生分裂,经过几次分裂发育形成根丝细胞叶状体(见图1-15),其中最显著的特征是假根细长。叶片一般长到十几个细胞就停止生长渐渐衰老死亡。
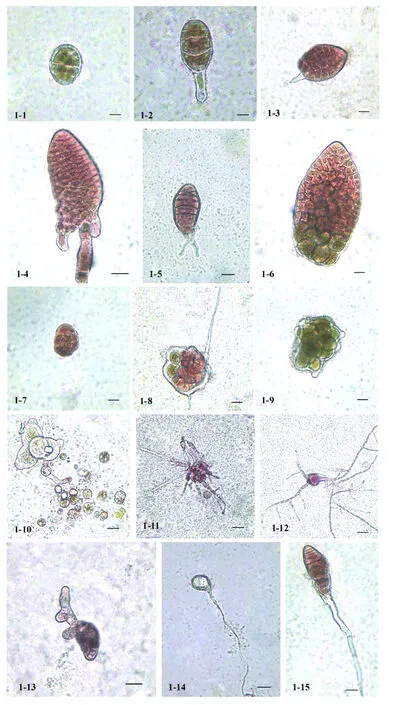
图1 雌配子体体细胞的发育情况Fig.1 The development of somatic cells isolated from female gametophytes
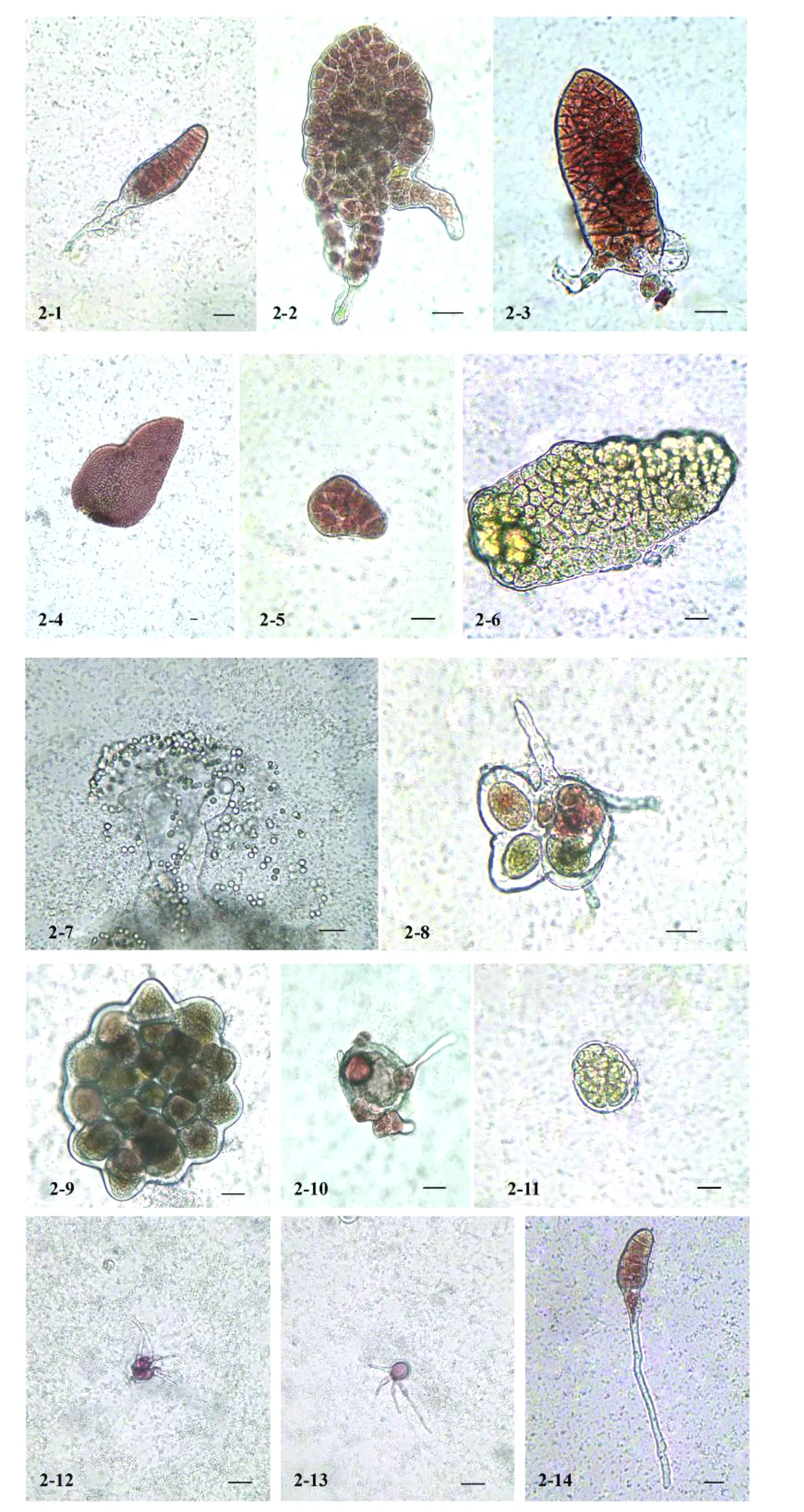
图2 雄配子体体细胞的发育情况Fig.2 The development of somatic cells isolated from male gametophytes
2.2 雄配子体离体细胞发育分化类型
坛紫菜雄配子体体细胞的发育分化类型与其雌配子体类似,主要有6种发育类型:
第一种类型是发育成叶状体,其中Ⅰ(见图2-1)、Ⅱ(见图2-2、图2-3)、Ⅲ(见图2-4)发育类型分别与雌配子体单细胞的Ⅰ、Ⅱ、Ⅲ发育类型基本相同。
第二种类型是发育成细胞团,其中的Ⅰ、Ⅱ发育类型分别与雌配子体单细胞的Ⅰ、Ⅱ发育类型基本相类似,但是发育分化趋势不同。Ⅰ发育类型(见图2-5)多数细胞团继续分裂形成畸形叶状体;少数细胞团进一步发育成黄绿色的精子囊团(见图2-6),然后精子囊从细胞团中游离出来,大量成熟的精子从精子囊中释放,随后解体退化(见图2-7);另有少数细胞团中红褐色细胞直接萌发形成细长的丝状体(见图2-8),其余细胞团逐渐死亡。Ⅱ发育类型(见图2-9)大多数细胞团分化成精子囊团,成熟的精子囊释放大量精子;极少数细胞团释放出红色圆形的细胞并萌发形成丝状体,但较难成活(见图2-10);其余的细胞团裂解死亡。
第三种类型是发育成精子囊(见图2-11)。单细胞经过1~2周的培养分裂形成精子囊状细胞,细胞色素体呈浅黄色,逐渐形成精子细胞,随后释放精子。
第四种类型是极少数单细胞发育成类果孢子囊(见图2-12),其发育过程与雌配子体单细胞基本相同。
第五种类型是直接发育成丝状体(见图2-13),其发育过程与雌配子体单细胞相类似。
第六种类型是发育成根丝细胞叶状体(见图2-14),其发育过程与雌配子体单细胞相类似。
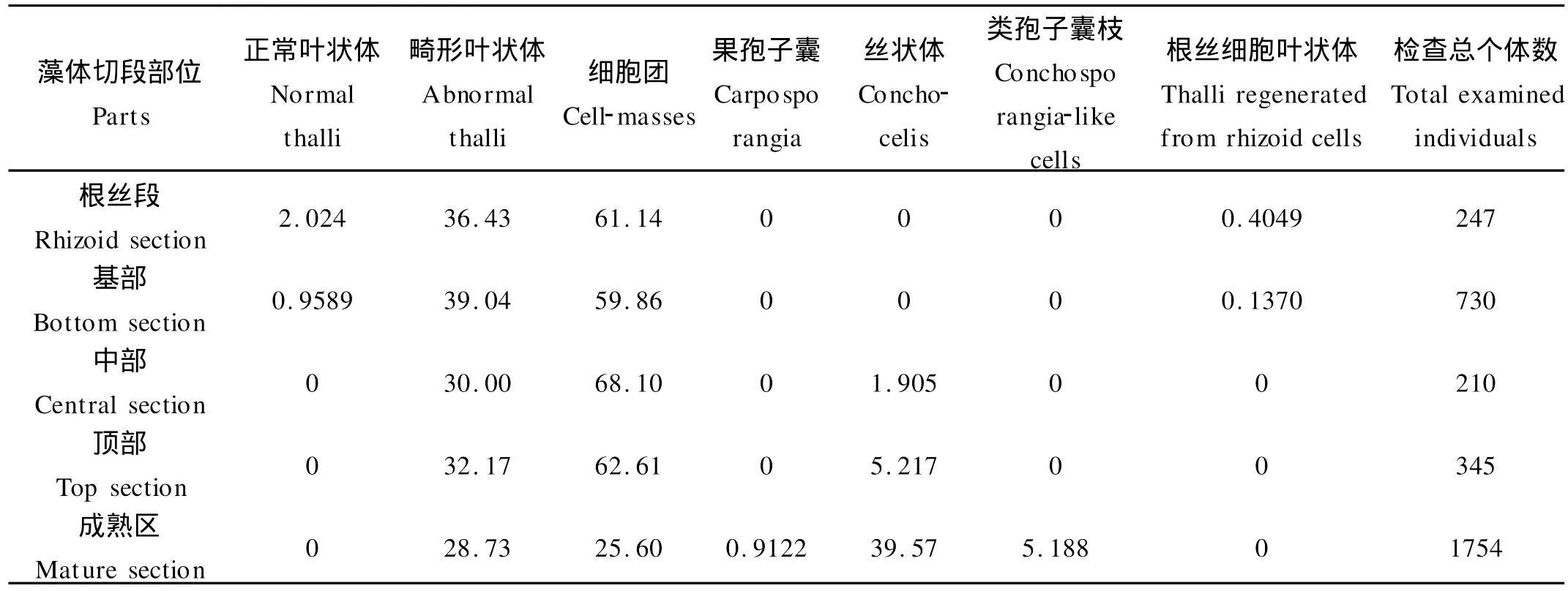
表1 坛紫菜雌配子体不同部位单细胞的发育类型和百分比(%)以及每个部位检查的总个体数(培养15 d)Table 1 Developmental types and their percentages of the single cells isolated from different parts of the female gametophytes and total examined individuals of every part in P.haitanensis after being cultured for 15 days
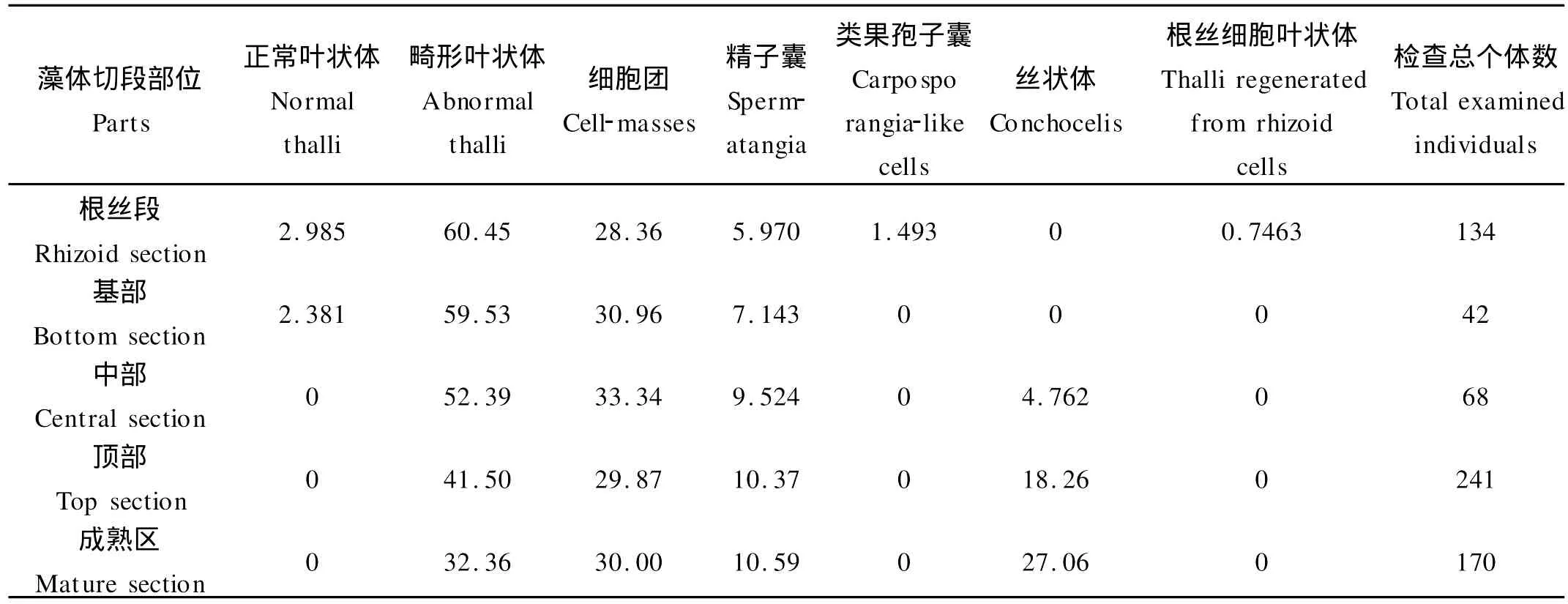
表2 坛紫菜雄配子体不同部位单细胞的发育类型和百分比(%)以及每个部位检查的总个体数(培养15 d)Table 2 Developmental types and their percentages of the single cells isolated from different parts of the male gametophytes and total examined individuals of every part in P.haitanensis after being cultured for 15 days
2.3 配子体离体细胞发育分化的位置效应
对同一株配子体不同部位(根丝段、基部、中部、顶部、成熟区)分别进行酶解获得单细胞进行培养,结果表明不同部位细胞其发育类型和不同类型细胞比例也不同。对于雌配子体,从根丝段向上到成熟区,正常叶状体和根丝细胞叶状体2种发育类型仅出现在根丝段和基部,其所占比例均小于3%且逐渐下降;畸形叶状体所占比例无明显差别;细胞团所占比例除成熟区外无明显差别;从配子体中部开始出现丝状体类型且比例逐渐增加,尤其在成熟区所占比例接近40%;果孢子囊与类孢子囊枝类型仅出现在成熟区(见表1)。与雌配子体不同的是,在雄配子体单细胞的发育类型中畸形叶状体所占比例逐渐下降,出现精子囊类型且所占比例逐渐增加;少数类果孢子囊仅出现在根丝段(见表2)。这说明配子体根丝段和基部大部分细胞处于未分化状态或者初分化状态,中部的大多数细胞已进入分化阶段,顶部细胞已经接近于性细胞,成熟区中大多数细胞已分化成为性细胞。由此可见,无论雌性配子体或雄性配子体,同一株藻体的不同部位的细胞其分化状态不同,从藻体根丝段开始向上移,细胞的分化状态越接近于精子囊或果孢。
3 讨论
3.1 海螺酶对配子体细胞状态的影响
正常生长的配子体细胞饱满呈红褐色,细胞间致密,整个叶片除了根丝段和成熟区以外所有细胞形态基本一致。经海螺酶酶解得到的单细胞色素体墨绿且呈弥散状,基本处于不分裂状态。培养3~4 d后细胞逐渐恢复各种生理机能,在显微镜下观察发现细胞壁加厚,色素体变为星状呈红褐色,细胞开始进入分裂状态。同时研究也发现大量酶解出来的单细胞呈现浅绿色,这类细胞在培养过程中逐渐变透明死亡,这与唐延林[9]的研究结果是一致的,出现这种现象的原因为本研究所用海螺酶为复合酶,除了含有分解紫菜细胞壁的有效酶类(纤维素酶、木聚糖酶、琼胶酶等)外[13],还含有一些对单细胞具有毒害作用且活性较高的蛋白酶等酶类[9],若处理条件掌握不当会导致单细胞大量死亡。
3.2 坛紫菜雌雄配子体离体细胞发育分化的异同点
通过观察坛紫菜雌雄配子体体细胞的发育途径,发现不同性别配子体细胞发育分化类型及趋势基本类似,雌性和雄性配子体离体细胞都可以发育成叶状体、细胞团、性细胞、丝状体以及根丝细胞叶状体,这与严兴洪[11]和王素娟[14]所报道的部分结果相似,但上述作者未观察到单细胞发育成类孢子囊枝的情况。Po lne-Fuller[15]等发现,在野生P.perforate J.Agardh配子体中,邻接成熟生殖块的未分化单离细胞发育成与孢子囊枝形态上相似的膨大藻丝但没有放散壳孢子。曾庆国[7]利用栽培海区的坛紫菜配子体,观察到极个别单细胞可以形成1种类似于膨大细胞的结构,但未指出雌雄配子体单细胞发育的差异和哪种性别配子体单细胞可发育成类膨大细胞。王娟[16]以采自栽培海区的坛紫菜成熟配子体为材料,发现少数雌性配子体营养组织和营养细胞可以直接形成孢子囊枝,并且当培养温度在25℃时比例明显高于20℃,孢子囊枝经培养能正常放散壳孢子。与曾庆国[7]和王娟[16]的报道不同的是,为了排除自然栽培海区混合群体中果孢子囊或受精细胞对实验结果的干扰,本研究使用单株隔离培养的配子体为材料,采用酶法分离培养其单细胞,发现仅来自雌性配子体成熟区的单细胞可发育形成类似于孢子囊枝的膨大藻丝,将其粉碎后继续培养仍保持膨大藻丝的形态,维持3~4个月后死亡。将膨大藻丝培养于28℃条件下时生长速度稍大于20℃但生长均非常缓慢,再经过降温促放培养未放散壳孢子,这与Polne-Fuller[15]在野生P.perforate J.Agardh的研究结果相似。一般情况下,正常生长的营养丝状体只有在特定的光照和温度等诱导条件下才能成熟形成孢子囊枝,而本研究中成熟区少数单细胞未经过特定条件的诱导就可直接形成类孢子囊枝,推测原因是成熟区未受精的果孢或者分化更接近于果孢的细胞具有直接形成类孢子囊枝的能力。但是在雄配子体单细胞培养过程中未观察到孢子囊枝,其原因有待于进一步探索。另外雌性配子体细胞在离体条件下可以发育成果孢子囊,但未观察到发育成精子囊;与雌配子体相比,雄配子体单细胞发育成精子囊,而根丝段的极少数细胞发育成类果孢子囊,本研究认为根丝段少数离体细胞可能发生性别转化,发育成与其来源配子体不同性别的生殖细胞,这种性转化现象在动物界的鱼类中普遍存在。这与王娟[16]的报道不同,后者发现坛紫菜少数雌性或雄性配子体单细胞都能分化出2种性细胞。
3.3 低温冷冻对坛紫菜配子体离体细胞发育分化的影响
实验所用的坛紫菜配子体在-20℃保存了10~20 d,复苏后酶解得到的单细胞经过再生培养发育分化成多种类型的再生植株。同时在研究过程中发现,冷冻6~12个月的材料其发育分化类型明显减少,大多数只观察到发育成无假根的畸形叶状体、具假根的畸形叶状体以及细胞团,正常叶状体、性细胞和丝状体发育类型明显减少,孢子囊枝及根丝细胞叶状体类型极少见。王素娟[14]报道10月中下旬或11月上中旬不冷藏或冷藏天数少的材料出苗多。由此可见冷藏时间越长配子体细胞受到的低温伤害就越大,这样单细胞活力下降,成活率低,发育分化类型减少。为了提高酶解效率并获得尽可能多的发育分化类型,建议利用新鲜的材料或者冷藏天数少的材料进行实验。
3.4 酶法育苗在生产研究中的应用前景
无论雌性配子体或雄性配子体离体细胞均能发育成正常叶状体,但与丝状体发育类型相比,正常叶状体的比例均较低,推测可能与坛紫菜配子体离体细胞的发育全能性及酶解所用藻体的日龄和成熟程度有关。条斑紫菜配子体能形成单孢子,放散萌发后形成新的配子体,而目前大多数学者认为坛紫菜配子体不能形成单孢子,这一点也表明坛紫菜配子体体细胞的全能性较差。严兴洪[11]报道正常叶状体的比例随着藻龄的增加而急剧下降,由此作者认为种藻日龄越大,配子体的成熟程度越高,其大多数体细胞的分化程度越接近于性细胞,发育成正常叶状体就越少。所以在酶法育苗过程中为了获得较高的出苗率,可以利用日龄小的藻体进行酶法分离细胞;对于较成熟的配子体,由于根丝段区域较小的局限可以选择藻体基部区域进行酶解。戴继勋[17]和王素娟[14,18]将坛紫菜和条斑紫菜的单细胞附于网绳上下网栽培并取得了成效。但是由于单细胞在网绳上的附着率低,使得目前酶法育苗在生产实践中仍未得到大面积的推广利用,所以提高单细胞在网绳上的附着效率成为亟待解决的关键问题。此外,由于坛紫菜配子体是遗传上的嵌合体,给遗传育种工作及遗传学研究带来了一定的困难,而通过酶法分离培养单细胞得到的形态正常叶状体为纯合叶状体,这将为开展遗传育种研究提供极大的便利。
[1] 福建省水产局.坛紫菜人工养殖[M].福州:福建人民出版社,1979:1-23.
[2] Yan X H,Li L,A ruga Y.Genetic analysisof the position of meiosis in Porphyra haitanensis Chang et Zheng(Bangiales,Rhodophyta)[J].Journal of App lied Phycology,2005,17:467-473.
[3] Polne-Fuller M,Gibor A.Developmental studies in Porphyra(Rhodophyceae).III.Effect of culture conditionson wall regeneration and differentiation of p rotoplasts[J].Journal of Phycology,1990,26:674-682.
[4] Fujita Y,Saito M,Protoplast isolation and fusion in Porphyra(Bangiales,Rhodophyta)[J].Hydrobiologia,1990,204/205:161-166.
[5] Gall E A,Chiang Y M,Kloareg B.Isolation and regeneration of p rotop lasts from Porphyra dentata and Porphyra crispata[J].European Journal of Phycology,1993,28:277-283.
[6] Chen L C M,Craigie J S,Xie Z K.Protoplast production from Porphyra linearis using a simplified agarase procedure capable of commercial application[J].Journal of Applied Phycology,1994,6:35-39.
[7] 曾庆国,刘必谦,杨锐,等.坛紫菜单个体细胞克隆的丝状体途径[J].中国水产科学,2004,11(6):549-553.
[8] 赵焕登,张学成.条斑紫菜营养细胞的分离和培养[J].山东海洋学院学报,1981,11(1):61-65.
[9] 唐延林.紫菜营养细胞和原生质体的分离和培养[J].山东海洋学院学报,1982,12(4):37-50.
[10] Waaland J R,Dickson L G,Watson B A.Protoplast isolation and regeneration in the marine red alga Porphyra nereocystis[J].Planta,1990,181:522-528.
[11] 严兴洪,刘旭升.坛紫菜雌雄叶状体的细胞分化比较[J].水产学报,2007,31(2):184-192.
[12] 严兴洪,刘新轶,张善霹.条斑紫菜叶状体细胞的发育与分化[J].水产学报,2004,28(2):145-154.
[13] 刘成圣,刘晨光,孟祥红,等.海螺酶的制备、性质和应用研究[J].武汉大学学报:理学版,2002,48(2):243-248.
[14] 王素娟,张小平,徐志东,等.坛紫菜营养细胞和原生质体培养的研究Ⅰ[J].海洋与湖沼,1986,17(3):217-221.
[15] Polne-Fuller M,Gibor A.Development studies in Porphyra.I.Blade differentiation in Porphyra perforata as expressed by morphology,enzymatic digestion,and p rotoplast regeneration[J].Journal of Phycology,1984,20:609-616.
[16] 王娟,戴继勋.坛紫菜单性叶状体细胞的发育研究[J].中国海洋大学学报,2008,38(3):419-423.
[17] 戴继勋,包振民,唐延林,等.紫菜叶状体细胞的酶法分离及其养殖研究[J].生物工程学报,1988,4(2):133-137.
[18] 王素娟,孙云龙,路安明,等.坛紫菜营养细胞和原生质体培养研究——Ⅱ.直接育苗下海养殖的实验研究[J].海洋科学,1987,11(1):1-7.
Studies on the Development of Cells Isolated from Gametophytes in Porphyra haitanensis
WANG Li,KONG Fan-Na,MAO Yun-Xiang,YANG Hui
(Labo rato ry of Marine Genetics and Breeding,Ocean University of China,Qingdao 266003,China)
This paper investigated the developmental patternsof somatic cells isolated from male and female gametophytes in Porphyra haitanensis Chang et Zheng and the developmental patterns of the single cells isolated from different parts of the gametophytic thallus(rhizoid section,bottom section,central section,top section,mature section).The single cells enzymatically isolated from both male and female gametophytes of P.haitanensis were cultured.The results showed that the development of somatic cells of male and female gametophytes in P.haitanens is were a little different although their patterns were nearly the same.These differences included some somatic cells isolated from female gametophytes developing into carpospo rangia,a few somatic cells developing into conchospo rangia-like cells;but some somatic cells isolated from male gametophytes developing into spermatangia from which spermatia were released,only few somatic cells developing into carpospo rangia-like cells.Researches on regeneration of the single cells showed that the development of somatic cells isolated from gametophyteswere affected by the part of the gametophytic thallus.The somatic cells isolated from different parts of the thallus regenerated into different types of plants because of the difference of the differentiation stages of the cells in the thallus.With the position w here the cells were isolated moving upward from rhizoid section,the percentages of both normal thalli and thalli regenerated from rhizoid cells decreased,and the percentages of the abnormal thalli also decreased o r had no significant difference,while the percentages of the conchocelis increased.
Porphyra haitanensis;male and female gametophytes;single cell;development and differentiation
Q343
A
1672-5174(2010)12-081-08
国家自然科学基金项目(30700621,30972247);国家高技术研究发展计划项目(2006AA 10A 402,2006AA10A 413);教育部新世纪人才支持计划(NCET-06-0596);山东省优秀中青年科学家科研奖励基金(2008BS06002);农业部行业公益性专项(200903030)资助
2009-12-21;
2010-04-27
王 莉(1983-),女,硕士生,主要从事藻类遗传育种研究。E-mail:liwang830423@yahoo.cn
**通讯作者:Tel:0532-82032017;E-mail:yxmao@ouc.edu.cn
责任编辑 于 卫

