新生淋巴管在判断胰腺癌预后的独立胰腺导管腺癌周围神经丛微转移过程中的机制研究
程鹏 金钢 胡先贵 陈颖 刘瑞 张怡杰 邵成浩 周颖奇
·论著·
新生淋巴管在判断胰腺癌预后的独立胰腺导管腺癌周围神经丛微转移过程中的机制研究
程鹏 金钢 胡先贵 陈颖 刘瑞 张怡杰 邵成浩 周颖奇
目的研究新生淋巴管在胰腺导管腺癌周围神经丛微转移过程中的作用与机制。方法收集2005年9月至2006年10月长海医院行胰腺癌扩大根治术的30例胰腺导管腺癌患者的临床资料,术中采集胰腺肿瘤、癌旁、胆管下段、胰尾、肠系膜上动脉(SMA)旁组织(含胰周神经丛)以及区域淋巴结标本。常规病理检查,采用双重免疫组化方法检测毛细淋巴管,计算淋巴管密度(LVD)。结果胰内和(或)胰周神经丛浸润25例(83.3%),其中胰内合并胰周神经丛浸润20例,单纯胰内神经浸润5例,无单纯胰周神经丛浸润病例。神经浸润与患者年龄、性别、淋巴结转移、肿瘤大小、肿瘤部位无明显相关性(Pgt;0.05),但与JPS临床分期相关(Plt;0.05)。癌组织内的平均LVD为每视野(4.2±3.4)个,显著少于癌旁的(11.3±6.9)个及正常胰腺组织的(10.8±4.4)个(Plt;0.01) ,正常胰腺组织与癌旁组织平均LVD值差异无统计学意义。18例胰腺癌患者在非癌组织清晰可见肿瘤浸润淋巴管,而且胰周神经丛浸润与淋巴管肿瘤浸润间亦有明显相关性(Plt;0.05)。结论胰腺导管腺癌周围神经丛浸润的发生率较高,神经浸润与JPS临床分期、淋巴管浸润有明显相关性,提示胰腺导管腺癌存在通过新生淋巴管途径扩散转移的可能性。
胰腺肿瘤; 肿瘤转移; 淋巴管; D2-40; 微转移
材料和方法
一、临床资料
收集第二军医大学长海医院普外科2005年9月至2006年10月行胰腺癌扩大根治术的经病理检查证实的30例胰腺导管腺癌患者,其中男19例,女11例,年龄35~76岁。22例肿瘤位于胰头及钩突部,8例位于胰颈、体尾部。30例经影像学检查及术中检查均明确无远处脏器转移。22例(73.3%)行胰头十二指肠切除术,8例(26.7%)行胰体尾切除术。30例均行淋巴结廓清(D1或D2)。肿瘤直径2.0~5.5 cm;中分化24例,低分化6例;淋巴结转移17例(56.7%);根据日本2002年第5版胰腺癌治疗规范(JPS)的临床分期标准,Ⅱ期4例(13.3%),Ⅲ期 5例(16.7%),Ⅳ期21例(70.0%)。
二、标本采集
将术中采集的各例标本分成肿瘤组、癌旁组(距肿瘤组织 ≤1.2 mm且未被肿瘤组织包围)、周围正常胰腺组(距肿瘤组织 gt;1.2 mm );另有SMA旁组织(含神经丛)、区域淋巴结,大小为2.0 cm×1.5 cm×0.3 cm。所有标本固定、包埋、连续切片,间隔取1套行HE染色,另1套行免疫组化染色。
三、D2-40和CK19双重免疫组化染色
按照双染试剂盒(Polylink DS kit,中杉金桥生物技术公司)说明书操作。鼠抗人D2-40单克隆抗体(DAKO,USA)及兔抗人CK19单克隆抗体(Epitomics,USA)均1∶100稀释。以PBS代替一抗作为阴性对照,同一切片的非染色部位作为阳性对照。CK19和D2-40双重免疫组化阳性表现为红色和棕黄色颗粒。
淋巴管密度(LVD)测定:淋巴管内皮细胞胞膜和胞质的D2-40阳性染色呈棕黄色颗粒状。标记阳性淋巴管一般呈扩张状,形态不规则,壁薄,管壁无平滑肌,管腔内偶见淋巴细胞,也可见由几个内皮细胞构成的细胞簇,甚至仅见单个内皮细胞。40倍光镜下确定D2-40染色阳性最集中的区域,然后在200倍视野下计数3个视野的染色阳性淋巴管数,取均值,为各个组织的LVD。
四、统计学分析
数据分析采用SPSS 13.0统计软件分析系统。神经浸润与临床病理参数的关系及胰周神经丛浸润与淋巴管肿瘤浸润的相关性采用Fisher确切概率法。LVD值符合正态分布,采用配对t检验分析。Plt;0.05被认为差异有统计学意义。
结 果
一、胰腺癌神经浸润及其与临床病理参数的关系
HE染色可见导管腺癌细胞浸润神经束膜,有的神经纤维束被肿瘤细胞包绕形成完整的一层癌性上皮(图1),但难以辨别毛细淋巴管与毛细血管。
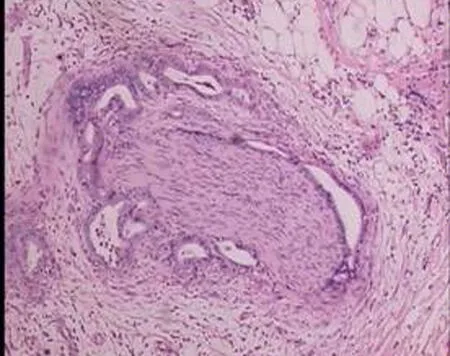
图1 胰周神经丛中癌细胞包绕胰周神经束( HE ×100)
胰内和(或)胰周神经丛浸润25例(83.3%),其中胰内合并胰周神经丛浸润20例(66.7%),单纯胰内神经浸润5例(16.7%)。胰内与胰周神经丛浸润相关(Plt;0.05)。
神经浸润与患者年龄、性别、肿瘤大小、淋巴结转移、肿瘤部位之间均无相关性(P值均gt;0.05),但与JPS临床分期相关(Plt;0.05,表1)。
表1胰腺导管腺癌神经浸润及与临床病理参数的关系

临床病理参数例数神经浸润(例)阳性阴性P值年龄(岁)≥5022184lt;50871gt;0.05性别男19154女11101gt;0.05肿瘤部位胰头22193胰颈体尾862gt;0.05肿瘤大小(cm)≥4.013121lt;417134gt;0.05JPS分期Ⅰ、Ⅱ期413Ⅲ、Ⅳ期26242lt;0.05淋巴结转移阳性17143阴性13112gt;0.05
二、胰腺组织的LVD
胰腺癌、癌旁及正常胰腺组织内均有淋巴管分布,表现为内皮细胞D2-40染色阳性的微小管道结构,由单层内皮细胞构成,不规则开放,管壁较薄,管腔内无红细胞(图2),大多分布在间质组织中。而有红细胞填充的厚壁小血管对D2-40抗体呈阴性反应。胰腺癌内及癌旁淋巴管分布不均匀,一些淋巴管受肿瘤细胞压迫萎陷,直径及管腔均小于正常胰腺组织内淋巴管。正常胰腺组织内淋巴管多与间质内小胰管、血管及神经束伴行。
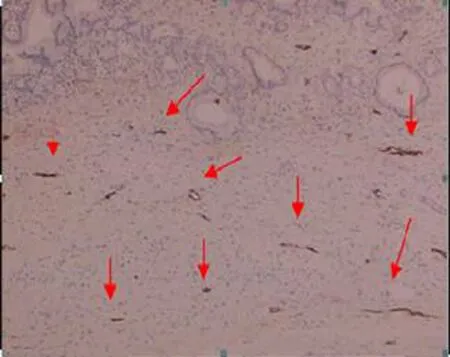
图2 癌旁区的淋巴管(免疫组化 ×40)
正常胰腺组织内平均LVD值为(10.8±4.4)个,癌旁组织为(11.3±6.9)个,癌组织为(4.2±3.4)个,其中5例(16.7%)胰腺癌组织内为阴性。癌组织的LVD值显著少于癌旁及正常胰腺组织(Plt;0.01),而正常胰腺组织与癌旁组织间无显著差异(Pgt;0.05)。
三、胰周神经丛浸润与淋巴管微转移的关系
18例(60.0%)胰腺癌患者在非癌组织中的淋巴管内发现肿瘤细胞浸润。即在D2-40染成棕黄色的淋巴管内有CK19染成红色的胰腺癌细胞(图3)。20例胰周神经丛浸润者中淋巴管肿瘤浸润16例,10例无胰周神经丛浸润者中淋巴管肿瘤浸润2例,两者明显相关(Plt;0.05)。
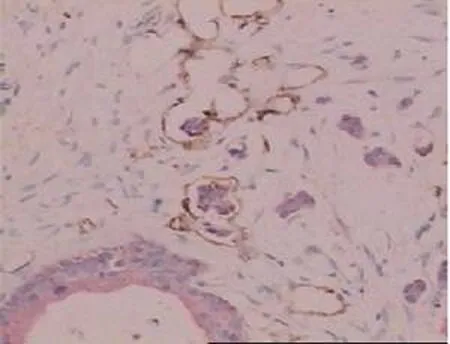
图3 癌旁区域淋巴管被肿瘤细胞浸润(免疫组化 ×100)
讨 论
近年来对胰腺癌生物学行为的研究表明,淋巴结转移与神经浸润是影响胰腺癌预后最重要的两个因素[5]。目前胰腺癌周围神经浸润研究的临床意义在于提高无远隔脏器转移的胰腺癌病例的手术切除率,减少术后复发,以期针对胰腺癌嗜神经生长的生物学特征,通过适当扩大区域淋巴结及周围神经丛清扫范围,使远期生存率得到提高,达到彻底治愈可切除病例的目的。
以往有学者提出,是否由于淋巴路途径导致神经浸润的发生。由于缺乏淋巴管特异性标记物,以往只能通过淋巴管注射染料或电子显微镜技术对淋巴管进行研究,但这存在着较大的局限性。本实验HE染色结果也说明常规染色方法难以对淋巴管形态学进行研究。因而胰腺癌组织内淋巴管分布一直是一个研究空白[6]。D2-40单克隆抗体与淋巴管上皮内一种唾液酸糖蛋白结合,已经被证实能够特异性识别头颈部鳞癌、乳腺癌及Kaposi肉瘤组织内淋巴管[7]。故本实验也采用该抗体。结果显示,胰腺导管腺癌组织中淋巴管分布存在一定的规律性,癌组织内的LVD显著低于癌旁及正常胰腺组织(Plt;0.01)。其原因可能为肿瘤细胞生长对周围淋巴管产生压力或直接侵入管腔,致其萎陷甚至溃破。此外,本组结果显示神经浸润与患者年龄、性别、肿瘤大小、肿瘤部位、淋巴结转移之间均无相关性。但与JPS临床分期相关。
我们曾报道在肠系膜上动脉周围神经丛内有网状淋巴管分布,肿瘤细胞有可能通过毛细淋巴管网浸润周围神经丛[8]。本实验在非癌组织中的淋巴管内也发现肿瘤细胞浸润,且胰周神经丛浸润与淋巴管肿瘤浸润之间有明显相关性(Plt;0.05)。表明胰腺癌能够诱导淋巴管生成,并可能通过该新生淋巴管通路浸润胰周神经丛。
[1] Zhu Z,Kleeff J,Kayed H,et al.Nerve growth factor and enhancement of proliferation,invasion,and tumorigenicity of pancreatic cancer cells.Mol Carcinog,2002,35:138-147.
[2] Kahn HJ, Marks A. A new monoclonal antibody,D2-40,for detection of lymphatic invasion in primary tumors. Lab Invest, 2002, 82: 1255-1257.
[3] Mohammed RA, Martin SG, Gill MS,et al. Improved methods of detection of lymphovascular invasion demonstrate that it is the predominant method of vascular invasion in breast cancer and has important clinical consequences.Am J Surg Pathol, 2007,31:1825-1833.
[4] Laser J,Cangiarella J,Singh B,et al.Invasive lobular carcinoma of the breast: role of endothelial lymphatic marker D2-40. Ann Clin Lab Sci,2008,38:99-104.
[5] Hirai I, Kimura W, Ozawa K, et al. Perineural invasion in pancreatic cancer.Pancreas,2002,24:15-25.
[6] Uomo G. Some more news on the metastatic pathway in pancreatic cancer.JOP,2005,13:42-46.
[7] Choi WW, Lewis MM, Lawson D, et al. Angiogenic and lymphangiogenic microvessel density in breast carcinoma: correlation with clinicopathologic parameters and VEGF-family gene expression. Mod Pathol, 2005, 18: 143-152.
[8] Jin G, Sugiyama M, Tuo H,et al. Distribution of lymphatic vessels in the neural plexuses surrounding the superior mesenteric artery.Pancreas,2006,32:62-66.
2008-11-21)
(本文编辑:屠振兴)
Lymphangiogenesisintheperineuralmicrometastasisofpancreaticadenocarcinoma
CHENGPeng,JINGang,HUXian-gui,CHENYing,LIURui,ZHANGYi-jie,SHAOCheng-hao,ZHOUYing-qi.
DepartmentofGeneralSurgery,ChanghaiHospital,SecondMilitaryMedicalUniversity,Shanghai200433,China
JINGang,Email:jingang@sh163.com
ObjectivesTo investigate the role of lymphangiogenesis in the perineural micrometastasis of pancreatic adenocarcinoma.MethodsThe clinical data of 30 pancreatic adenocarcinoma patients who were admitted from Sep. 2005 to Oct. 2006 for extended radical surgery were collected. The samples including pancreatic cancer, adjacent tissue, lower bile duct, pancreatic tail, the structure surrounding the SMA (peripancreatic nerve plexus) and lymph nodes were collected during operation. They were subjected to conventional pathological examination. The lymphatic capillaries weredetected by double immunohistochemical staining and the lymphatic vessel density (LVD) was measured.ResultsIntra-pancreatic and/or peri-pancreatic neural invasion was observed in 25 patients (83.3%), of which 20 were found to have both the peri-pancreatic and intra-pancreatic neural invasion. The other 5 only had the intrapancreatic neural fiber invasion and there was no single patient with peri-pancreatic neural fiber invasion only. Peri-neural invasion was not significantly associated with patients′ age, gender, lymph node metastasis, tumor size and the location (Pgt;0.05), but was obviously associated with JPS clinical staging (Plt;0.05). The mean intratumoral LVD was (4.2±3.4) per field, which was significantly lower than (11.3±6.9) per field of adjacent tissue and (10.8±4.4)per field of normal pancreatic tissue(Plt;0.01). The mean intratumoral LVD between adjacenttissue and normal pancreatic tissue was not statistically different. Lymphatic vessel invasion was observed in non-malignant tissues in 18 patients, and there was a distribution correlation between lymphatic vessel invasion and extra-pancreatic neural plexus invasion (Plt;0.05).ConclusionsThe incidence of peri-neural invasion was high, peri-neural invasion was associated with JPS clinical staging and lymphatic vessel invasion, which suggested the possibility of the cancer spreading by peritumoral lymphangiogenesis route into the peri-SMA neural plexuses.
Pancreatic neoplasms; Neoplasm metastasis; Lymphatic vessels; D2-40; Micrometastasis
10.3760/cma.j.issn.1674-1935.2009.06.001
国家自然科学基金(30772139)
200433 上海,第二军医大学长海医院普外三科(程鹏、金钢、胡先贵、刘瑞、张怡杰、邵成浩、周颖奇),病理科(陈颖)
金钢,Email:jingang@sh163.com
胰腺癌神经浸润被认为是判断胰腺癌预后的独立指标[1]。本文应用新型淋巴管上皮特异性抗体D2-40[2-4]检测胰腺导管腺癌组织中淋巴管的分布,探讨其与胰腺癌神经浸润的相关性。

