“溶液”中考新题速递
朱世友
一、考查对溶解度曲线的理解
固体物质的溶解度曲线可表示:某一物质在某温度时的溶解度;同一物质在不同温度时的溶解度;不同物质在同一温度时的溶解度;物质的溶解度受温度变化影响的大小等。灵活运用上述信息可顺利解决诸多相关问题。
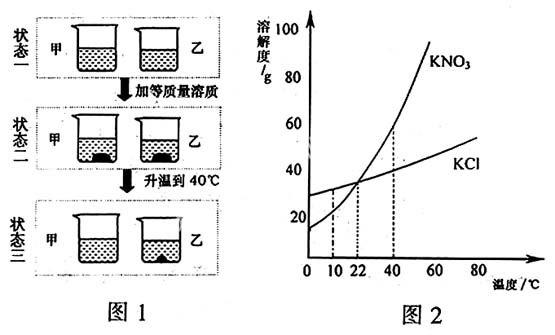
例1 (2008年山东东营)10 ℃时,在两个烧杯中分别盛有相同质量的硝酸钾和氯化钾饱和溶液;保持溶液温度不变,分别向其中加入等质量的相应溶质;再将温度升高到40 ℃,氯化钾和硝酸钾的溶解情况如图1所示。图2为两种物质的溶解度曲线。请仔细观察、分析图1和图2,回答下列问题:
(1) 烧杯甲盛放的是_______溶液。
(2) 状态三时,烧杯_______中溶剂水的质量相对较小。
答案:(1) 硝酸钾 (2) 乙
点拨: 从图1判断哪种物质的溶解度受温度变化的影响较大,再结合图2可确定具体物质是什么。
二、考查溶质质量分数的计算
例2 (2008年广东)20 ℃时,NaCl溶解于水的实验数据如下表。
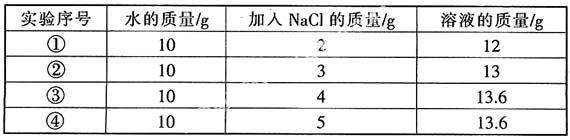
则下列叙述正确的是( )。
A. ②所得溶液是饱和溶液
B. 20 ℃时10 g水最多能溶解4 gNaCl
C. ③④所得溶液溶质质量分数相等
D. ①所得溶液溶质质量分数为20%
答案:C
点拨: 计算溶质质量分数时必须注意,已溶解的物质才能看做溶质,在溶解度范围内溶质质量分数的计算才有意义。结合化学方程式计算溶液中溶质的质量分数时,首先得找准溶液中的溶质,其次要用好质量守恒定律。
思考一下 (2008年北京)消毒剂在公共场所进行卫生防疫时发挥着重要的作用。过氧乙酸(CH3COOOH)是被广泛使用的高效消毒剂,它不稳定,易分解放出一种常见的气体单质,并生成醋酸(CH3COOH),该反应的化学方程式为_______;若一瓶久置的过氧乙酸溶液已完全分解,所得溶液中醋酸的质量分数为12%,则原溶液中过氧乙酸的质量分数为_______%(结果保留1位小数)。
答案:1. 2CH3COOOH=2CH3COOH+O2↑ 14.7
三、考查溶液的配制
例3 (2008年江苏泰州)下面①~⑤是小梅配制100 g溶质质量分数为12%的NaCl溶液的实验操作示意图。
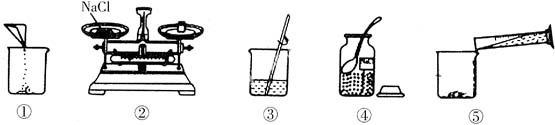
(1) 用如上图示的序号表示配制溶液的操作顺序_______。

(2) 小梅将配制好的溶液装入试剂瓶中,请你帮助她写好标签。
答案:(1) ④②①⑤③(2)

点拨: 同学们在配制溶液时,要学会分析错误操作可能导致怎样的结果,如:量水时俯视读数致使所配溶液的溶质质量分数偏大;称量固体质量时砝码与被称物位置颠倒,有可能使溶质的质量分数偏小等。
责任编辑/侯秀姣

