低氧、低氧耐力训练对大鼠肌球蛋白重链表达的影响
苏艳红 王瑞元 周 越
摘要:目的在于探讨低氧及低氧耐力训练条件下肌球蛋白重链(MHC)转换的方式,了解低氧及低氧运动下骨骼肌微细组成的改变。方法:选取SD大鼠30只,随机分为常氧对照组(NC)、低氧对照组(HC)和低氧训练组(HT)。HC组和HT组动物均生活在模拟海拔4000米高度的低氧舱中,HT组进行跑台练习,28天后取浅层胫前肌。RT睵CR方法测定四种MHC亚型mRNA表达,SDS睵AGE方法测定各种MHC亚型蛋白表达。结果:低氧及低氧运动均使MHC-Ⅱa 蛋白表达显著下降, MHC-Ⅱx和MHC-Ⅱb 蛋白表达显著升高;低氧影响MHC基因表达为MHC-Ⅱa mRNA显著升高,MHC-ⅠmRNA不显著下降;低氧运动使MHC-Ⅱb mRNA显著升高。结论:低氧及低氧训练使MHC蛋白和基因表达慢型向快型转化。
关键词:肌球蛋白重链;低氧;低氧运动
中图分类号:G804.2文献标识码:A文章编号:1007-3612(2008)07-0919-03
低氧环境已显示可引起骨骼肌形态学显著的改变,如毛细血管密度增加、平均肌纤维横截面积下降,同时线粒体数目、肌红蛋白明显增多,机体的有氧代谢能力得到改善。
伴随着代谢方式等一系列的改变肌纤维类型也可能会发生相应的调整。如Itoh[1]的研究表明雄性SD鼠置于模拟4 000 m低氧舱10周后,比目鱼肌快缩氧化糖酵解型肌纤维(FOG)增加,慢缩氧化型纤维(SO)减少;Bigard等对Wistar鼠4 000 m高度游泳训练14周的研究[2]显示,高海拔耐力练习引起快肌趾长伸肌(Extensor digitorum longus,EDL)和足底肌(Plantaris,PLA)Ⅱa型纤维增加,同时Ⅱb减少。
由于肌纤维分类方法的差异使得对于低氧及低氧耐力训练影响肌纤维组成的报道结果存在差异。现在常用的肌纤维分类方法有肌原纤维ATP酶(肌球蛋白ATP酶)、肌球蛋白重链(MHC)单克隆抗体免疫组化、肌球蛋白重链(MHC) 聚丙烯酰胺凝胶电泳等方法。
肌原纤维ATP酶(肌球蛋白ATP酶)的方法一般只能区分出Ⅱa、Ⅱb和Ⅰ三种肌纤维[3];免疫组化方法由于缺乏特异性的Ⅱx MHC抗体,目前还不能检测到Ⅱa与Ⅱx或Ⅱx与Ⅱb同时存在的纤维类型。肌球蛋白重链(MHC) 聚丙烯酰胺凝胶电泳的方法可以清晰地看到四种纯合的肌纤维(Ⅱa-MHC、Ⅱb-MHC、Ⅱd/x-MHC和Ⅰ-MHC),依其敏感性好、特异性强、可重复的特点广泛用于分离MHC。
Talmadge[4]总结多人研究结果发现,由MHC确定的肌纤维最大收缩速度顺序为Ⅰ<Ⅱa <Ⅱx <Ⅱb,除了收缩速度存在差异外,代谢特性也各不相同。因此,研究低氧及低氧耐力条件下MHC组成的改变对于了解低氧训练影响骨骼肌收缩特性具有重要意义。
1材料与方法
1.1实验动物与分组7周龄健康雄性Spraque Dawley(SD)大鼠30只,平均体重(210±20)g,购自河北医科大学实验动物中心,为国家二级卫生动物。饲养温度控制在(22±3)℃,动物自由进水进食,适应性喂养两天后,随机分为三组,每组10只:

常氧对照组(Normoxic Controls,NC)
低氧对照组(Hypoxic Controls,HC)
低氧训练组(Hypoxic Training,HT)
1.2训练方式HC组和HT组动物均生活在模拟海拔4 000 m高度的低氧舱中(氧浓度12.7%),每天至少保证22 h低氧时间。
低氧训练组经5 d跑台适应后,进入正式训练。训练在常氧条件下进行,训练方式为跑台练习:
跑台坡度+10°,跑速20 m/min,每天1次,每次1 h,每周训练6 d,28 d后取材。
1.3取材腹腔注射戊巴比妥钠麻醉(45 mg/kg),迅速剥离两侧浅层胫前肌,去除结缔组织,锡纸包叠后置于液氮中冻存。
1.4主要测试方法和仪器
1) 骨骼肌肌球蛋白重链(MHC)蛋白组成:
十二烷基硫酸钠-聚丙烯酰胺凝胶电泳方法(SDS-PAGE)。参照Talmadge(1993)[5]
2) 骨骼肌MHCⅠ、Ⅱa、Ⅱx/d、Ⅱb四个亚型mRNA 基因表达:(RT-PCR方法 )
低氧设备:HYPOXIC TRAINING SYSTEMS, Hypoxico Inc.(USA)
PCR引物设计:PCR引物由北京奥科生物技术有限责任公司设计、合成。
引物序列如下表:
1.5统计分析
采用SPSS11.5统计软件,利用多因素方差一般线性模型(GLM)LSD方法检验各组间是否有显著性差异,玃<0.05具有统计学的显著意义。
2结果
2.1低氧、低氧耐力训练对肌球蛋白重链(MHC)蛋白组成的影响
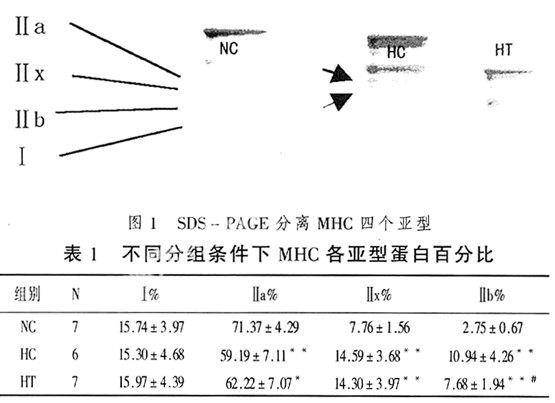
SDS-PAGE结果如图1所示,依各个亚型不同的电泳迁移速率由上向下依次为Ⅱa、Ⅱx、Ⅱb、Ⅰ。
由图1和表1,慢型MHCⅠ比例不受低氧和低氧训练的影响;低氧、低氧训练均显著降低了Ⅱa比例,其中低氧对照组下降幅度更明显(玃<0.01);低氧对照组(HC)、低氧训练组(HT)与常氧对照组(NC)比较,Ⅱx比例均明显增加(玃<001,P<0.01);Ⅱb的变化与Ⅱx相似,即低氧对照组和低氧训练组有显著升高的Ⅱb百分比,但低氧训练组升高幅度显著低于低氧安静组。
上述结果可以总结为:单纯低氧降低了Ⅱa MHC蛋白表达,取而代之的是Ⅱx和Ⅱb MHC表达升高,即低氧引起“慢型”MHC向“快型”转化;低氧训练的效果与单纯低氧变化趋势一致。
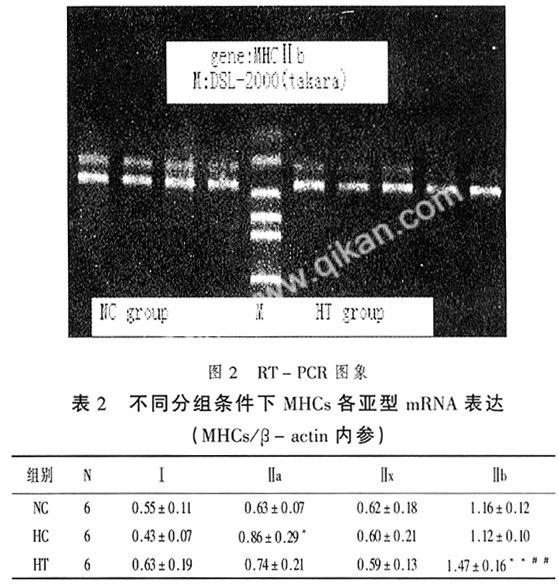
2.2低氧、低氧耐力训练对MHCs mRNA表达的影响
3讨论
3.1低氧、低氧耐力训练对肌球蛋白重链(MHC)蛋白组成的影响肌球蛋白是骨骼肌细胞中表达最多的蛋白,占总蛋白的25%,由两条重链和两对不同的轻链组成。因其具有ATP酶活性,所以又称肌球蛋白Ca2+-ATP酶,肌球蛋白Ca2+-ATP酶活性高低,直接决定肌纤维的收缩力量和速度。
成年骨骼肌有Ⅱa-MHC、Ⅱb-MHC、Ⅱd/x-MHC和Ⅰ-MHC四种类型,由MHC确定的肌纤维最大收缩速度顺序为Ⅰ<Ⅱa <Ⅱx <Ⅱb。
目前学者们对低氧的关注很多,但低氧对肌纤维和MHC组成的报道为数并不多,且研究结果也不尽相同。
如Bigard[6]将Wistar鼠置于模拟5 500 m海拔环境中4周,足底肌Ⅰ、Ⅱa型MHC显著下降,Ⅱb MHC增加;比目鱼肌Ⅰ型MHC显著下降,Ⅱa MHC增加。肌纤维转换方向与我们实验一致,一般来说,肌纤维的转换容易发生在快肌纤维间,Ⅰ和Ⅱ型间很难相互转变,Bigard的实验足底肌Ⅰ型MHC向Ⅱ型MHC转换可能由于低氧刺激严重引发的。
多数低氧影响比目鱼肌结果都是Ⅰ型MHC下降,Ⅱa增加,或者SO肌纤维下降同时FOG增加[7]。
尽管上述一些研究显示低氧引起慢型MHC向快型转化,但若形成缺氧不明显MHC和肌纤维组成不会改变。
如Perhonen[8]对于Wistar鼠2 250~2 500 m高度低氧跑台训练观察氧化酶活性增加的同时,体重下降,但肌原纤维ATP酶方法检测的肌纤维组成无明显变化。
低氧影响肌纤维和MHC组成受低氧高度的制约。模拟低氧高度低,造成组织缺氧不足,不能引起肌纤维和MHC改变。
慢性低氧引起肌组织中的氧压水平较低可能是引起肌纤维转化的一个有利因素。低氧一般会使快肌纤维表达增加,这些肌纤维多数在低氧压条件下工作,一方面是由于它们毛细血管供应不足,另一方面它们在高强度练习中易被募集。
慢性持续性低氧与运动引起的低氧不同,前者持续时间久,且造成缺氧程度高,这可能更适于Ⅱb等快肌纤维的表达,Ⅱb肌纤维以糖酵解为主,比氧化型纤维如Ⅰ或Ⅱa更易受局部低氧的影响。
耐力训练是一种增加负荷的训练,有研究报道负荷强度适宜、持续时间足够长的耐力训练会引起快型MHC向慢型转化。如有研究大鼠轮跑4周比目鱼肌Ⅰ型MHC显著增加。SD大鼠75%强度跑台训练10周的实验观察到训练时间大于60 min时比目鱼肌MHCⅠ显著增加,同时MHCⅡa下降[9]。Wistar鼠4周耐力练习(20 m/min,60 min/d,5d/周)[10]结果显示,足底肌MHCⅡb下降的同时MHCⅡa明显增加。
本实验中低氧耐力训练组MHCⅡa下降幅度低于低氧对照组,与此同时MHCⅡb升高幅度同样低于低氧对照组,这可能缘于耐力训练易引起快型MHC向慢型转化。
3.2低氧、低氧耐力训练对MHCs mRNA表达的影响RT-PCR方法测定的各种MHC mRNA是在转录水平观察MHC的变化。转录是蛋白合成的前提,转录水平的变化为蛋白水平的改变提供可能性。
低氧对MHC mRNA的影响表现为MHC-Ⅱa mRNA显著增加,MHC-ⅠmRNA不显著减少。许多关于低氧影响MHC蛋白组成的研究也表明低氧会使慢型MHC向快型转化。低氧影响MHC蛋白的结果显示MHC-Ⅱa向MHC-Ⅱx和MHC-Ⅱb转化,虽然低氧影响MHC蛋白和mRNA表达改变的具体MHC不同,但均显示快型MHC表达的增加。具体MHC不同的原因可能在于mRNA的增加能在刺激的即刻发生,其半衰期约为2~3 d,而相应蛋白的半衰期为2~3周[11],MHC表型的表达可能是MHCmRNA与蛋白不同时机上调和下调的结果。因而MHC表型表达与MHCmRNA间会出现错配的现象。除此之外,翻译或翻译后机制的调控也妨碍mRNA准确地表达蛋白活性[12-15]。
4结语
低氧及低氧耐力训练作为一种剧烈的缺氧刺激,不仅能增加骨骼肌毛细血管的分布,改善局部血液供应,增加有氧氧化酶活性,还能引起骨骼肌微细结构的改变,本研究显示快型肌球蛋白重链表达增加,基因和蛋白表达均有表现。肌球蛋白是骨骼肌内主要的结构蛋白和收缩蛋白,其组成的改变直接会影响到肌肉的收缩速度、收缩力量及其他代谢特性。此实验必将会对低氧训练的深入研究提供一有益的启示。
参考文献:
[1] Kazuo Itoh,Toshio Moritani,Koji Ishida,Chiyoko Hirofuji,Sadayoshi Taguchi,and Minoru Itoh. Hypoxia-induced fibre type transformation in rat hindlimb muscles[J].Eur J Appl Physiol. 1990, 60(5): 331-336.
[2] A.X.Bigard,A.Brunet,C.Y.Guezennec,and H.Monod.Skeletal muscle changes after endurance training at high altitude[J].J Appl Physiol. 1991,71(6):2114-2121.
[3] D.Pette,H.Peuker and R.S.Staron. The impact of biochemical methods for single muscle fibre analysis[J].Acta Physiol Scand.1999,166(4):261-277.
[4] Robert J.Talmadge.Myosin heavy chain isoform expression following reduced neuromuscular activity: potential regulatory mechanisms[J]Muscle Nerve. 23(5):661-679,2000.
[5] Robert J.Talmadge and Roland R.Roy. Electrophoretic separation of rat skeletal muscle myosin heavy-chain isoforms[J].J Appl Physiol.1993,75(5):2337-2340.
[6] A.X.Bigard, Sanchez,O.Birot, and B.Serrurier. Myosin heavy chain composition of skeletal muscles in young rats growing under hypobaric hypoxia conditions[J]. J Appl Physiol.2000,88(2): 479-486.
[7] Akihiko Ishihara, Kazuo Itoh, Yasuharu Oishi, Minoru Itoh,Chiyoko Hirofuji, Hitomi Hayashi. Effects of hypobaric hypoxia on histochemical fibre-type composition and myosin heavy chain isoform component in the rat soleus muscle[J].Pflüger Archiv-Eur J Physiol. 1995,429(5):601-606.
[8] Merja Perhonen, Timo E.S.Takala, Vuokko Kovanen. Effects of prolonged exposure to and physical training in hypobaric conditions on skeletal muscle morphology and metabolic enzymes in rats[J]. Pflügers Arch-Eur J Physiol. 1996, 432(1):50-58.
[9] Haydar A.Demirel, Scott K.Powers, Hisashi Naito, Michael Hughes, and Jeff S Coombes. Exercise-induced alterations in skeletal muscle myosin heavy chain phenotype:dose-response relationship[J].J Appl Physiol.1999,86(3):1002-1008.
[10] Takao Sugiura, Akio Morimoto, and Naotoshi Murakami. Effects of endurance training on myosin heavy-chain isoforms and enzyme activity in the rat diaphragm.[J].Pflügers Arch. 1992,421(1):77-81.
[11] Darryn S.Willoughby and Matthew J.Nelson. Myosin heavy-chain mRNA expression after a single session of heavy-resistance exercise[J].Med Sci Sports Exerc. 2002,34(8):1262-1269.
[12] 徐心浩.力量和耐力训练对肌球蛋白重链及肌纤维转型的影响[J].北京体育大学学报,2004,27(11):1492-1495.
[13] 潘同斌,王瑞元,袁建琴,等.慢性低氧及跑台训练对大鼠骨骼肌肌球蛋白重链(MHC—亚型基因表达的影响[J].北京体育大学学报,2005,28(1):57-59.
[14] 王瑞元,苑玉和,冯炜权.次力竭性离心运动后大鼠骨骼肌MHC各同功型基因表达及针刺对其影响[J].北京体育大学学报,2002,25(2):189-190.
[15] 毛杉杉,潘同斌,王瑞元.低氧诱导因子-1与低氧训练的调控机制[J].北京体育大学学报,2005,28(9):1227-1229.

