生草对滇中苹果园土壤酶活性和微生物群落多样性的影响





摘要:为探究不同生草处理对滇中苹果园土壤酶活性和微生物群落多样性的影响。本研究选取南方果园常见的光叶紫花苕(Vicia villosa),菊苣(Cichorium intybus)和鼠茅草(Vulpia myuros)3种牧草,以自然生草(CK1)和清耕(每月人工除草一次,CK2)处理为对照,测定0~30 cm耕层土壤酶活性及微生物群落多样性。结果表明,与清耕相比,人工生草改善了土壤理化性状。光叶紫花苕处理土壤过氧化氢酶,蔗糖酶和脲酶活性显著提高,增幅分别为12.70%,45.30%,45.45%。土壤微生物群落数量以菊苣处理提升显著,细菌数量增幅为42.76%(较CK1),49.02%(较CK2);真菌数量增幅为49.76%(较CK1),42.28%(较CK2)。土壤微生物中变形菌门(Proteobacteria)和子囊菌门(Ascomycota)占据主导地位,放线菌门(Actinobacteria)和酸杆菌门(Acidobacteriota)主导了酶活性对土壤酸碱度的响应。此外,土壤含水量、pH、全氮及全钾含量是影响滇中苹果园土壤养分及酶活性的重要因子。
关键词:果园生草;土壤理化性状;土壤酶活性;土壤微生物;相关性分析
中图分类号:S154.3" " " " 文献标识码:A" " " " 文章编号:1007-0435(2025)02-0419-10
Effects of Grass Cultivation on Soil Enzyme Activity and Microbial Community Diversity of Apple Orchards in Dianzhong Area of China
YANG Jin-peng1,2, MU Lan3, QIU Jia-yue1,2, WU Zong-ye1,2, ZHANG Xin-liang1,2,
ZHANG Mei-yan2, CAI Ming2*, HUANG Bi-zhi2*
(1.Faculty of Animal Science and Technology, Yunnan Agricultural University, Kunming, Yunnan Province 650201, China;
2.Academy of Grassland and Animal Science, Kunming, Yunnan Province 650212, China;3.College of Landscape and Horticulture,
Southwest Forestry University, Kunming, Yunnan Province 650224, China)
Abstract:To investigate the impacts of different grass cultivation treatments on soil enzyme activities and microbial community diversity of apple orchards in Dianzhong area, we selected three common forage species in southern China, including Vicia villosa, Cichorium intybus, and Vulpia myuros, with natural grass (CK1) and clean tillage (with monthly manual weeding, CK2) as controls. Soil enzyme activities and microbial community diversity were assessed in the 0-30 cm soil layer. The results showed that compared with CK2, artificial grass improved the soil physicochemical properties. The Vicia villosa treatment showed the most significant increase in soil catalase, sucrase, and urease activities by 12.70%, 45.30%, and 45.45%, respectively. Moreover, The population size of soil microbial communities significantly increased in Cichorium intybus treatment, and the number of bacteria increased by 42.76% (compared with CK1) and 49.02% (compared with CK2), and the number of fungi increased by 49.76% (compared with CK1) and 42.28% (compared with CK2). In conclusion, Proteobacteria and Ascomycota dominated soil microorganisms, while Actinobacteria and Acidobacteriota dominated the responses of enzyme activity to soil pH. Additionally, soil moisture content, pH, total nitrogen and total potassium content were important factors affecting soil nutrient and enzyme activities in apple orchards in Dianzhong area.
Key words:Orchard grass cultivation;Soil physicochemical properties;Soil enzyme activity;Soil microbe;Correlation analysis
果园生草是指在果树行间或株间进行人工牧草种植或自然生草的一种土壤管理制度[1],具有改善土壤结构和理化性状,调节小气候,提高果实品质等作用[2-4]。渭北旱地苹果园种植白三叶(Trifolium repens),多年生黑麦草(Lolium perenne)以及攀枝花地区芒果园种植紫云英(Astragalus sinicus)均可显著降低0~60 cm土层土壤容重,提高土壤总孔隙度[5-6],对改变土壤机械组成,提高田间持水量和通气性具有重要作用。研究表明生草覆盖可有效提高果园土壤中全氮,全磷,全钾,有机质和速效养分等含量[7-9],且0~20 cm土层土壤有机质和速效养分含量均高于20~40 cm土层土壤,同时随年限增加效果显著。有关果园生草措施对土壤酶活性和微生物群落地影响机制研究已成为当今果园生草领域的研究热点之一。土壤酶和微生物具有分解有机物,促进养分循环,维持土壤生态平衡等作用,可直观反映土壤健康状态。土壤酶主要来自微生物和动植物残体,参与物质代谢和能量转化,是土壤中最为活跃的有机成分之一,其活性高低与土壤肥力和微生物活动密切相关[10],研究表明秦岭北麓猕猴桃园和陕西渭北柿子园种植白三叶可提高土壤过氧化氢酶、蔗糖酶和脲酶活性[11-12],其中浅层(0~20 cm)土壤酶活性提升效果优于深层(20~40 cm)土壤,因动植物残体和微生物等富集在近表层土壤,加强该区域酶的作用底物,从而提高酶活性。
此外,生草还可提高土壤微生物数量,且效果随人工牧草种植年限增加而提高[13]。陇东地区苹果园套种紫花苜蓿(Medicago sativa),鸭茅(Dactylis glomerata)和白三叶可显著提高土壤真菌Alpha多样性[14],以紫花苜蓿表现最佳,因其利于土壤有机碳和养分积累,利于土壤真菌生长繁殖,从而提高相对丰度。关中地区猕猴桃园混播紫云英,多年生黑麦草和毛苕子(Vicia villosa Roth.)可改变土壤细菌组成,提高细菌Beta多样性及群落之间相互作用关系,降低差异代谢通路代谢功能[15],豫西黄土高原苹果园单播毛苕子可提高土壤养分含量和线虫总丰度[16],表明生草有助于改善果园土壤微生态环境。而土壤微生物是植物根系与土壤之间养分转化和运输的重要介质,直接影响植物生长和土壤生态功能[17]。
探明生草后土壤酶活性和微生物群落变化特征,对深刻理解果园生草模式对土壤健康状态和生态功能调节机制具有重要意义。目前,果园生草领域相对缺乏南方果园土壤的系统研究,云南省果园面积超过73万hm2,在如此大面积的果园内利用行间空地种植牧草,对提高果实品质,缓解牧草供应不足的问题具有重要意义。本研究以云南曲靖矮砧密植苹果园土壤为研究对象,播种光叶紫花苕(Vicia villosa),菊苣(Cichorium intybus)和鼠茅草(Vulpia myuros),并设置自然生草和清耕作为两组对照,探究不同生草处理对苹果园土壤理化性状,酶活性和微生物群落多样性的影响,以期为云南同类地区的果园生草的科学管理模式提供理论依据和技术支撑。
1 材料与方法
1.1 试验地概况与试验设计
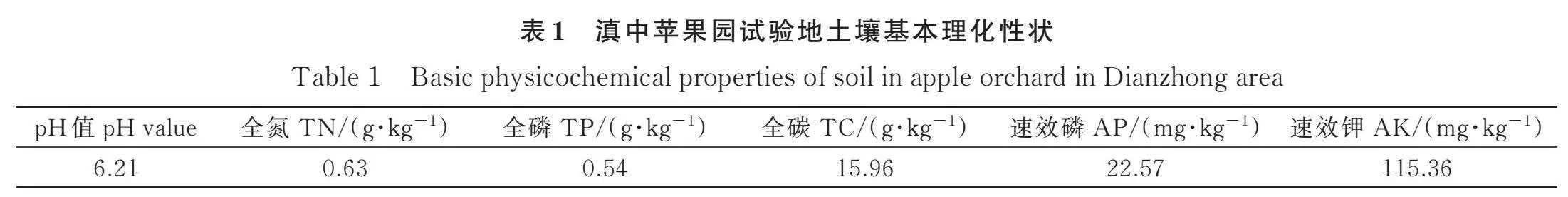
试验小区位于云南省曲靖市马鸣乡的果园种草示范基地(25°31′38″ N,103°38′72″ E)。该试验站海拔约1992 m,属亚热带季风气候,年平均气温 13.6℃,最热月平均温度21℃,最冷月平均温度 5℃,平均无霜期260 d,年均降雨量1032 mm,降雨集中在5—10月,具有季节性干湿分明特点,年均蒸发量1500~2000 mm,年日照时数1985 h以上,土壤以红壤和黄壤为主,呈微酸性,土质较为疏松,肥力中等[18],基本理化性状如表1所示。
试验地为矮砧密植苹果园,果树建植4 a,品种为‘瑞香红’(Malus domestica ‘Ruixianghong’),果树行距4 m,株距1 m,树下培土起垄(宽1 m,高40 cm)并覆黑膜。2023年5月中旬对果树行间土壤翻耕(深30 cm)、晾晒并清除杂草后条播撒种,种草样地小区长20 m,宽2.5 m,设5个处理:①自然生草(CK1)主要群落为马唐(Digitaria sanguinalis)、牛膝菊(Galinsoga parviflora)、藜(Chenopodium album)、稗草(Echinochloa crus-galli)、鬼针草(Bidens pilosa)等;②清耕(CK2),小区土壤翻耕后进行裸地管理,③光叶紫花苕(GY),播种量105 kg·hm-2;④菊苣(JY),播种量7.5 kg·hm-2;⑤鼠茅草(SY),播种量21 kg·hm-2。
1.2 样品采集
于2024年3月牧草初花期在试验小区内用40 mm土钻以“S”型5点取样取0~30 cm耕层土壤。去除表层杂质后每小区的5个土样混合均匀,采用4分法取500 g土样带回实验室。每个处理小区3次重复,所有新鲜土样分成2份。一部分土样自然风干,过1 mm筛,用于测定土壤酶活性,另一部分土样过2 mm筛,置于干冰盒内,带回实验室于-80℃ 液氮中保存,用于测定土壤细菌,真菌多样性及群落结构。取样过程中,每处理小区随机选取3个采样点,去除2 cm左右的土壤表层后环刀取土,用于测定土壤容重。
1.3 土壤理化性状、养分含量及酶活性的测定
土壤容重(BD)采用环刀法测定,含水量(SM)采用烘干法((105±2)℃烘烤48 h)测定,孔隙度(SP)采用干重法测定,pH采用pH计测定(水土比为2.5∶1)。全氮(TN)采用凯氏定氮法测定,速效磷(AP)采用碳酸氢钠浸提-钼锑抗比色法测定,速效钾(AK)采用乙酸铵浸提-火焰光度法测定[19]。土壤酶活性采用北京盒子生工科技有限公司生产的试剂盒测定,过氧化氢酶(CAT):测定其分解H2O2时反应溶液在240 nm处吸光值的变化速率,以24 h后1 g风干土样催化降解的H2O2(mg)表示;蔗糖酶(SUC):测定其催化蔗糖降解产生的还原糖与3,5-二硝基水杨酸反应后产生的棕红色氨基化合物在540 nm处的吸光值,以24 h后1 g土样中产生的还原糖(mg)表示;脲酶(URE):测定其水解尿素生成的NH3-N在强碱性介质中与次氯酸钠和苯酚反应后产生的水溶性蓝色染料靛酚蓝在630 nm处吸光值,以24 h后1 g土样中的NH3-N质量(mg)表示。
1.4 土壤微生物多样性的测定
土壤微生物多样性测序,采用TGuide S96磁珠法从土壤样品中提取总基因组DNA。扩增后产物在1.8% 琼脂糖凝胶电泳上验证,并使用 Nano Drop 2000 UV-紫外分光光度计 (Thermo Scientific, Wilmington, USA)检测DNA浓度和纯度。测序信息如表2所示,PCR在10 μL的总反应体积下进行:基因组DNA 5-50 ng,上游引物(10 μmol)0.3 μL,下游引物(10 μmol)0.3 μL,KOD FX Neo Buffer 5 μL,dNTP(2 mmol each)2 μL,KOD FX Neo 0.2 μL,ddH2O补充至10 μL。PCR反应条件:95℃ 5min,95℃ 30 s,50℃ 30 s,72℃ 40 s,72℃ 7 min并循环20次。使用Omega DNA试剂盒(Omega Inc.,Norcross,GA,USA)纯化扩增产物,Qsep-400(BiOptic,Inc.,New Taipei City,Taiwan,ROC)进行定量。扩增子文库在Illumina novaseq6000上进行双端测序(2×250)。
1.5 数据分析
采用Excel进行数据整理,SPSS 24.0对数据检验正态分布和方差齐性后进行单因素方差分析,多重比较采用LSD法,数据以“平均数±标准误”表示。相关性分析采用Origin 2021中Correlation Plot绘制。土壤微生物多样性数据是基于 Illumina NovaSeq平台制造商的建议测序, 通过QIIME2 2020.6[20]进行过滤去噪,使用KRONA v2.6对物种注释结果进行可视化展示Alpha多样性反映单个样品物种丰富度及物种多样性,使用QIIME2 2020.6软件对样品Alpha多样性指数进行评估并计算Ace,Chao1,Simpson,Shannon;Beta 多样性由QIIME2 2020.6计算,采用R语言包绘制,样品间距离热图基于Heatmap距离算法,通过R语言工具绘制样品热图并用Origin 2021中Heat Map with Dendrogram调节色块。
2 结果与分析
2.1 不同生草处理对苹果园土壤理化性状和养分含量的影响
如表3所示,与CK1相比,JY处理的土壤pH值显著升高(Plt;0.05),GY,JY,SY处理的SM,TN含量显著升高(Plt;0.05)。与CK2相比,GY,JY处理的土壤pH值显著升高(Plt;0.05),增幅分别为5.04%,10.87%。GY,JY,SY处理的SM,AK含量显著升高(Plt;0.05),其中GY处理提升效果更佳,增幅分别为54.02%,22.02%。4种生草处理TN含量均显著升高(Plt;0.05),依次为JYgt;GYgt;SYgt;CK1。GY处理的AP含量显著高于CK2(Plt;0.05),CK1处理的土壤pH值,SM,TN和AP含量显著高于CK2(Plt;0.05)。
2.2 不同生草处理对苹果园土壤酶活性的影响
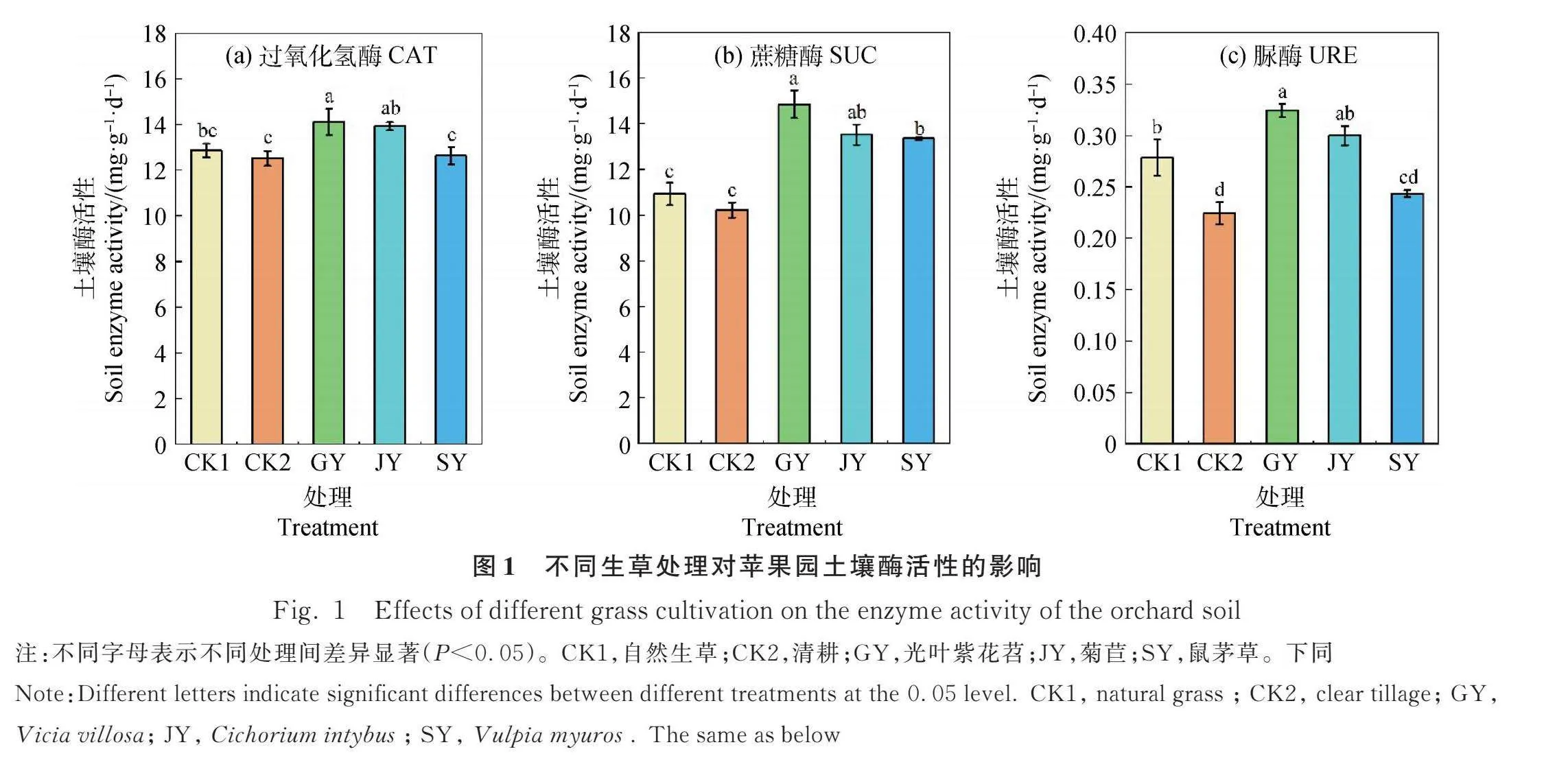
由图1可知,与CK1相比,GY处理的CAT,SUC,URE活性及JY处理的SUC活性均显著提高(Plt;0.05)。与CK2相比,GY,JY处理的CAT,SUC,URE活性均显著提高(Plt;0.05),其中GY处理提升效果更佳,增幅分别为12.70%,45.30%,45.45%。SY处理的SUC活性显著高于CK1和CK2(Plt;0.05),增幅分别为22.25%,30.63%。CK1处理的CAT,SUC,URE活性均高于CK2,以URE活性提升效果显著(Plt;0.05),增幅为27.27%。
2.3 滇中苹果园土壤理化性状和养分含量与酶活性相关性分析
相关性分析结果表明(图2),SM,pH与CAT,URE呈显著正相关关系(Plt;0.05),TN,AK与SUE呈显著正相关关系(Plt;0.05),SM与SP,AP,AK呈显著正相关关系(Plt;0.05);TN与SP呈显著负相关关系(Plt;0.05),可见土壤理化性状和养分含量与相关酶活性之间存在紧密联系,相互影响并共同起到调节作用。
2.4 不同生草处理对苹果园土壤微生物多样性OTU相关性分析
对细菌16S rRNA V3+V4区域测序后得到总有效序列数1 162 029,获得读数1 082 672条,对真菌its1区域测序后得到总有效序列数1 167 014,获得读数964 135条,在相似度大于97%的水平下将其统计为不同处理的OTU(Operational Taxonomic Units )信息,得到土壤细菌和真菌在不同生草处理环境下的主要微生物。共产生25493个土壤细菌OTU和9762个土壤真菌OTU ,其中土壤细菌共有的OTU个数为79,而土壤真菌共有的OTU个数为180(图3)。关于细菌(图3a),CK1,GY和JY处理的土壤细菌OTU个数高于CK2,且以JY效果最佳,为6591个,分别高于CK1和CK2 42.76%、49.02%;GY,CK1处理较CK2分别提高了24.69%,4.39%的OTU个数。土壤真菌在不同生草处理下也表现出不同OTU个数(图3b),GY、JY和SY处理土壤真菌OTU个数均高于CK1和CK2,以JY效果最佳,为2507个,SY次之,为2028个,GY最低,为1791个,3种处理土壤真菌OTU个数分别比CK1高49.76%,21.15%,6.99%,比CK2高42.28%,15.10%,1.65%;CK1处理土壤真菌OTU个数比CK2低4.99%。
2.5 不同生草处理对苹果园土壤微生物Alpha多样性分析
本试验对5组处理的测序覆盖度均大于99.92%,证明本次试验测序数据可较为全面地表示土壤微生物群落结构组成。如表4所示,不同生草处理间土壤细菌和真菌Ace,Chao1,Shannon指数存在差异,而Simpson指数在各组间差异不大。CK1,GY,JY,SY处理土壤细菌和真菌Ace,Chao1指数均高于CK2,以JY处理最高,依次为GYgt;CK1gt;SYgt;CK2。
2.6 不同生草处理对苹果园土壤微生物群落Beta多样性分析
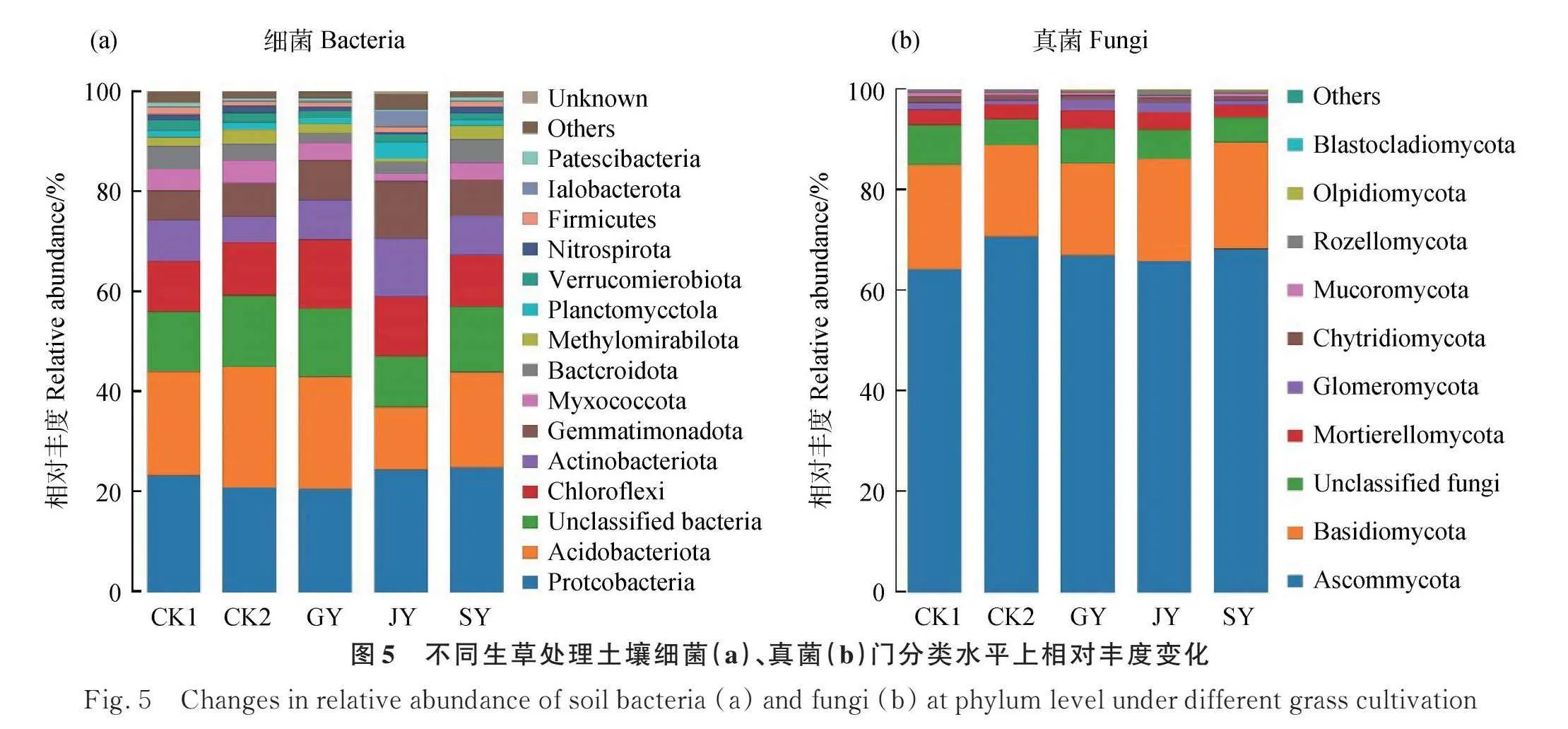
由图4可知,选取细菌,真菌在门水平下的分类(单元gt;15),如细菌浮霉菌门(Planctomycetoa),芽单胞菌门(Gemmatimonadota),甲基异硝酸还原菌门(Methylomirabilota),变形菌门(Proteobacteria)和厚壁菌门(Firmicutes);真菌土霉菌门(Mortierellomycota),球囊菌门(Glomeromycota),子囊菌门(Ascomycota),芽枝霉门(Blastocladiomycota)和壶菌门(Chytridiomycota)。不同生草处理土壤细菌,真菌在门水平下横向聚类后,样品从CK1到JY处理颜色差异显著,颜色由蓝色到红色表示样品间距离由近到远。如图4a所示,土壤细菌方面,JY处理浮霉菌门(Planctomycetoa),芽单胞菌门(Gemmatimonadota) 和SY处理甲基异硝酸还原菌门(Methylomirabilota)群落丰度高于其他生草处理,CK1变形菌门(Proteobacteria)群落丰度高于其他处理,CK2厚壁菌门(Firmicutes)群落丰度高于其他处理。如图4b所示,土壤真菌方面,GY处理土霉菌门(Mortierellomycota),JY处理球囊菌门(Glomeromycota),SY处理子囊菌门(Ascomycota)群落丰度高于其他生草处理,CK1芽枝霉门(Blastocladiomycota)群落丰度高于其他处理,CK2壶菌门(Chytridiomycota)群落丰度高于其他处理。
2.7 不同生草处理对苹果园土壤微生物群落相对丰度组成分析
根据测序结果对各物种注释,并选择样品在门水平上丰度排前15的优势物种,制作土壤细菌、真菌物种分布柱状图。图5a中,土壤细菌在门水平上排前8的是变形菌门(Proteobacteria),酸杆菌门(Acidobacteriota),绿弯菌门(Chloroflexi),放线菌门(Actinobacteriota),芽单胞菌门(Gemmatimonadota),黏细菌门(Myxococcota)[21] ,拟杆菌门(Bacteroidota)和甲基异硝酸还原菌门(Methylomirabilota),生草处理土壤放线菌门和绿弯菌门较CK1,CK2群落丰度增加较多,JY处理放线菌门增加最多,是CK1的1.43倍,是CK2的2.25倍;而酸杆菌门,黏细菌门较CK1,CK2群落丰度降低,尤其在JY中最为明显,较CK1分别降低了39.61%,64.29%,较CK2分别降低了48.13%,67.39%。
图5b中,土壤真菌在门水平上排前5的是子囊菌门(Ascomycota),担子菌门(Basidiomycota),土霉菌门(Mortierellomycota),球囊菌门(Glomeromycota)和壶菌门(Chytridiomycota)。GY,JY,SY处理担子菌门相对丰度均高于CK2,分别提高了0.55%,12.15%,16.57%。与对照相比,GY处理球囊菌门群落相对丰度增加最多,是CK1的1.50倍,是CK2的2.33倍,而生草处理子囊菌门和壶菌门群落相对丰度呈降低趋势,SY处理壶菌门群落相对丰度降低最明显,较CK1降低了46.15%,较CK2降低了30.00%。
3 讨论
3.1 不同生草处理对苹果园土壤理化性状和养分含量的影响
与清耕相比,3种人工生草处理降低了0~30 cm土层土壤容重,提高了土壤孔隙度,与王迅等[22]在四川柑桔园内生草的研究结果一致,种植光叶紫花苕和鼠茅草均可降低土壤容重,提高总孔隙度。本研究中自然生草和3种人工生草处理下的土壤含水量与清耕相比显著升高,且人工生草效果优于自然生草,与已有研究结果一致[23-25],与传统清耕模式相比,生草后果园土壤含水量得到有效提升,牧草根系活动改善了土壤团聚体稳定性[26],提高孔隙度,增强对雨水的吸附和储存能力。但也有研究表明生草后土壤含水量会呈现降低趋势[27-28],生草后增加了地表植被覆盖率,而水分不足时会加剧牧草与果树间的水分竞争,过多消耗浅层土壤水分,因此林草耦合系统构建要注意减少水肥竞争,可通过控制和调整牧草种植带宽度减少牧草自身水分蒸发[29],以减少对土壤水分的消耗。自然生草能够保留果园内良性杂草,消除恶性杂草,起到调节生态环境的作用[30],本研究表明,与清耕相比,自然生草和人工生草提高了0~30 cm土层土壤全氮,速效磷和速效钾含量,人工生草效果优于自然生草,且种植光叶紫花苕对提高土壤养分含量效果更佳,这与秦秦等[8]和张朋朋等[31]研究结果一致,二者分别于上海猕猴桃园和陕北苹果园进行生草研究后表明,生草显著提高了0~40 cm土层土壤养分含量,这是由于生草后增加了土壤中植物残体和凋落物的生物量,促进浅层土壤微生物分解腐殖质,加快速效养分含量变化[32],有利于土壤有机质和速效养分的积累[33-34]。本研究所处试验地区土壤呈弱酸性,与清耕相比,自然生草和人工生草显著提高了土壤pH值,且人工生草处理的提高幅度大于自然生草,其中菊苣处理将土壤pH值调节为弱碱性。韦鑫等[35]研究表明,贵州梨园生草光叶紫花苕可将土壤pH值由4.85调节为5.84,向减弱土壤酸性的趋势变化,而王迅等[22]研究表明,种植鼠茅草可将土壤pH值由7.82调节为7.02,向减弱土壤碱性的趋势变化。生草对土壤pH值起到调节作用,可有效降低碱性土壤pH值[36],提高酸性土壤pH值[37],使其向着利于果树生长的方向变化。
3.2 不同生草处理对苹果园土壤酶活性的影响
土壤酶参与生物化学过程,其活性可直观反映土壤中物质转化和生物活动状况,通常作为土壤健康状况和质量的重要评价指标[38],果园生草可显著提高土壤脲酶,磷酸酶,蔗糖酶,过氧化氢酶和纤维素酶的活性[12,39]。本研究表明,与清耕相比,3种人工生草处理均提高了土壤过氧化氢酶,蔗糖酶和脲酶活性,且光叶紫花苕处理土壤过氧化氢酶和脲酶活性最高,鼠茅草处理土壤蔗糖酶活性最高,这与侯宇辉等[40]研究结果相似,生草后土壤蔗糖酶和脲酶活性显著升高,以光叶紫花苕效果最佳,可能是生草后枯草掉落物及土壤腐殖成分引起微生物群落多样性及丰度增加,进而影响到酶活性[41]。本研究中自然生草处理土壤蔗糖酶和脲酶活性均高于清耕,且3种人工生草处理对酶活性的提升效果优于自然生草,这与葛永申等[9]研究结果一致,其认为间作光叶紫花苕和油菜的土壤蔗糖酶和脲酶活性高于自然生草。但对过氧化氢酶影响不一致,其中光叶紫花苕和菊苣处理土壤过氧化氢酶活性略高于自然生草小区,而种植鼠茅草的土壤过氧化氢酶活性略低于自然生草小区,这可能是该时期鼠茅草正处于生长后期,易枯萎倒伏并覆于地表[42],自身生物量较低,植株长势较弱,参与土壤物质转化,有机质形成等能力较弱,进而影响土壤中过氧化氢酶活性。土壤过氧化氢酶参与化合物氧化,蔗糖酶参与有机体循环,脲酶促进有机质分子肽键水解[43-44],且酶活性并非长期处于高度活跃状态,其会随着时间推移或果树生育期的变化而呈现不同的趋势[45]。土壤理化性状和养分含量与相关酶活性之间相互联系,相互作用,形成一个有机的整体,共同调节果园土壤养分利用与转化,进而影响果树及果实的生长发育。
3.3 不同生草处理对苹果园土壤耕层微生物多样性的影响
土壤微生物是土壤酶的主要来源之一,可将土壤中的植物根系、凋落物及残体腐殖质等有机大分子分解转化成可供植物吸收利用的单体,进而形成改变土壤中营养物质的转化途径[46-47],微生物多样性常被作为评价土壤营养物质转化活跃度和循环强度的重要指标[48]。本研究表明,苹果园种植光叶紫花苕,菊苣和鼠茅草均能提高门水平下土壤细菌,真菌丰度和群落多样性,与清耕相比,生草处理土壤细菌浮霉菌门,芽单胞菌门,变形菌门和甲基异硝酸还原菌门丰度增加。芽单胞菌门具有典型的植物促生作用,可进行生物固氮并诱导植物分泌激素,进而提高土壤肥力或抑制病原生长[49];而甲基异硝酸还原菌是厌氧菌,能够利用甲烷和亚甲基化合物进行亚硝酸盐还原,从而参与到土壤硝化作用中,有助于维持土壤中氮循环的平衡。这表明生草处理可通过调节土壤微生物活动促进养分循环,提高肥力,并与植物互作进行生物防治。此外,不同生草处理可通过改变微生物群落结构进而调节土壤pH值[50-51],本研究发现,生草后的土壤酸杆菌门丰度较清耕处理有所降低,放线菌门丰度较清耕处理有所增加,同时土壤pH值由弱酸性向弱碱性变化,而在其他研究中,土壤pH值向弱酸性变化的同时,土壤中放线菌门丰度降低[52],酸杆菌门丰度增加[53]。放线菌适宜生长在中性偏碱性土壤中[54],酸杆菌门为嗜酸菌,适宜生长在中性偏酸性土壤中[55],表明酸杆菌门和放线菌门的丰度变化和土壤pH值具有较强的相关性。二者在土壤物质循环和生态环境构建中具有重要的生态学作用,对于土壤酸碱度的变化有一定影响,关于2种菌与土壤pH值间的影响机理还需做进一步研究。
与清耕相比,自然生草处理土壤真菌Shannon指数差异不显著,与姜莉莉等[56]研究结果一致,连续3 a生草后土壤真菌Shannon指数变化不大,人工生草土壤真菌Shannon指数随年限下降。生草可提高土壤真菌Chao1指数和Shannon指数,以及土壤真菌子囊菌门,担子菌门及接合菌门的丰度[57]。本研究表明,人工生草处理土壤真菌土霉菌门,球囊菌门,子囊菌门和芽枝霉门丰度有所增加,但不显著,这可能与土壤真菌在有机物分解过程中起主要作用[58],其适应性强,稳定性较高等因素有关。人工生草后将土壤细菌转变为以变形菌门为主的物种,将真菌转变为以子囊菌门为主的物种,表明变形菌门和子囊菌门在人工生草的体系结构中起到至关重要的作用。
4 结论
生草改善了滇中地区苹果园土壤理化性状,提高了酶活性和微生物多样性。土壤真菌比细菌更具稳定性和适应性,其中细菌的变形菌门和真菌的子囊菌门占据主导地位,放线菌门和酸杆菌门协同作用,主导了酶活性对土壤酸碱度的响应。此外,土壤含水量,pH,全氮及全钾含量是影响滇中苹果园土壤养分及酶活性的重要因子。综合而言,生草对改善滇中地区苹果园土壤质量和微域环境具有重要作用,且种植光叶紫花苕和菊苣效果显著。
参考文献
[1] 寇建村,杨文权,韩明玉,等. 我国果园生草研究进展[J]. 草业科学,2010,27(7):154-159
[2] 曹铨,沈禹颖,王自奎,等. 生草对果园土壤理化性状的影响研究进展[J]. 草业学报,2016,25(8):180-188
[3] 韦鑫,张朝权,谢彩云,等. 生草对梨园温度和果实产量与品质的影响[J]. 贵州农业科学,2023,51(10):108-114
[4] GUO Z, LIU H, ZHOU W, et al. Characteristics of phosphorus losses due to surface runoff in a peach orchard and the effects of inter-planting white clover (Trifolium repens L.) on fruit yield and quality[J]. Feb-Fresenius Environmental Bulletin,2016,25(12):5516-5527
[5] 李会科,张广军,赵政阳,等. 生草对黄土高原旱地苹果园土壤性状的影响[J]. 草业学报,2007,16(2):32-39
[6] 刘伟,罗玲,钟奇,等. 生草和地布覆盖对攀枝花地区芒果园土壤性质及果实品质的影响[J]. 应用与环境生物学报,2021,27(2):261-270
[7] 王依,陈成,马拦妮,等. 行间生草对秦岭北麓猕猴桃园土壤养分、pH值的影响[J]. 中国农学通报,2019,35(15):59-65
[8] 秦秦,宋科,孙丽娟,等. 猕猴桃园行间生草对土壤养分的影响及有效性评价[J]. 果树学报,2020,37(1):68-76
[9] 葛永申,岳绪国,万春雁,等. 果园不同生草方式对土壤养分及微生物的影响[J]. 扬州大学学报(农业与生命科学版),2024,45(2):42-50
[10] 刘善江, 夏雪, 陈桂梅,等. 土壤酶的研究进展[J]. 中国农学通报,2011,27(21):1-7
[11] 井赵斌,李腾飞,龙明秀,等. 生草对猕猴桃果园土壤酶活性和土壤微生物的影响[J]. 草业科学,2020,37(9):1710-1718
[12] 左玉环,刘高远,杨莉莉,等. 陕西渭北柿子园种植白三叶草对土壤养分和生物学性质的影响[J]. 应用生态学报,2019,30(2):518-524
[13] WHITELAW-WECKERT M A, RAHMAN L, HUTTON R J, et al. Permanent swards increase soil microbial counts in two Australian vineyards[J]. Applied soil ecology,2007,36(2/3):224-232
[14] 钱雅丽,王先之,来兴发,等. 多年生牧草种植对苹果园土壤真菌群落特征的影响[J]. 草业学报,2019,28(11):124-132
[15] 谭华,靳旭妹,蔡明明,等. 生草对关中地区有机猕猴桃园土壤理化性质及细菌群落的影响[J]. 草地学报,2024,32(3):667-676
[16] 包涵,吕丹丹,施赟,等. 豫西黄土高原果园生草对土壤线虫群落及结构的影响[J]. 草地学报,2024,32(1):96-104
[17] ZHOU X G, GAO D M, LIU J, et al. Changes in rhizosphere soil microbial communities in a continuously monocropped cucumber (Cucumis sativus L.) system[J]. European Journal of Soil Biology,2014,60:1-8
[18] 沈良英. 狼尾草属3种高禾草营养动态及消化特性研究[D]. 昆明:云南农业大学,2023:14
[19] 鲍士旦. 土壤农化分析[M]. 第3版.北京:中国农业出版社,2000:30-112
[20] BOLYEN E, RIDEOUT J R, DILLON M R, et al. Reproducible, interactive, scalable and extensible microbiome data science using QIIME2[J]. Nature Biotechnology,2019,37(8):852-857
[21] 杜欣然,王晶晶,冉柒,等. 黏细菌资源及其系统分类[J]. 微生物学通报,2023,50(7):3104-3121
[22] 王迅,黎媛,赖永辉,等. 果园生草对柑桔果园土壤性质与微生物群落的影响[J]. 草学,2021(2):61-65,69
[23] MELVILLE N, MORGAN R P C. The influence of grass density on effectiveness of contour grass strips control of soil erosion on Low angle slops[J]. Soil Use and Management,2001,(17):278-281
[24] 王爱玲,段国琪,田时敏,等. 不同生草种类对苹果果园土壤含水量及土壤肥力的影响[J]. 草学,2023(5):29-34,42
[25] 封帆,谢开云,艾比布拉·伊马木,等. 果园生草对苹果园杂草控制、土壤养分及果树营养状况的影响[J]. 新疆农业科学,2023,60(4):982-991
[26] 付学琴,杨星鹏,陈登云,等. 南丰蜜橘果园生草栽培对土壤团聚体和有机碳特征及果实品质的影响[J]. 园艺学报,2020,47(10):1905-1916
[27] 邓丰产,安贵阳,郁俊谊,等. 渭北旱塬苹果园的生草效应[J]. 果树学报,2003(6):506-508
[28] 李惟婕,王立,马景永,等. 黄土旱塬区苹果园生草覆盖对深层土壤水分和根系分布特征的影响[J]. 草业学报,2023,32(1):63-74
[29] WANG Z K, WU Y H, CAO Q, et al. Modeling the coupling processes of evapotranspiration and soil water balance in agroforestry systems[J]. Agricultural Water Management,2021,250(1):106839
[30] 焦润安,张舒涵,李毅,等. 生草影响果树生长发育及果园环境的研究进展[J]. 果树学报,2017,34(12):1610-1623
[31] 张朋朋,胡雯,管增辉,等. 生草对苹果园土壤养分、酶活性及细菌群落的影响[J]. 西北农林科技大学学报(自然科学版),2024,52(9):86-96
[32] 陈燕. 自然生草对梨园土壤理化性质、采前采后果实品质及糖代谢影响研究[D]. 阿拉尔:塔里木大学,2024:22
[33] 杨露,毛云飞,胡艳丽,等. 生草改善果园土壤肥力和苹果树体营养的效果[J]. 植物营养与肥料学报,2020,26(2):325-337
[34] 吉爽秋,李旭娇,张弛,等.生草不同处理方式对果园土壤温度、含水量及养分的影响[J]. 草学,2021,(6):58-65,70
[35] 韦鑫,张朝权,谢彩云,等. 果园生草对梨园土壤理化性质和微生物的影响[J]. 北方园艺,2023(18):79-86
[36] 孙瑶,马金昭,傅国海,等. 土壤调理剂和生草互作对果园酸化土壤化学性质及产量的影响[J]. 中国土壤与肥料,2021,(2):61-68
[37] 刘晗,王萍,孙鲁沅,等. 种植冬绿肥对红壤幼龄橘园土壤微生物量碳、氮和酶活的影响[J]. 生态环境学报,2023,32(9):1623-1631
[38] SUN L, ZHANG J, ZHAO J, et al. Effects of Cinnamomum camphora coppice planting on soil fertility, microbial community structure and enzyme activity in subtropical China[J]. Frontiers in Microbiology,2023,14:1104077
[39] 惠竹梅,李华,龙妍,等. 葡萄园行间生草体系中土壤微生物数量的变化及其与土壤养分的关系[J]. 园艺学报,2010,37(9):1395-1402
[40] 侯宇辉. 果园生草对柑橘园杂草防控及土壤环境的影响[D]. 成都:四川农业大学,2023:1
[41] ZHANG Z, CHEN Q, YIN C, et al. The effects of organic matter on the physiological features of Malus hupehensis seedlings and soil properties under replant conditions[J]. Scientia Horticulturae, 2012,146:52-58
[42] 王延,杨浩,张雯娜,等. 果园生草模式对黄土高原苹果园土壤温度的缓冲效应[J]. 中国草地学报,2023,45(6):117-125
[43] 张承,王秋萍,周开拓,等. 猕猴桃园套种吉祥草对土壤酶活性及果实产量、品质的影响[J]. 中国农业科学,2018,51(8):1556-1567
[44] GREG D, TILSTON E L, JULIE B, et al. Spatial structuring of soil microbial communities in commercial apple orchards[J]. Applied Soil Ecology, 2018,130:1-12
[45] 温晓霞,殷瑞敬,高茂盛,等. 不同覆盖模式下旱作苹果园土壤酶活性和微生物数量时空动态研究[J]. 西北农业学报,2011,20(11):82-88
[46] SIMPSON R M, MASON K, ROBERTSON K, et al. Relationship between soil properties and enzyme activities with soil water repellency[J]. Soil Research,2019,57(6):689-702
[47] ZHENG W, GONG Q, ZHAO Z, et al. Changes in the soil bacterial community structure and enzyme activities after intercrop mulch with cover crop for eight years in an orchard[J]. European Journal of Soil Biology,2018,86:34-41
[48] ACOSTA-MARTINZE V, CRUZ L, SOTOMAYOR-RAMIREZ D, et al. Enzyme activities as affected by soil properties and land use in a tropical watershed[J]. Applied Soil Ecology,2007,35(1):35-45
[49] 李昱龙,韩正敏. 嗜麦芽窄食单胞菌在环保和农业生产上的应用[J]. 生物技术通报,2015,31(8):35-43
[50] 梁博文,刘成连,王永章,等. 黄河三角洲梨园自然生草对土壤pH的影响[J]. 中国农学通报,2014,30(1):143-148
[51] 赵海洲,王如刚,李克磊,等. 丘陵地苹果园生草对根际土壤理化性状及微生物的影响[J]. 北方园艺,2024(6):79-85
[52] 钱雅丽,梁志婷,曹铨,等. 陇东旱作果园生草对土壤细菌群落组成的影响[J]. 生态学杂志,2018,37(10):3010-3017
[53] 刘业萍,毛云飞,胡艳丽,等. 苹果园生草对土壤微生物多样性、酶活性及碳组分的影响[J]. 植物营养与肥料学报,2021,27(10):1792-1805
[54] 赵璇. 中国北方主要草地类型土壤放线菌多样性和群落结构的比较研究[D]. 长春:东北师范大学,2016:29
[55] MENG H, LI K, NIE M, et al. Responses of bacterial and fungal communities to an elevation gradient in a subtropical montane forest of China[J]. Applied Microbiology amp; Biotechnology, 2013,97(5):2219-2230
[56] 姜莉莉,孙瑞红,张甘雨,等. 连续3 a生草对苹果园土壤理化性质及微生物群落的影响[J]. 西北农业学报,2023,32(9):1456-1465
[57] 王莹莹. 渭北旱塬苹果园行间生草及树盘覆盖对土壤理化性质和微生物群落的影响[D]. 杨凌:西北农林科技大学,2023:47
[58] ZHONG Y, YAN W, WANG R, et al. Decreased occurrence of carbon cycle functions in microbial communities along with long-term secondary succession[J]. Soil Biology and Biochemistry,2018,123:207-217
(责任编辑" 彭露茜)

