改变碳输入对亚热带针阔混交林土壤化学性质和微生物群落的影响



关键词:土壤微生物;有机碳输入;高通量测序;土壤化学性质;木荷与马尾松混交林
中图分类号:S714 文献标志码:A 文章编号:1672-2043(2025)01-0095-10 doi:10.11654/jaes.2024-0155
我国南方红壤区由于特殊的成土因素和人为活动的干扰,水土流失较为严重,不少地区出现“空中森林”现象,这不仅会影响林地生产力、破坏当地生态环境,而且制约区域经济发展,因而提升退化地土壤肥力进而维护生态系统稳定备受关注[1-2]。土壤微生物是土壤的重要组成部分,它不仅参与元素循环过程,同时在增强根际免疫、提高土壤肥力方面扮演关键的角色[2];但微生物具有高度敏感性,易受到外部环境的影响,不同碳源输入可能会造成微生物群落的不同,而微生物群落是驱动生态系统过程的主要因素[3]。因此,土壤微生物群落对土壤质量提高和生态系统恢复极为重要。
与农业土壤人为添加有机质不同,林地主要通过凋落物、细根和菌根等自肥方式补给有机碳,从而影响土壤微生物[4]。地上凋落物输入是植物归还土壤养分的主要途径,也是森林生态系统中土壤微生物代谢的重要基质,其输入量的变化会影响土壤微生物群落结构,然而关于凋落物添加与去除的影响结果仍存在争议。例如:卢晓蓉等[5]对亚热带杉木人工林的研究显示,土壤细菌和真菌含量随凋落物量的增加而增加;而Sayer[6]通过对欧洲森林的研究发现,凋落物的去除会改变真菌的物种组成和多样性,凋落物的添加则不会引起真菌丰度的增加。根系输入会将根系分泌物如多糖、有机酸和氨基酸释放到土壤中,这些分泌物可以刺激微生物生长从而增加土壤的养分利用[7]。前人关于根系输入对土壤微生物影响的研究结果也存在差异,例如:Wang等[8]对中亚热带混交林研究发现,根沟处理使得根系分泌物减少,从而显著影响土壤真菌生物量;Brant等[9]对温带3种不同林分的研究发现,根系去除会提高放线菌生物量,降低真菌生物量。菌根是土壤和植物根系中某些真菌的共生体,菌根的菌丝可以促进碳沉积到土壤孔隙和矿物质表面[10],对土壤有机质的形成与稳定起着重要作用。Toljander 等[11]对温带耕地研究发现菌根的菌丝分泌物提高了细菌的活性,并改变了细菌群落组成。
植物残体的添加和去除实验(DIRT)是通过改变地上、地下碳输入来研究植物和土壤微生物群落之间反馈作用的有效方法[12],但前人大多只关注凋落物或根系输入对土壤微生物的单一影响[5-6,8-9,11],关于地上、地下有机碳交互输入对土壤微生物群落影响的研究较少,对于红壤退化地植被恢复后土壤微生物的相关研究则更为缺乏。木荷(Schima superba)和马尾松(Pinus massoniana)是亚热带常绿阔叶林中分布广泛的优势树种,在我国红壤退化地区具有普遍适用性,并且与纯林相比,针阔混交在增加微生物生物量和改善林地养分状况方面更有优势[13],因此,本研究以亚热带木荷与马尾松针阔混交林为研究对象,以未处理的土壤(凋落物输入+根系输入+菌根输入,LRM)为对照,原位设置双倍凋落物输入+根系输入+菌根输入(2LRM)、凋落物去除+ 根系输入+ 菌根输入(NRM)、凋落物去除+根系去除+菌根输入(NNM)和凋落物去除+根系去除+菌根去除(NNN)处理,采用高通量测序技术比较有机碳输入改变下土壤化学性质和土壤微生物群落的变化,旨在揭示退化恢复林地土壤细菌和真菌群落对有机碳输入改变的响应,从而确定有机碳输入变化影响的主要微生物类群,确定影响人工恢复林土壤微生物群落结构的关键土壤性质,为亚热带针阔混交林土壤肥力提升和生态系统恢复提供理论依据。
1 材料与方法
1.1 研究区概况
试验地为亚热带红壤森林恢复长期定位试验基地,位于江西省吉安市泰和县螺溪林场(26°44′N,115°04′E),土壤为第四纪红色黏土发育而来的红壤,年均降水量1726 mm,年均气温18.6 ℃,年均日照时间1 574.9 h,无霜期288 d,属典型亚热带湿润季风气候。该试验地原始植被类型为次生灌木,经过长期人为干扰退化成荒地,1991年选择马尾松、木荷等阔叶树种进行生态恢复形成针阔混交林。据调查,木荷与马尾松混交林土壤的pH值为5.1,有机质含量为22.6 g·kg-1,全氮含量为0.7 g·kg-1,全磷含量为0.2 g·kg-1;林分密度为2 084 株·hm-2,平均树高为6.7 m,平均胸径为11.5 cm;主要乔木树种为木荷和马尾松,其中木荷占比约63%,平均树高为6.7 m,平均胸径为11.0 cm,马尾松占比约37%,平均树高为6.7 m,平均胸径为12.3 cm。林下植被主要有苔草(Carex tristachya)、芒萁(Dicranopterisdichotoma)、白檀(Symplocos paniculata)等。
1.2 样地设计与样品采集
2018 年12 月,随机选取3 片木荷与马尾松混交林,每片林分布设1块20 m×20 m的标准地。每块标准地采用随机区组的方式布设5种处理,每种处理5个重复(图1a)。每个处理小区长1 m、宽0.5 m,小区上方放置1 m×0.5 m×0.6 m尼龙网框(孔径为1 mm)。5种处理分别如下:LRM处理(保持原状)、2LRM处理(仅网框侧面围尼龙网,并每月将NRM处理尼龙网上面的凋落物转移至此网框中)、NRM处理(清除样方内凋落物,网框上面和侧面均围尼龙网,以阻止凋落物进入)、NNM处理(清除样方内凋落物,网框上面和侧面均围尼龙网,并沿样方四周开挖0.5 m深壕沟,填入37 μm 尼龙网以隔离根系但不影响菌根[14])、NNN处理(清除样方内凋落物,网框上面和侧面均围尼龙网,并沿小区周围挖0.5 m深壕沟,填入石膏板将小区与周围土壤隔离开,以阻止根系和菌丝长入小区)。2020年8月进行土壤样品采集,采集前去除土壤表层的凋落物、根系和碎石,将同一标准地相同处理5个重复的0~10 cm 表层土样均匀混合置于无菌自封袋中作为一份土壤样品,3块标准地共采集15份土壤样品,将样品置于低温保温箱中并尽快带回实验室。将采回的样品分为两份,一份自然风干后过筛用于土壤化学性质测定和酶活性测定,另一份保存于-80 ℃冰箱用于高通量测序。
1.3 土壤化学性质测定
土壤化学性质测定参考《土壤农业化学分析方法》[15]:采用电位法测定土壤pH值;采用重铬酸钾外加热法测定土壤有机质;采用凯氏定氮法测定土壤全氮;采用氟化铵-盐酸浸提法测定土壤速效磷;采用乙酸铵浸提法测定速效钾。土壤脲酶、蔗糖酶、酸性磷酸酶、酸性转化酶和多酚氧化酶活性分别用脲酶试剂盒(BC0120)、蔗糖酶试剂盒(BC0240)、酸性磷酸酶试剂盒(BC0140)、酸性转化酶试剂盒(BC3075)和多酚氧化酶试剂盒(BC0110)测定[16]。
1.4 土壤微生物高通量测序
利用基因组DNA 提取试剂盒(GENE ray)提取,使用特异引物338F(ACTCCTACGCGAGGCAGCAG)和806R(GGACTACHVGGGTWTCTAAT)对16S rRNA基因V3~V4可变区进行聚合酶链式反应(Polymerasechain reaction,PCR)扩增,使用特异引物ITS1F(CTTG⁃GTCATTTAGAGGAAGTAA)和ITS2(GCTGCGTTCTT⁃CATCGATGC)对ITS基因的特异区间进行扩增,扩增程序:95 ℃预变性10 min;95 ℃变性10 s,60 ℃退火34 s,72 ℃延伸30 s,40个循环;72 ℃延伸10 min,降温至10 ℃。利用Illumina MiSeq 对PCR 扩增产物进行测序。利用Trimmomatic 0.33软件过滤原始序列,再利用Cutadapt 1.9.1 软件和FLASH 1.2.7 获取高质量序列并对其进行拼接,利用Uchime 4.2软件鉴定并去除嵌合体序列进而得到有效序列。在97.0%的相似度水平下,利用Usearch v10 软件对序列进行聚类并与RDP classifier 数据库已知序列对比,最终获得每个分类操作单元(Operational taxonomic unit,OTU)的物种注释信息。
1.5 数据处理
利用SPSS 26.0软件对混交林不同处理土壤化学性质、酶活性、Alpha多样性指数和土壤微生物门水平组成进行多重比较(LSD)和Pearson 相关分析(Plt;0.05)。运用Origin 2022软件绘制土壤微生物门水平物种相对丰度堆叠图。运用Canoco 5.0 软件绘制冗余分析(Redundancy analysis,RDA)图。
2 结果与分析
2.1 土壤化学性质
与LRM 处理相比,2LRM 和NNN 处理显著降低了土壤酸性磷酸酶的活性,NRM和NNM处理对土壤化学性质和酶活性无显著影响(表1)。
2.2 土壤微生物Alpha多样性
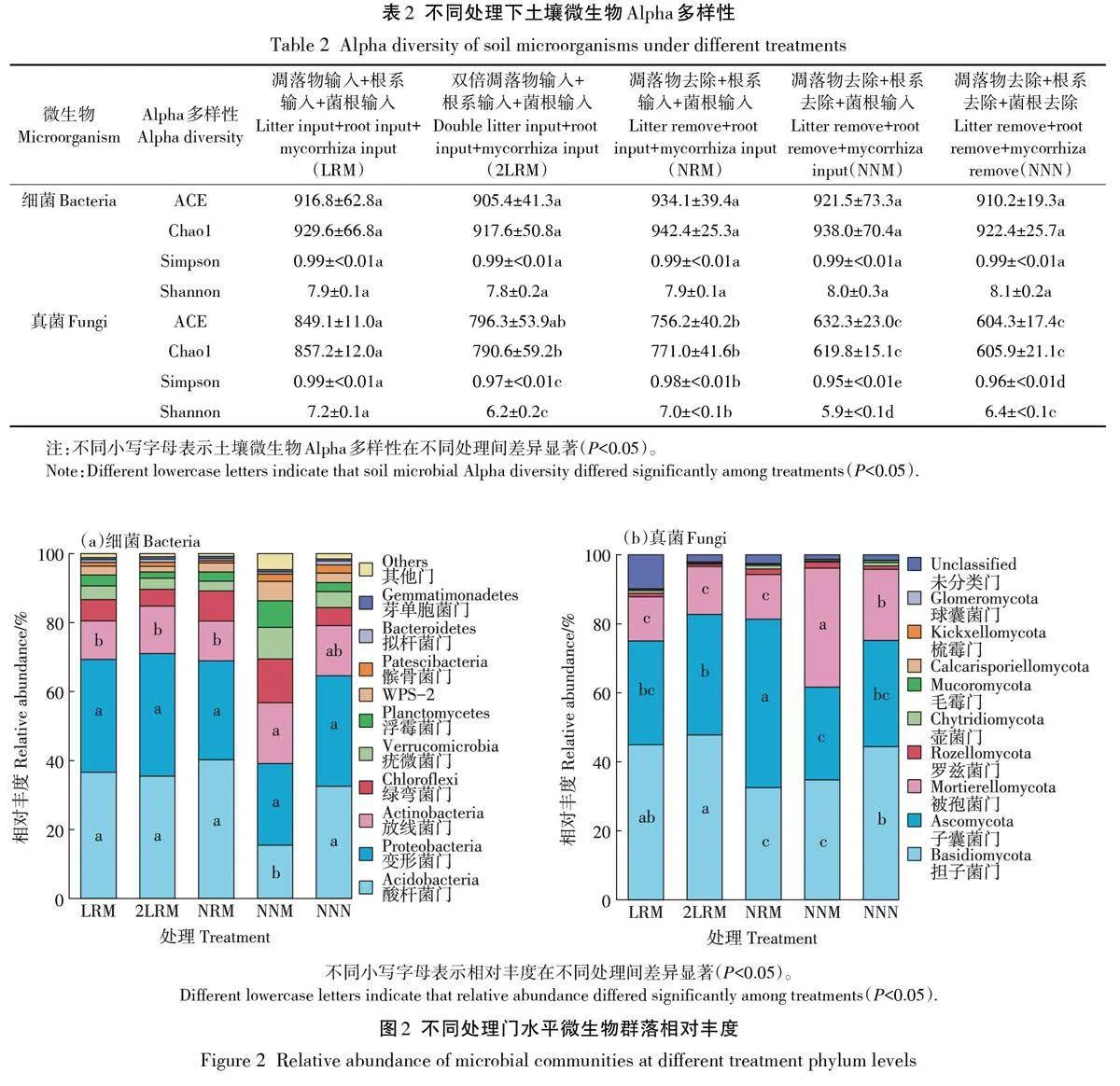
土壤微生物群落的物种丰富度可通过ACE指数和Chao1指数表示,物种多样性可通过Simpson指数和Shannon 指数表示。与LRM 处理相比,2LRM、NRM、NNM和NNN处理显著降低了土壤真菌的丰富度和多样性,而对细菌的丰富度和多样性均无显著影响(表2)。
2.3 土壤微生物群落组成
对土壤样品进行高通量测序,在97% 的相似度条件下进行聚类分析,细菌共获得1 054个OTUs,隶属于21门48纲100目142科210属221种;真菌共获得1 017个OTUs,隶属于9门24纲62目115科187属181种。5种处理的土壤样品共检测出21个细菌门,相对丰度较高的前10 个细菌门分别为酸杆菌门(Acidobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobia)、浮霉菌门(Planctomycetes)、WPS-2 门、髌骨菌门(Patescibacteria)、拟杆菌门(Bacte⁃roidetes)和芽单胞菌门(Gemmatimonadetes),其中酸杆菌门(15.5%~40.2%)、变形菌门(23.6%~35.5%)、放线菌门(11.2%~17.7%)均为优势细菌门(图2a)。与LRM处理相比,NNM处理使酸杆菌门的相对丰度降低了57.7%,使放线菌门的相对丰度提高了57.8%;变形菌门的相对丰度在各处理间未表现出显著差异性。
5种处理的土壤样品共检测出9个真菌门,分别为担子菌门(Basidiomycota)、子囊菌门(Ascomycota)、被孢菌门(Mortierellomycota)、罗兹菌门(Rozellomyco⁃ta)、壶菌门(Chytridiomycota)、毛霉门(Mucoromyco⁃ta)、Calcarisporiellomycota 门、梳霉门(Kickxellomyco⁃ta)和球囊菌门(Glomeromycota),其中优势真菌门为担子菌门(32.5%~47.8%)、子囊菌门(26.9%~48.8%)和被孢菌门(12.8%~34.5%),它们的相对丰度占比超80%(图2b)。与LRM处理相比,NRM和NNM处理使担子菌门的相对丰度分别降低了27.6%、22.7%。NRM 处理使子囊菌门的相对丰度提高了62.1%;NNM和NNN处理使被孢菌门的相对丰度分别提高了169.8%和61.0%。
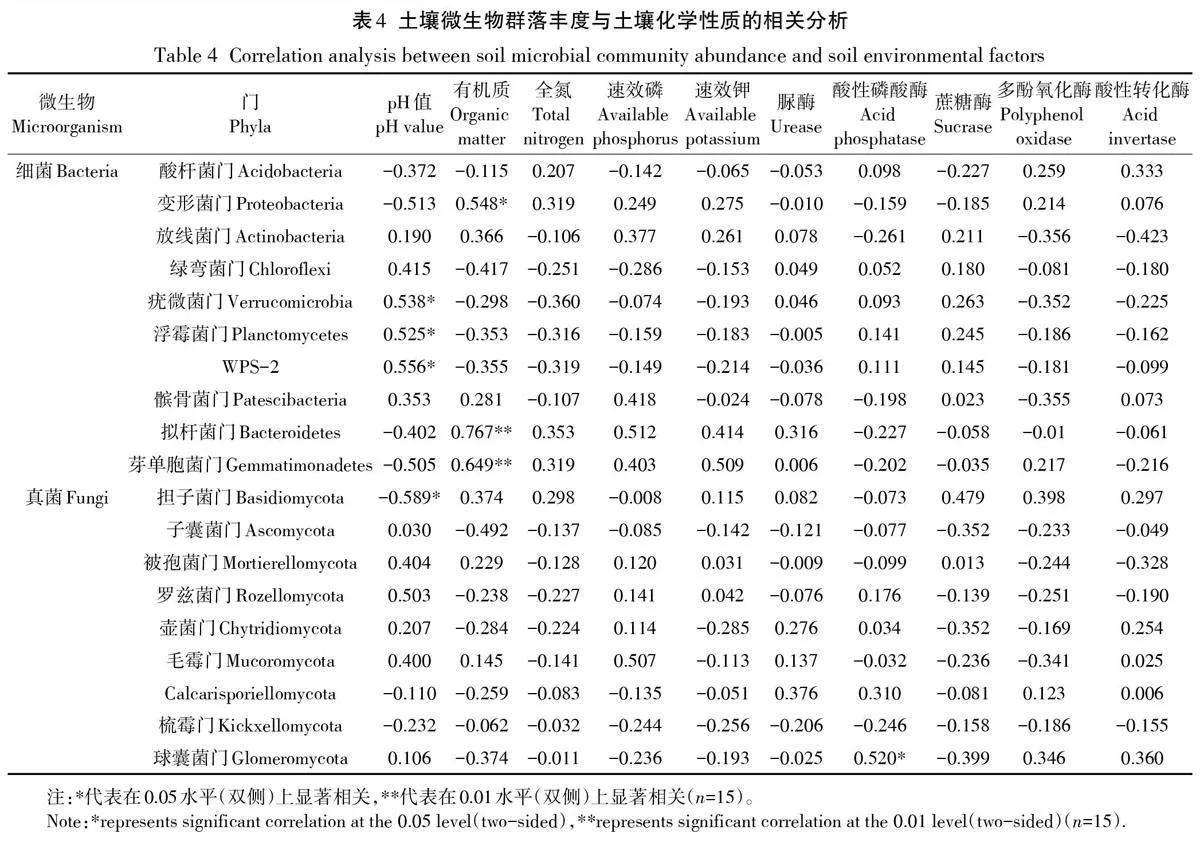
2.4 土壤微生物多样性与土壤化学性质的关系
土壤真菌群落的丰富度(ACE 指数和Chao1 指数)与土壤速效磷呈显著负相关,与土壤多酚氧化酶呈显著正相关;土壤细菌群落的丰富度和多样性与土壤化学性质无显著相关性(表3)。
2.5 土壤微生物群落组成与土壤化学性质关系分析
对土壤微生物群落与土壤化学性质进行冗余分析,结果表明土壤化学性质对微生物群落结构有较大影响。RDA的第1轴和第2轴分别解释了细菌群落变异的60.03%和18.23%,两轴共同解释了78.26%的变异(图3a)。土壤有机质、蔗糖酶、多酚氧化酶是主要的影响因子,其解释度分别为14.9%(P=0.002)、30.4%(P=0.006)、7.4%(P=0.048)。疣微菌门、浮霉菌门、WPS-2门与土壤pH呈正相关,变形菌门、拟杆菌门、芽单胞菌门与土壤有机质呈正相关(表4)。RDA的第1轴和第2 轴分别解释了真菌群落变异的56.87% 和28.17%,两轴共同解释了85.04%的变异(图3b)。土壤pH 和蔗糖酶是主要的影响因子,其解释度分别为23.6%(P=0.014)和14.8%(P=0.044)。担子菌门与土壤pH呈负相关,球囊菌门与酸性磷酸酶呈正相关(表4)。
3 讨论
3.1 改变有机碳输入对针阔混交林土壤化学性质的影响
改变有机碳输入对土壤有机质含量无显著影响(表1),可能有两方面的原因:(1)在自然状态下有机质的形成和积累过程比较缓慢,木荷叶片较厚且为革质,马尾松针叶中含有木质素等难分解物质[17],它们融入到土壤中所需时间较长;(2)有机碳输入可能会产生激发效应,导致土壤碳的矿化速率加快[18]。由于土壤有机质是全氮的主要来源[19],因此全氮含量也未表现出明显差异。本研究还发现,不同处理间速效磷含量也没有表现出显著差异,主要原因是南方红壤土铁铝氧化物对磷极强的吸附、固定作用,使得土壤中速效磷变成难溶性磷[20]。此外,2LRM处理显著降低了土壤酸性磷酸酶活性,这与魏翠翠等[21]对亚热带米槠次生林土壤酶活性研究的结果一致。NNN处理也降低了土壤酸性磷酸酶活性,这与根系和菌根分泌酸性磷酸酶有关[22]。土壤脲酶、蔗糖酶、多酚氧化酶和酸性转化酶活性在不同处理间无显著差异,体现出这几种酶对有机碳输入改变具有一定的适应性。
3.2 改变有机碳输入对针阔混交林土壤微生物多样性的影响
改变有机碳输入降低了真菌群落的丰富度指数,降低程度由大到小依次为NNN 处理、NNM 处理、NRM处理、2LRM处理。凋落物去除会引起土壤中可溶性有机质降低,导致真菌生长所需的营养不足,从而降低真菌群落丰富度。凋落物和根系的同时去除抑制了多酚氧化酶的产生,而多酚氧化酶可以促进有机质中木质素等难分解组分对养分元素的释放[23],凋落物和植物根系分泌物的去除导致碳源受阻,从而降低了真菌群落丰富度。与LRM处理相比,2LRM处理反而使土壤真菌丰富度指数和多样性指数降低,这可能是因为难分解的木质素含量相对升高,而木质素能与酚类等物质形成稳定化合物、与芳香族化合物反应生成难分解的腐殖质从而使凋落物的分解受到抑制[24],引起真菌群落多样性降低。土壤细菌丰富度和多样性指数在各处理之间无显著差异,说明不同有机碳输入对细菌群落的影响较小,这可能是因为土壤细菌喜中性或碱性环境,红壤的酸性条件限制了土壤细菌的生长[25];同时在酸性土壤中正常生长的耐酸真菌可以代替细菌分解有机物[14],因此与细菌相比,真菌对有机碳输入的改变更敏感。
3.3 不同有机碳输入对针阔混交林土壤微生物群落组成的影响
土壤细菌群落中,酸杆菌门、变形菌门和放线菌门相对丰度占比较大(图2a),这与邵亚军等[26]对亚热带人工林常见造林树种的研究结果一致。NNM处理显著降低酸杆菌门的相对丰度,这可能是因为NNM处理引起土壤pH 升高(表1),而酸杆菌门是一种嗜酸菌,pH升高引起酸杆菌门相对丰度的降低。由于凋落物中含有低分子有机酸,且根系分泌有机酸[18],而根系分泌的有机酸总量与放线菌门呈显著负相关[27],去除凋落物和根系使得土壤中有机酸含量减少,引起放线菌门相对丰度的升高。担子菌门、子囊菌门和被孢菌门在土壤真菌群落中相对丰度占比较大(图2b)。由相关分析可知,担子菌门与pH呈显著负相关,NRM和NNM处理的土壤pH相对较高,导致担子菌门的相对丰度降低。同时担子菌具有较高的木质素分解能力,对凋落物的分解起重要作用。因为被孢霉属真菌为菌根真菌类益生真菌[28],所以NNM处理显著提高了被孢菌门的相对丰度。凋落物去除显著提升了子囊菌门的相对丰度,这是因为凋落物去除后,子囊菌门能够有效分解并快速利用根系分泌的有效碳素使其迅速生长,进而成为土壤真菌群落的主要种群[29];同时子囊菌门与土壤湿度呈显著正相关[30],凋落物去除会促进雨水的渗透,使得土壤含水率提高[31],这也可能使子囊菌门相对丰度得以提高,但这点还需要验证,因为缺少对土壤水分的监测。
3.4 影响针阔混交林土壤微生物群落特征的土壤化学性质
本研究发现有机质、蔗糖酶和多酚氧化酶是影响细菌群落的关键因子(图3a)。有机质是影响土壤细菌群落的主要环境因子,地上凋落物或根系输入引起碳有效性的变化,进而促进土壤有机碳的积累,引起细菌群落的变化,如变形菌门、拟杆菌门、芽单胞菌门等均为嗜营养菌,富碳环境会刺激它们快速生长[32]。蔗糖酶是影响土壤微生物群落的关键酶,与麦淑媛[33]对岷江上游不同气候区土壤微生物研究结果一致。蔗糖酶可以促进腐殖质、有机质等物质的转化,促进养分的释放,加速变形菌门等嗜营养菌对养分的获取[34]。由于多酚氧化酶主要受pH 的影响[35],亚热带酸性红壤条件提高了多酚氧化酶活性,并且多酚氧化酶能够参与木质素分解的酚类物质转化,引起土壤有机质含量增加,进而影响土壤细菌群落[36]。pH 是影响土壤真菌群落的关键环境因子(图3b)。pH与担子菌门呈显著负相关(表4),其变化可以直接改变担子菌门的相对丰度从而影响真菌群落;pH的变化也会直接影响酸性磷酸酶的活性进而影响球囊菌门的丰度。凋落物和根系分泌有机酸引起pH变化,pH改变会直接影响土壤有效磷的转化[19],本研究发现真菌丰富度与速效磷呈显著负相关(表3),因此pH 可以通过改变土壤养分的有效性间接影响土壤真菌群落,同时pH还能够直接影响外生菌根真菌的生长和菌丝代谢从而影响真菌群落[37]。
本研究仅在微生物较为活跃的夏季进行取样,季节变化是否会引起结果的不同还需进一步取样验证。由于本研究从实验处理到样品采集时间不到两年,有机碳输入改变对土壤微生物群落组成的影响是否随处理时间的增加而发生变化,还需要通过长期实验进一步论证。
4 结论
(1)本研究采用高通量测序技术探究了有机碳输入改变对木荷与马尾松混交林土壤微生物群落特征的影响,发现受有机碳输入改变影响的细菌类群主要是酸杆菌门和放线菌门,受影响的真菌类群主要是担子菌门、被孢菌门和子囊菌门,且真菌群落比细菌群落对碳输入改变更敏感。
(2)凋落物加倍输入和凋落物、根系、菌根同时去除显著降低了土壤酸性磷酸酶的活性。影响土壤细菌群落变化的关键因子是土壤有机质、蔗糖酶和多酚氧化酶,影响土壤真菌群落变化的关键因子是pH和蔗糖酶。土壤有机质和pH是影响土壤微生物群落变化的关键因子。
(3)凋落物和根系同时去除对土壤微生物群落组成的影响最大,凋落物加倍输入对土壤微生物群落组成的影响最小。

