群体感应系统信号分子受体abaR基因对鲍曼不动杆菌致病性和获得性耐药的影响
【摘 要】目的:探讨群体感应系统(quorum sensing system,QS)信号分子受体abaR对鲍曼不动杆菌致病性和耐药性的影响。方法:构建鲍曼不动杆菌ATCC 17978 abaR敲除株(ΔabaR),通过生长曲线分析、血清杀伤实验和生物膜形成实验,比较野生株和敲除株在生长速率、血清杀伤能力和生物膜形成能力等方面的差异;通过多步骤稳态体外诱导耐药实验,检测野生株ATCC 17978和敲除株ΔabaR诱导耐药后相关耐药基因表达水平的差异。结果:生长曲线显示,野生株和敲除株在各个时期的600 nm处测定吸光度(absorbance,A)值无明显差异(t=10.720,P>0.05);血清杀伤实验表明,敲除株的健康人血清(normal human serum,NHS)/磷酸缓冲盐溶液(phosphate buffered saline,PBS)比值明显低于野生株(t=3.968,P<0.05);生物膜形成实验显示,敲除株的生物膜形成能力在培养的前24 h低于野生株(t=4.632,P<0.01);在体外将野生株和敲除株诱导为美罗培南耐药菌株后,敲除株的耐药基因AdeA、AdeB和AmpC表达水平低于野生株(t1=11.330;t2=15.010;t3=13.420,均P<0.001)。结论:abaR基因通过调控生物膜形成和外排泵基因的表达,明显影响鲍曼不动杆菌的毒力和获得性耐药;干扰群体感应系统中的abaR受体分子可能是抑制群体感应信号和解决鲍曼不动杆菌耐药性问题的有效策略,为开发新型抗生素治疗耐药菌株奠定了基础。
【关键词】鲍曼不动杆菌;abaR基因;毒力;生物被膜;获得性耐药
【中图分类号】R378.99 【文献标志码】A【收稿日期】2024-09-10
基金项目:重庆市自然科学基金面上资助项目(编号:cstc2020jcyjmsxmX0207)。
Effect of the quorum sensing system LuxR type regulator abaR on the pathogenicity and drug resistance of Acinetobacter baumannii
Liao Jiaxin,Hu Weiwei
(Department of Respiratory and Critical Care,The First Affiliated Hospital of Chongqing Medical University)
【Abstract】Objective:To investigate the effect of the quorum sensing(QS) system LuxR type regulator abaR on the pathogenicity and drug resistance of Acinetobacter baumannii. Methods:The abaR-knockout(ΔabaR) strain of A. baumannii ATCC 17978 was con‐structed,and the growth curve analysis,serum killing experiment,and biofilm formation assay were used to compare the wild strain and the ΔabaR strain in terms of growth rate and serum killing ability. The multi-step in vitro drug resistance induction test was used to investigate the differences in the expression levels of related drug resistance genes after induction of drug resistance between the ATCC 17978 wild strain and the ΔabaR strain. Results:The growth curve showed that there was no significant difference in A600 nm value be‐tween the wild strain and the ΔabaR strain at each time point(t=10.720,P>0.05). The serum killing experiment showed that the ΔabaR strain had a significantly lower normal human serum/phosphate buffered saline(NHS/PBS) ratio than the wild strain(t=3.968,P< 0.05). The biofilm formation assay showed that the ΔabaR strain had a significantly lower biofilm formation ability than the wild strain within the first 24 hours of culture(t=4.632,P<0.01). After the wild strain and the ΔabaR strain were induced to meropenem-resistant strains in vitro,compared with the wild strain,the ΔabaR strain had significantly lower expression levels of the drug-resistance genes AdeA,AdeB,and AmpC(t1=11.330;t2=15.010;t3=13.420,P<0.001). Conclusion:The abaR gene significantly influences the virulence and acquired resistance of A. baumannii by regulating biofilm formation and the expression of efflux pump genes. Interference with the abaR receptor molecule within the QS may be an effective strategy to inhibit QS signaling and address the drug resistance of A. bau? mannii,which lays a foundation for developing novel antibiotics for the treatment of drug-resistant strains.
【Key words】Acinetobacter baumannii;abaR gene;virulence;bio‐film;acquired drug resistance
鲍曼不动杆菌是医院感染中最常见的病原菌之一,能从感染患者的痰液、血液、尿液、脓液及分泌物等标本中分离出来,且该菌可以长期存活,极易造成危重患者的院内感染[1-2]。近年来,全球由鲍曼不动杆菌引发的医院内感染日趋严重,临床抗菌药物的过度和不恰当的使用导致多重耐药(multi drug resistance,MDR)及泛耐药(multi drug resis‐tance,XDR)鲍曼不动杆菌的迅速出现。在我国,根据2023年细菌耐药监测网数据显示耐碳青霉烯类鲍曼不动杆菌(carbapenem-resistant A.baumannii,CRAB)检出率一直保持高位[3];但是针对CRAB的有效抗菌药物依然有限,世界卫生组织已将CRAB列入急需新型抗菌药物的重点病原体之一[4]。因此,控制鲍曼不动杆菌的感染与耐药问题迫在眉睫,研究其致病和耐药机制是解决上述临床问题的前提。
鲍曼不动杆菌拥有多种耐药机制,包括抗菌药物的灭活酶或钝化酶的产生、外膜蛋白缺失或外膜通透性下降、外排泵系统、抗菌药物靶点改变和生物膜形成等[5-8]。其中,生物膜具有独特性,受到群体感应系统(quorum sensing,QS)的调控,使细菌作为一个群体应对抗菌药物[9-10]。鲍曼不动杆菌内存在唯一的一套AHL-LuxI/LuxR型群体感应系统,该系统由abaI和abaR基因编码,分别合成abaI和abaR受体蛋白。abaI负责合成自诱导物分子AHL,当AHL积累到一定浓度时,它会与abaR受体蛋白结合,形成复合物。这个复合物启动下游基因的表达,产生许多生物行为,如毒性因子的产生和生物膜的形成,使细菌表现出高致病性和高耐药性[11]。abaR作为群体感应系统的关键受体蛋白,对鲍曼不动杆菌致病性和耐药性的作用尚不清楚,尤其对获得性耐药的影响更值得研究。
本研究建立了鲍曼不动杆菌ATCC 17978 abaR基因敲除株ΔabaR,检测abaR基因对鲍曼不动杆菌致病性、生物被膜形成及获得性耐药的影响,旨在探讨abaR基因在鲍曼不动杆菌群体感应信号中的作用机制。
1 材料与方法
1.1 细菌菌株、试剂和仪器
鲍曼不动杆菌ATCC 17978(GenBank:CP059041.1,陆军特色医学中心检验科微生物实验室馈赠),大肠杆菌DH5α和pEX18Tc载体均由本实验室保存。卡那霉素购自北京索莱宝科技有限公司,DL2000 DNA marker、2×pfu PCR Mix、2×Taq PCR Mix、5×infusion mix、2×Superpfu PCR mix、5×Seamless Cloning mix购自杭州宝赛生物科技有限公司,2K plus Ⅱ、trans2K plus DNA marker、trans2K plusⅡ DNA marker购自北京全式金生物科技有限公司,质粒DNA提取试剂盒购自北京天根生物有限公司,TRIzol Reagent购自日本Takara公司。Vitek Densichek酶标仪、PCR仪、电泳仪和凝胶成像仪购自美国Bio-Rad公司。恒温摇床购自上海世平实验设备有限公司,生物安全柜购自苏州安泰有限公司,倒置显微镜购自日本Olympus公司。
1.2 方法
1.2.1 鲍曼不动杆菌ATCC 17978 abaR基因敲除株构建 选取鲍曼不动杆菌标准株ATCC 17978为研究对象,在LB培养基中37 ℃培养过夜,通过同源重组的方法敲除abaR基因[12]。设计PCR引物扩增目的基因的abaR上下游同源臂序列,利用融合PCR技术对同源重组臂和卡那霉素抗性基因序列进行重组,将重组目的片段转入pUC19载体,进行PCR检测。最后将连接到载体上的重组DNA片段转移到大肠杆菌中,并进行四环素抗性筛选,阳性克隆经1%琼脂糖电泳检测后,送北京六合华大基因科技有限公司进行测序分析。
1.2.2 生长曲线实验 将野生株和敲除株在LB液体培养基中培养,调节菌液浓度为1×108 CFU/mL,在96孔板中37 ℃培养18 h。使用Vitek Densichek酶标仪检测每小时2株鲍曼不动杆菌在600 nm波长处的吸光度(absorbance,A)值,每组设3个重复。
1.2.3 血清杀伤实验 根据Mostafavi SKS等[13]的血清杀伤试验操作方法,将野生株和敲除株在LB液体培养基中进行37 °C、180 r/min培养,12 h后调整菌液浓度为0.5麦氏浊度。然后,将50 μL对数生长期的2 株鲍曼不动杆菌菌液与150 μL健康人血清(normal human serum,NHS)或磷酸缓冲盐溶液(phosphate buffered saline,PBS)混合。2组混合物在37 ℃条件下继续孵育3 h,将其稀释10倍并培养过夜,用于细菌计数的测定。采用平板涂布法测定活菌数,每组重复3次。结果以在NHS和PBS中生长的存活细菌的比率表示。
1.2.4 生物膜形成实验 在96孔板中放入1×108 CFU/mL的菌株培养物200 μL。培养12 h、24 h和48 h后,用PBS洗涤3次。洗涤后,用甲醇固定30 min,1%结晶紫溶液染色20 min,再用75 %乙醇脱色,最后用酶标仪测定A600 nm值,每组重复3次。
1.2.5 多步骤稳态体外诱导耐药实验 参考Chen X等[14]建立的体外诱导耐药方法,将培养18~24 h的野生株和敲除株用新鲜的MH培养基调整为0.5麦氏浊度混悬液(1×108 CFU/mL)。将25 μL菌悬液(5×105 CFU/mL)接种于1/4 MIC美罗培南培养基中。然后在37 ℃连续培养24 h,称为一代,连续培养5代。同上方法,取25 μL菌悬液于5 mL含1/2美罗培南的MH培养基中培养。如前所述,2组细菌在美罗培南1/4 MIC至128 μg/mL浓度范围内连续培养,每个药物浓度培养5代,最终菌液用于耐药基因检测。
1.2.6 qRT-PCR法检测耐药基因的表达 在成功诱导出耐药菌株后,对其耐药基因(OXA-23、AmpC、VIM-2、AdeA、AdeB和AdeC)进行检测。将WT菌株和ΔabaR的过夜培养物在MH中稀释1∶100。将稀释的培养物在37 ℃培养至对数期(A600 nm=0.6~0.8),收集细菌并使用TRIzol Reagent提取总RNA。使用PrimeScript RT Reagent Kit将RNA反转录为cDNA。使用SYBR Premix Ex Taq Ⅱ Kit进行RT-qPCR。根据说明书,使用ABI 7500实时PCR系统进行PCR扩增。采用2-ΔΔCT方法计算相对基因表达量,以16S rRNA基因作为内参基因。实验进行3次独立重复,每次重复包括3次技术重复。
1.3 统计学方法
采用GraphPad Prism9.0软件分析作图。计量资料采用均数±标准差(x±s)表示,2组间比较采用t检验,检验水准α=0.05。
2 结 果
2.1 鲍曼不动杆菌ATCC 17978 abaR基因敲除株构建及验证
首先根据abaR基因组序列,设计引物PCR扩增目的基因abaR的上下游同源臂DNA序列2147 bp(图1A)。在限制性内切酶的作用下分别克隆到自杀性质粒pEX18Tc的多克隆位点上,并在上下游片段中间引入四环素抗性基因盒,构建abaR基因敲除载体pEX18Tc-abaR。敲除载体通过电转化入ATCC 17978感受态中,蔗糖诱导双交换实验筛选目的菌落,通过聚合酶链式反应(polymerase chain reaction,PCR)鉴定出敲除株(ΔabaR)和野生菌株(图1B)。阳性克隆菌株测序结果证实鲍曼不动杆菌ATCC 17978 abaR基因敲除株构建成功。
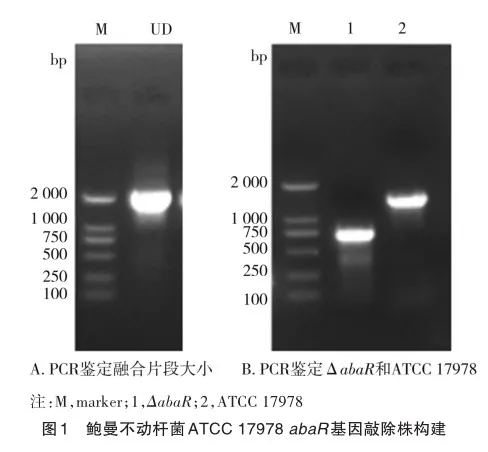
2.2 鲍曼不动杆菌abaR基因敲除对鲍曼不动杆菌生长的影响
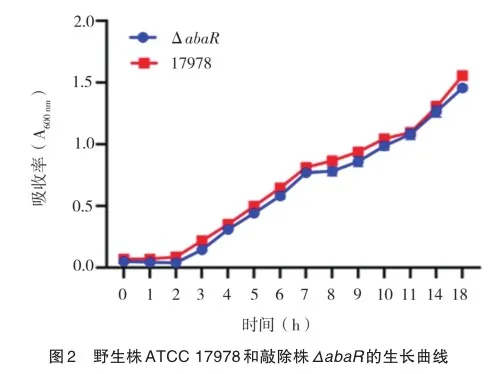
在相同培养条件下,绘制野生株ATCC 17978和敲除株ΔabaR的生长曲线,结果见图2。从图中可以看出,二者的生长速率相近,于接种后2 h左右进入对数生长期,约在培养7 h后进入平台期,并无明显差异(t=10.720,P>0.05)。
2.3 abaR基因敲除对鲍曼不动杆菌血清抵抗能力的影响
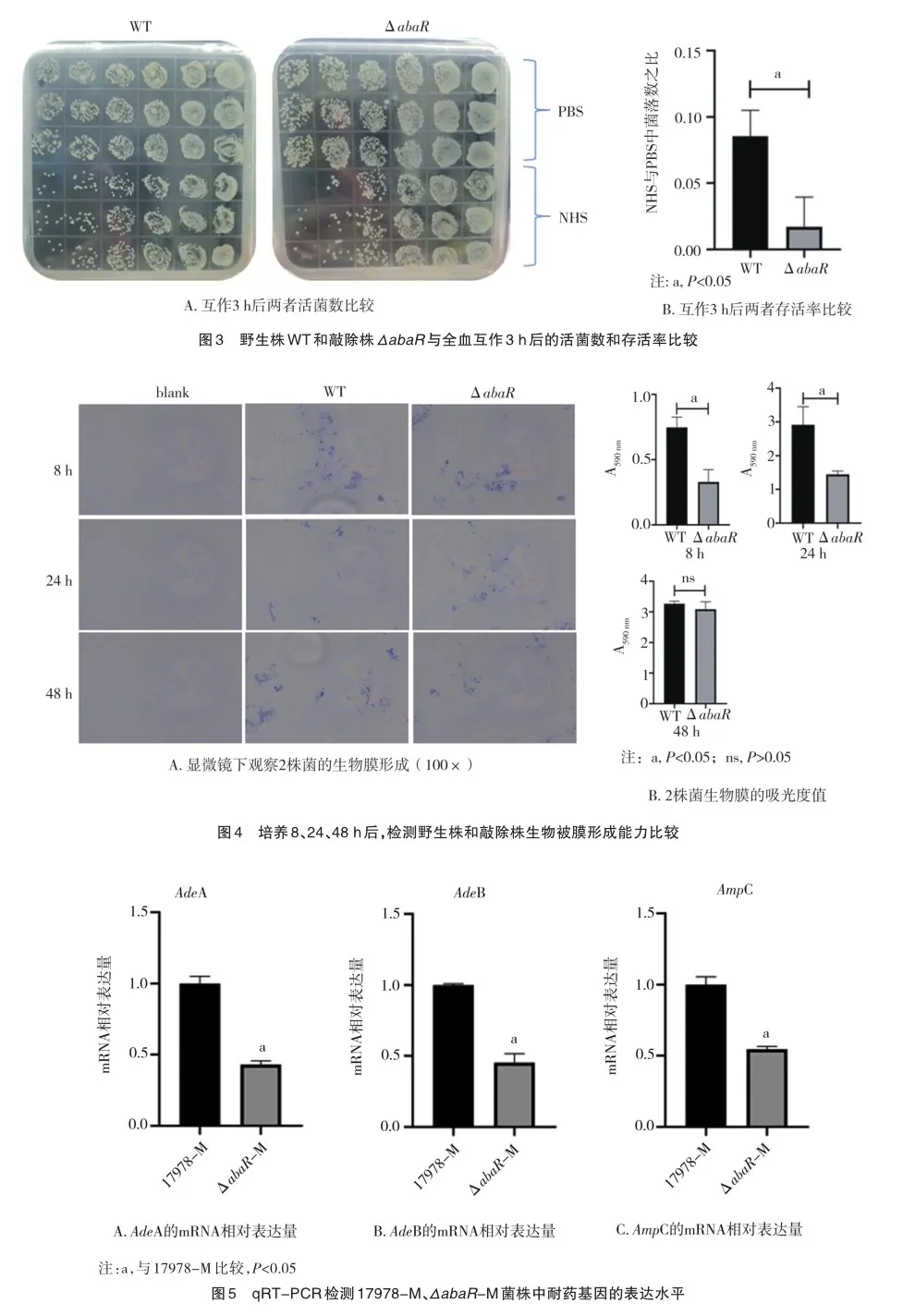
血清杀伤实验在鲍曼不动杆菌的毒性机制中起作用。为了阐明abaR基因对菌株血清抵抗能力的影响,本研究通过血清杀伤实验比较了2组菌株在NHS和PBS中的生存能力。ΔabaR组的NHS/PBS比值明显低于野生株WT组(t= 3.968,P<0.05),见图3。结果表明ΔabaR对血清更为敏感;相比之下,野生株具有较高的抗性。所有数值来自3个重复的样本,并代表3个独立的实验。
2.4 abaR基因敲除对鲍曼不动杆菌生物膜形成能力的影响
在培养8、24、48 h后,野生株WT的A600 nm值分别为0.73±0.18、2.822±0.32、3.24±0.06(图4)。abaR基因敲除后,8、24、48 h的A600 nm值分别为0.31±0.20、1.45±0.02、2.87±0.11。2株菌的生物被膜形成呈时间依赖性增加,在培养48 h时达到峰值。然而,在培养前24 h,敲除株ΔabaR的生物被膜形成能力明显低于野生株WT(t=4.632,P<0.01),表明abaR基因敲除后鲍曼不动杆菌ATCC 17978菌株生物膜形成能力明显下降。
2.5 abaR基因敲除对鲍曼不动杆菌获得性耐药性的影响
为了获得临床常见的耐美罗培南鲍曼不动杆菌株,本研究在体外用1/4MIC值逐渐递增至128 μg/mL的美罗培南诱导鲍曼不动杆菌野生株ATCC 17978和敲除株ΔabaR,其中敲除株ΔabaR较野生型菌株ATCC 17978诱导出耐药性的速度明显减慢。与耐美罗培南野生株ATCC 17978(17978-M)相比,耐美罗培南敲除株ΔabaR(ΔabaR-M)的耐药基因AdeA、AdeB和AmpC表达明显减少(t1=17.330;t2=15.010;t3= 13.420;P<0.001),AdeA基因从1.00±0.04降到0.43±0.02(图5A),AdeB基因从1.000±0.007下降到0.45±0.05(图5B),AmpC基因从1.00±0.05下降到0.55±0.01(图5C),其余3个基因AdeC、OXA-23和VIM-2均未检出,表明鲍曼不动杆菌abaR基因可以通过调控细菌外排泵基因AdeA和AdeB的表达从而影响细菌耐药。
3 讨 论
鲍曼不动杆菌耐药率高,针对耐药菌有效的抗菌药物较少,急需研发新型抗菌药物。其中群体感应系统是目前受到广泛关注的一种细菌群体行为调控机制,它对细菌致病性和获得性耐药的影响研究,给临床抗感染策略提供了新的思路:即目前临床上广泛使用的抗菌药物均以细菌的重要生命代谢过程为靶点,直接杀死病原菌或抑制病原菌的生长。在这种压力的选择下,病原菌逐渐产生耐药性;而针对细菌信号系统筛选的抗菌药物与传统的抗菌药物相比,能有效阻断病原菌的毒力因子产生但不影响细菌DNA复制和细胞分裂,不会对细菌耐药性产生选择压力。因此,针对细菌信号系统关键靶点的干扰研究,具有前瞻性的抗感染意义,也为建立新型的抗感染治疗模式提供了理论依据。本研究旨在探讨abaR信号分子受体在鲍曼不动杆菌致病性和获得性耐药中的作用。
生长速率曲线分析显示,野生株ATCC17978和敲除株ΔabaR的A600 nm值在各个时期均无明显差异,表明abaR基因缺失对鲍曼不动杆菌在LB液体培养基中的生长无明显影响。然而,临床上广泛使用的抗菌药物通常以细菌的关键代谢过程为靶点,直接杀死病原菌或抑制其生长[15]。因此,本研究表明鲍曼不动杆菌群体感应系统的信号分子受体与传统的抗菌药物的杀菌机制不同,abaR受体不会影响细菌的生长。血清补体在机体清除病原菌中发挥着关键作用。当补体系统被激活时,会在靶细胞表面形成攻膜复合体,导致靶细胞溶解,这种过程是机体抵抗微生物感染的重要防御机制。此外,血清调理素与细菌及其他颗粒物质结合,能增强吞噬细胞的吞噬能力。然而,病原菌在长期的进化过程中发展出有效的机制,以减轻或躲避补体的攻击。抗血清补体的杀灭能力被认为是多种革兰氏阴性菌致病性的重要决定因素[16]。本研究发现,鲍曼不动杆菌ATCC 17978对人血清的抗性与abaR基因相关。这一发现表明abaR在促进该菌的侵袭和血液定殖中具有潜在作用,是鲍曼不动杆菌的关键毒力因子。血清抵抗因子的发现对疫苗和药物的研发具有重要意义,并影响其致病性。
事实上,在鲍曼不动杆菌生长过程中已经观察到生物被膜的产生,并被认是其主要的致病因子之一,极大地增强了其存活能力和持久性。而且生物膜的形成是鲍曼不动杆菌的重要耐药机制之一。许多研究报道,QS系统通过分泌自动诱导物的信号分子来维持生物膜的形成。例如,在QS发生过程中,abaI作为合成酶产生AHL信号分子,这些分子与abaR受体结合,触发信号级联,从而增加生物被膜的密度[17]。本研究还发现abaR基因对鲍曼不动杆菌的生物膜形成也有重要影响。在8、24、48 h的3个时间点检测细菌生物膜形成量,结果显示abaR基因敲除株生物膜形能力明显低于野生株(P<0.01),这表明abaR基因对鲍曼不动杆菌的生物膜形成具有促进作用,这一研究结果与其他研究完全一致[18]。
根据2023年我国耐药监测网的统计数据,鲍曼不动杆菌对美罗培南的耐药率高达75.1%。而且中年肿瘤患者发生院内感染的病原菌中鲍曼不动杆菌占主导地位[19-20]。因此,研究其耐药机制并寻找新型抗菌药物迫在眉睫。文献查阅发现,鲍曼不动杆菌的群体感应系统与耐药性密切相关。窦懿[21]发现鲍曼不动杆菌产生信号分子N-3-羟基-十二酰基-高丝氨酸内酯能够诱导耐药基因的表达。另有研究报道,abaI/abaR介导的群体感应系统与多重耐药鲍曼不动杆菌明显相关[22]。文献还报道,耐碳青霉烯类鲍曼不动杆菌可以通过主动外排系统或在抗生素靶位点携带突变来获得抗生素耐药性[23]。本研究结果显示,在美罗培南获得性耐药菌株中,abaR基因敲除后产生的外排泵基因AdeA和AdeB的表达明显减少。这提示abaR基因可以通过调控细菌外排泵基因的表达来影响鲍曼不动杆菌的获得性耐药性。abaR信号分子受体可能是CRAB的潜在药物靶点,从而降低获得性耐药的概率。
综上所述,鲍曼不动杆菌群体感应系统信号分子受体abaR基因通过调控生物膜形成和外排泵基因的表达,明显影响鲍曼不动杆菌的致病性和获得性耐药;干扰群体感应系统中的abaR受体分子可能是抑制群体感应信号和解决鲍曼不动杆菌耐药性问题的有效策略,为开发新型抗生素治疗耐药菌株奠定了基础。
参考文献
[1] Zhao X,Wang LH,Wei N,et al. Epidemiological and clinical char‐acteristics of healthcare-associated infection in elderly patients in a large Chinese tertiary hospital:a 3-year surveillance study[J]. BMC In‐fect Dis,2020,20(1):121.
[2] Jain M,Sharma A,Sen MK,et al. Phenotypic and molecular char‐acterization of Acinetobacter baumannii isolates causing lower respira‐tory infections among ICU patients[J]. Microb Pathog,2019,128:75-81.
[3] Li WB,Liu CJ,Ho HC,et al. Association between antibiotic resis‐tance and increasing ambient temperature in China:an ecological study with nationwide panel data[J]. Lancet Reg Health West Pac,2023,30:100628.
[4] Tacconelli E,Carrara E,Savoldi A,et al. Discovery,research,and development of new antibiotics:the WHO priority list of antibioticresistant bacteria and tuberculosis[J]. Lancet Infect Dis,2018,18(3):318-327.
[5] Teerawattanapong N,Panich P,Kulpokin D,et al. A systematic re‐view of the burden of multidrug-resistant healthcare-associated infec‐tions among intensive care unit patients in Southeast Asia:the Rise of multidrug-resistant Acinetobacter baumannii[J]. Infect Control Hosp Epidemiol,2018,39(5):525-533.
[6] Morikane K,Suzuki S,Yoshioka J,et al. Clinical and microbiologi‐cal effect of pulsed xenon ultraviolet disinfection to reduce multidrugresistant organisms in the intensive care unit in a Japanese hospital:a before-after study[J]. BMC Infect Dis,2020,20(1):82.
[7] Khan AU,Maryam L,Zarrilli R. Structure,Genetics and World‐wide Spread of New Delhi Metallo-β-lactamase(NDM):a threat to public health[J]. BMC Microbiol,2017,17(1):101.
[8] Zhu LJ,Chen XY,Hou PF. Mutation of CarO participates in drug resistance in imipenem-resistant Acinetobacter baumannii[J]. J Clin Lab Anal,2019,33(8):e22976.
[9] 戚丽华. 鲍曼不动杆菌耐药特性及其与生物膜的相关性研究[D]. 北京:中国人民解放军军事医学科学院,2016. Qi LH. Study on drug resistance characteristics of Acinetobacter bau‐mannii and its correlation with biofilm[D]. Beijing:PLA Academy of Military Medical Sciences,2016.
[10] Amin M,Navidifar T,Shooshtari FS,et al. Association between biofilm formation,structure,and the expression levels of genes related to biofilm formation and Biofilm-specific resistance of Acinetobacter bau? mannii strains isolated from burn infection in Ahvaz,Iran[J]. Infect Drug Resist,2019,12:3867-3881.
[11] Kim DH,Choi JY,Kim HW,et al. Spread of carbapenemresistant Acinetobacter baumannii global clone 2 in Asia and AbaRtype resistance islands[J]. Antimicrob Agents Chemother,2013,57(11):5239-5246.
[12] Li J,Hu WW,Qu GX,et al. Characterization of a type VI secre‐tion system vgrG2 gene in the pathogenicity of Burkholderia thailanden? sis BPM[J]. Front Microbiol,2021,12:811343.
[13] Mostafavi SKS,Najar-Peerayeh S,Mobarez AM,et al. Character‐ization of uropathogenic E.coli O25b-B2-ST131,O15:K52:H1,and CGA:Neutrophils apoptosis,serum bactericidal assay,biofilm forma‐tion,and virulence typing[J]. J Cell Physiol,2019,234(10):18272-18282.
[14] Chen X,Meng XB,Gao QQ,et al. Meropenem selection induced overproduction of the intrinsic carbapenemase as well as phenotype di‐vergence in Acinetobacter baumannii[J]. Int J Antimicrob Agents,2017,50(3):419-426.
[15] Mok WWK,Orman MA,Brynildsen MP. Impacts of global tran‐scriptional regulators on persister metabolism[J]. Antimicrob Agents Chemother,2015,59(5):2713-2719.
[16] 董俊芳,王 萍,刘存伟,等. 鲍曼不动杆菌无痕基因敲除及hcp基因相关功能[J]. 微生物学通报,2021,48(3):811-819. Dong JF,Wang P,Liu CW,et al. Marker-less gene deletion and the function of hcp gene in Acinetobacter baumannii[J]. Microbiol China,2021,48(3):811-819.
[17] Luo LM,Wu LJ,Xiao YL,et al. Enhancing pili assembly and bio‐film formation in Acinetobacter baumannii ATCC19606 using nonnative acyl-homoserine lactones[J]. BMC Microbiol,2015,15:62.
[18] Saipriya K,Swathi CH,Ratnakar KS,et al. Quorum-sensing sys‐tem in Acinetobacter baumannii:a potential target for new drug develop‐ment[J]. J Appl Microbiol,2020,128(1):15-27.
[19] 黄丽华, 刘 娇, 彭雪儿等. 2019~2021年某肿瘤专科医院院内感染情况分析[J]. 中山大学学报(医学科学版),2023,44(4):697-703. Huang LH,Liu J, Peng XE,et al. Analysis of nosocomial infection in a cancer hospital from 2019 to 2021[J]. J Sun Yat Sen Univ Med Sci,2023,44(4):697-703.
[20] 李 雯,徐 丹, 成孟芹. 消化内科老年患者医院感染病原菌分布、危险因素分析及对策研究[J]. 重庆医科大学学报,2023,48(4):467-471. Li W,Xu D,Cheng MQ. Analysis of pathogenic bacteria distribution,risk factors and countermeasures of nosocomial infection in elderly pa‐tients in gastroenterology department[J]. J Chongqing Med Univ,2023,48(4):467-471.
[21] 窦 懿. 鲍曼不动杆菌群体感应系统信号分子N-酰基高丝氨酸内酯的鉴定以及与耐药基因相关性的研究[D]. 上海: 上海交通大学, 2015. Dou Y. Identification of N- acyl homoserine lactone,a signal molecule of quorum sensing system of Acinetobacter baumannii,and its correla‐tion with drug resistance genes[D]. Shanghai:Shanghai Jiao Tong Uni‐versity,2015.
[22] Tang J,Chen Y,Wang XL,et al. Contribution of the AbaI/AbaR quorum sensing system to resistance and virulence of Acinetobacter bau? mannii clinical strains[J]. Infect Drug Resist,2020,13:4273-4281.
[23] Choi SJ,Kim ES. Optimizing treatment for carbapenem-resistant Acinetobacter baumannii complex infections:a review of current evi‐dence[J]. Infect Chemother,2024,56(2):171-187.
(责任编辑:曾 玲)
本文引用格式:
廖佳馨,胡韦维. 群体感应系统信号分子受体abaR基因对鲍曼不动杆菌致病性和获得性耐药的影响[J]. 重庆医科大学学报,2025,50(1):52-57.

