2022~2023年福建省三明地区A型轮状病毒分子流行病学调查分析


摘要:为了解福建省三明地区A群猪轮状病毒的流行情况及分子特征,对2022~2023年福建省三明地区55家规模化猪场的4 356份粪便样品进行检测,用荧光定量PCR的方法调查RVA流行率,并对RVA阳性样本进行VP7基因扩增、测序使用MegAlign 软件进行同源性分析,利用MEGA11.0构建系统进化树。
关键词:A型轮状病毒;调查分析;流行病学
轮状病毒(Porcine Rotavirus,PoRV)属呼肠孤病毒科(Reoviridae)轮状病毒属(Rotavirus),是引起幼龄仔猪病毒性腹泻的主要病原之一[1]。病毒粒子有3层衣壳,最外层为VP7和VP4。根据VP7和VP4的特异性不同,PoRV可以分成2个血清型,分别为G型(VP7型)和P型(VP4型)[2]。G型和P型之间可以产生不同的组合,不同组合型之间的PoRV毒株诱导的交叉保护力低[3],至今为止PoRV已经确立为35个G型基因型和50个P型基因型[7]。轮状病毒基于VP6抗原性不同分为10个基因型(A-J),其中轮状病毒A型(Porcine Rotavirus A, RVA)可以感染人和动物,也是导致产房仔猪腹泻最常见的亚型,占到商品猪腹泻的90%以上[4-5]。现已有证据表明RVA不仅能在种间传播而且已经有猪RVA毒株感染到人的案
例[6]。该病目前尚无有效的治疗药物,虽然部分疫苗公司开发了相应的疫苗,但是由于RVA的多基因型,导致该病不能很好地被控制。本研究拟对福建省三明地区10个县市55家猪场进行RVA筛查,并对阳性样品进行VP7基因测序和分析,希望能为了解三明地区猪群RVA的感染情况和当前优势基因型流行情况并为猪场防控该病提供参考依据。
1 材料与方法
1.1 样品来源及采样原则
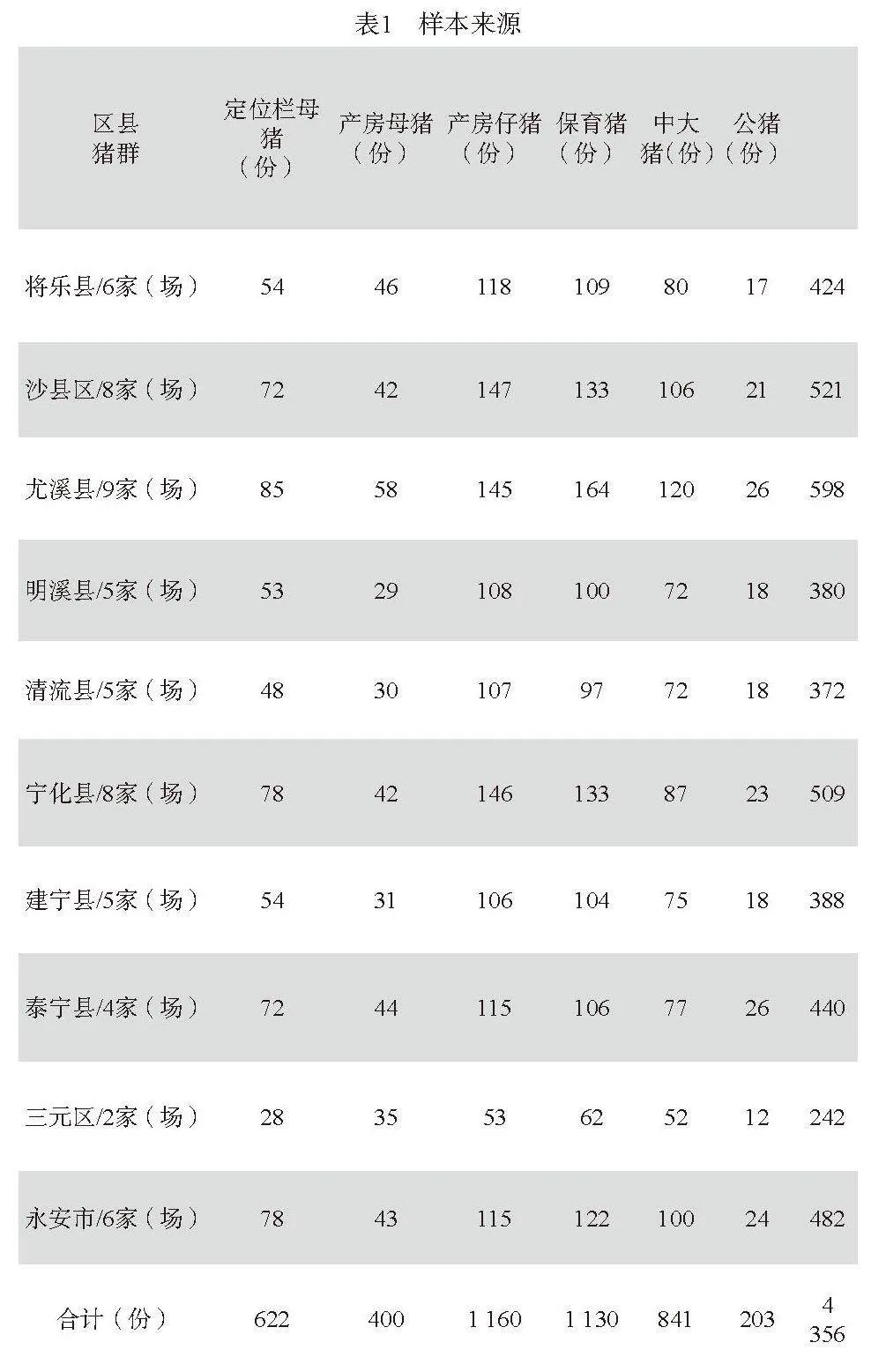
2022年8月~2023年9月对福建省闽西三明地区10个县(市、区)的55家规模化猪场开展样本收集(表1)。场内样本按照配额采样策略,规定每1 000头母猪采集定位栏母猪8~10头、产房母猪8头、产房仔猪和保育猪各15~20头、中大猪10头、公猪3~5头,不足1 000头的按1 000头样本采集。根据研究需求,个体样本基于风险采样,每个阶段尽可能有腹泻的样品,共采集粪便样品4 356份,其中腹泻样品1 568份。所有样品按等体积比加入无菌PBS液,反复冻融3次后放入离心机,4 ℃条件下5 000 r/min离心2 min取上清液置于-20 ℃保存备用。
1.2 主要试剂
核酸提取试剂盒购自济凡生物科技(常州)有限公司;猪轮状病毒荧光定量PCR检测试剂盒购自广州维伯鑫生物科技有限公司;HiScriptⓇⅡ One Step RT-PCR Kit、DL2000 Plus DNA Marker 购自南京诺唯赞生物科技股份有限公司。
1.3 主要仪器
高速冷冻离心机(Legend Micro 21R)、实时荧光定量PCR仪(Quant Studio 3):赛默飞世尔科技(中国)有限公司;全自动核酸提取仪(GeneRotex):西安天隆科技有限公司;电泳仪(DYCP-31DN):北京六一生物科技有限公司;Gene Scope V1.80 凝胶成像系统:上海山富科学仪器有限公司。
1.4 引物设计
用于检测RVA的引物根据GenBank所公布RVA流行株和经典毒株的保守区域为模板,采用SnapGene设计VP7基因特异性扩增引物(表2)。所有引物均为福建尚亚生物技术有限公司合成。
1.5 样品荧光定量PCR检测及结果判定
使用济凡抽提试剂盒及配套核酸提取仪提取核酸,荧光定量PCR按操作说明书进行操作。
1.6 RVA VP7基因扩增与测序
对于RVA荧光定量PCR检测阳性猪场核酸进行VP7基因扩增,反应体系为:20 μmol/L上下游引物各0.5μL、PCR Mix 12.5 μL、混合酶1.25 mL、RNA5 μL、无酶ddH2O 5.25μL,混合均匀。反应后取5 μLPCR产物经1.2%的琼脂凝胶电泳,将阳性扩增产物送福建尚亚生物技术有限公司测序。
1.7 RVA VP7 基因型鉴定及序列分析
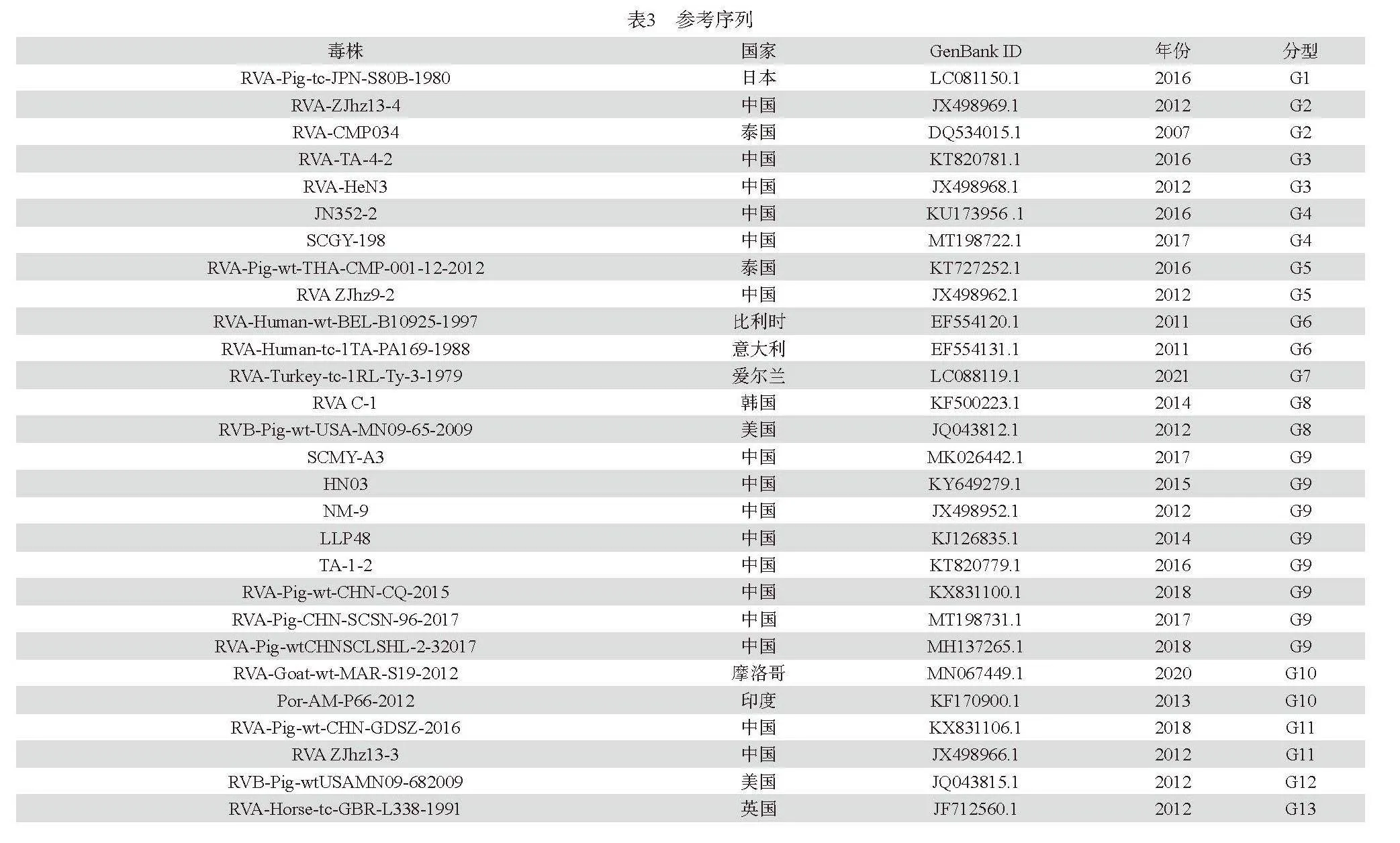
将测序的VP7基因序列采用MegAlign 和MEGA11.0等软件与GenBank(表3)中参考序列进行分析,以判定与参考序列的同源性。
2 结果
2.1 检测结果
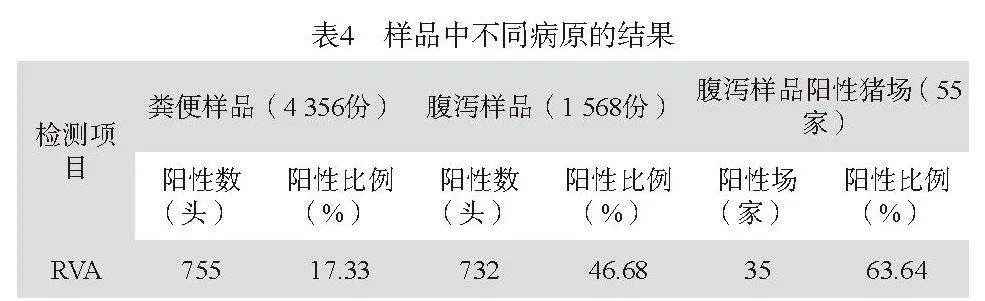
第一,猪场粪便RVA检测情况:2022~2023年间共检测福建省三明地区55家规模猪场粪便样品4 356份,全部样品做RVA检测,共检测出阳性样品755份,阳性比例为17.33%。其中腹泻样品1 568份,RVA阳性为732份,阳性率为46.68%(见表4)。
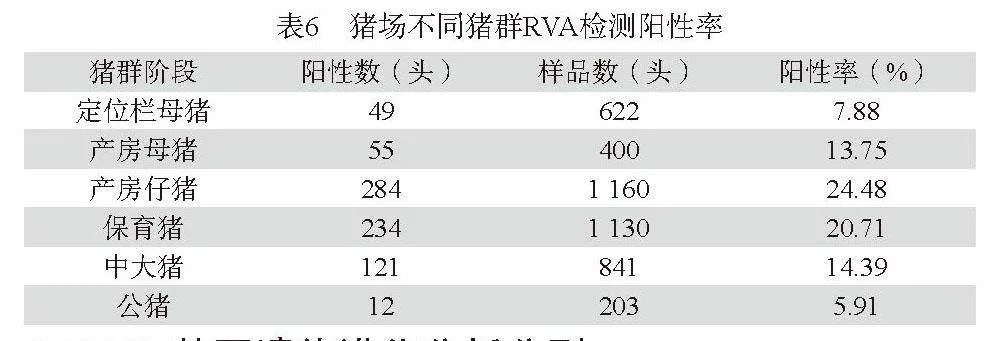
第二,不同县(市)来源的样品RVA阳性率:对福建省三明地区10个县市共采样55家(场),其中35家(场)检测出RVA阳性。不同县市来源的样品RVA阳性率差异较大,其中明溪县阳性率最高为31.05%,阳性家(个)感染率为80%,三元区样品阳性率最低为9.09%,结果见表5。
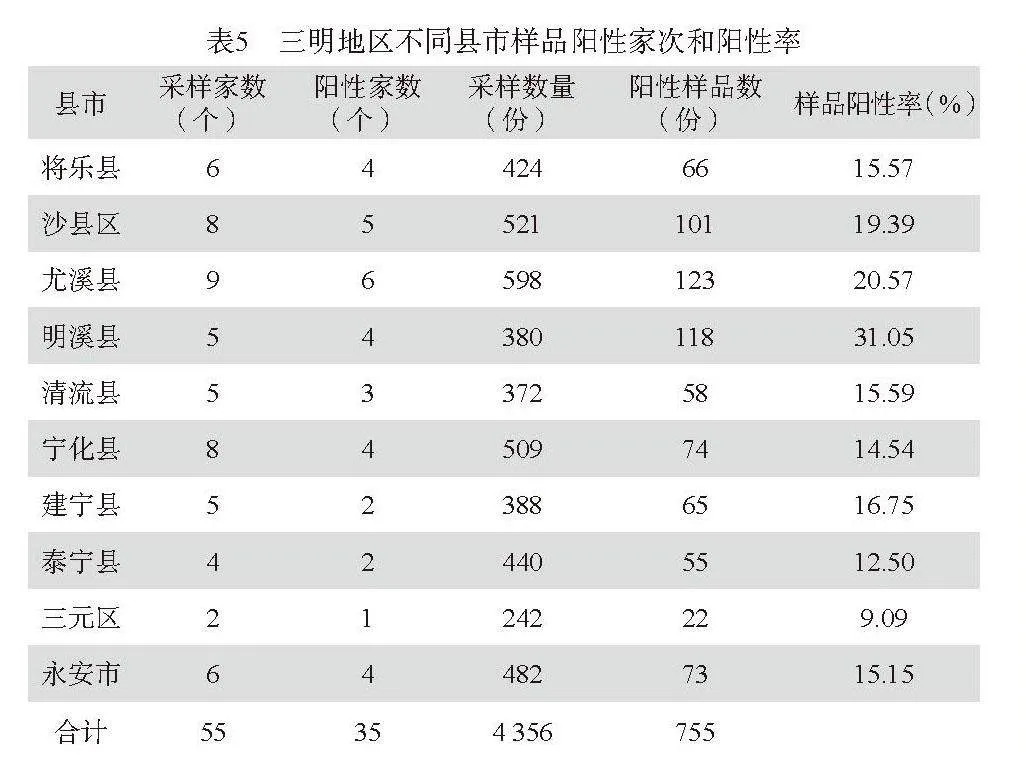
第三,不同猪群RVA感染情况:通过对不同猪群粪便样品的检测,定位栏母猪、产房母猪、保育猪、中大猪和公猪5个猪群中RVA阳性率为:产房仔猪阳性率最高为24.48%,公猪粪便阳性率最低为5.91%,保育猪阳性率为20.71%,产房母猪阳性率的13.75%高于定位栏母猪的7.88%,提示产房母猪和仔猪存在相互传染的可能,结果见表6。
2.2 VP7基因遗传进化分析分型
第一,VP7 基因RT-PCR电泳图:以VP7-F/R 为上下游引物扩增目的片段 VP7,扩增产物经凝胶电泳鉴定,结果显示成功扩增目的片段与预期相符,见图1。
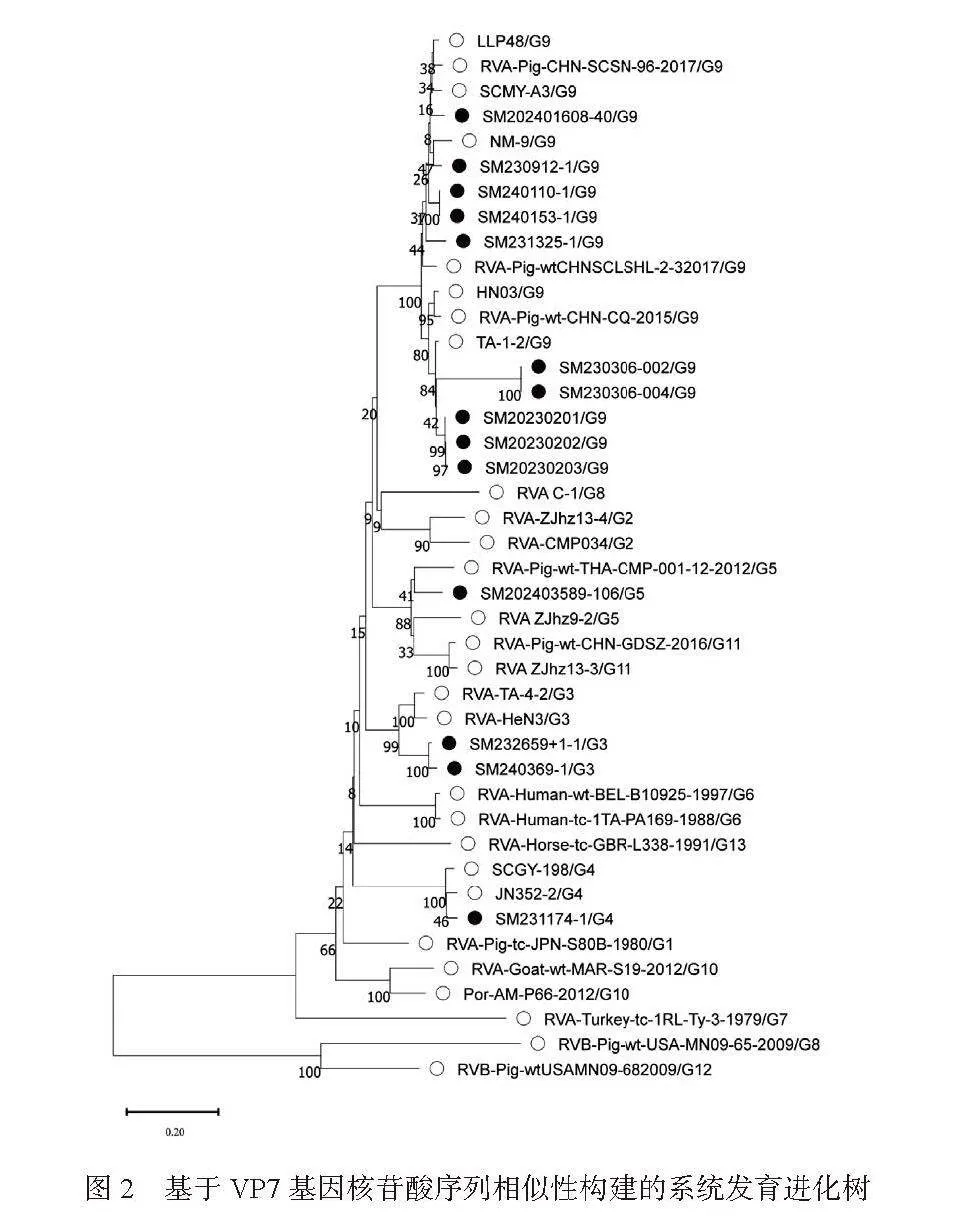
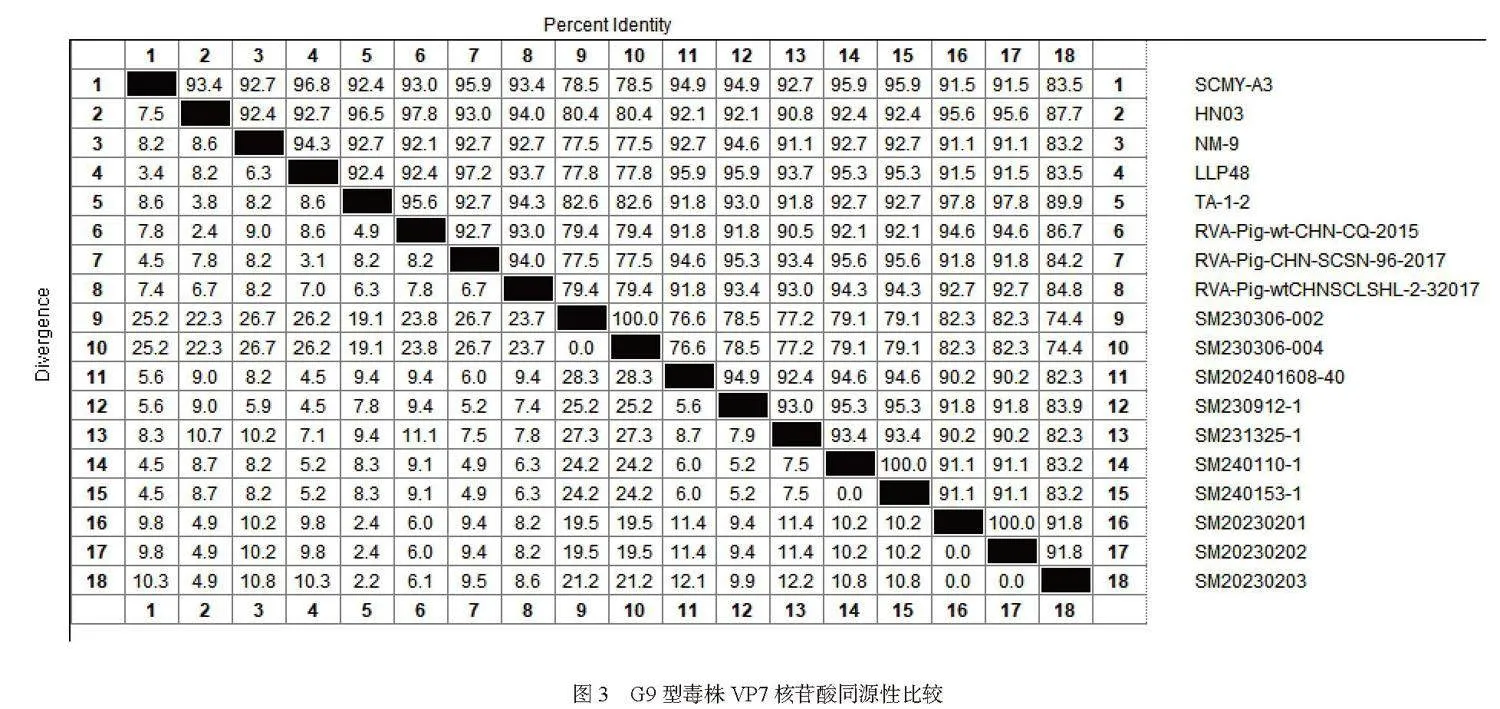
第二,基于VP7基因分型及系统进化分析:将测序所得到14株RVA VP7基因序列与GenBank中已知基因型的代表毒株通过MEGA11.0软件进行遗传进化分析,结果显示(图2):共测到4种基因型,其中G9为优势基因型(71.43%),G3、G4和G5分别占比14.29%、7.14%和7.14%。通过MegAlign 软件对测序所获10株G9基因序列与8株参考G9基因型的核苷酸进行同源性分析,VP7核苷酸同源性在74.4%~100%(图3)。SM230306-002和SM230306-004、SM240110-1和SM0153-1、SM20230201和SM20230202相近猪场分离到的毒株同源性100%。
3 讨论
福建省三明地区2022~2023年规模化猪场粪便样本RVA阳性率为17.8%,腹泻样本阳性率为45.7%,提示本病为猪群腹泻的主要原因。本研究粪便样品RVA阳性率低于何晓明[6]等2021~2022年检测的云南、贵州、广东、广西、江西和湖南6省86个规模化猪场样品的27.89%。但腹泻样本RVA阳性率与Qiao[7]等2022年对我国230家猪场中的25 768份腹泻样品检测的51.15%阳性率相近,由于采样数量和地区的不同,RVA流行率在1.5%~82.4%,尤其是安徽省样本阳性率可达82.4%。样本来源包括肠道样本和肛拭子样本,肠道样本的检出率高于肛拭子样本。此外,与保育猪和母猪相比,RVA感染在仔猪中更为常见[8]。
仔猪感染后表现为精神、食欲缺乏,逐渐出现呕吐等症状,随病情严重会发生腹泻,产黄色、灰色或黑色以及水样或糊状样粪便,更甚者粪便会伴有黏液或血液,严重者死亡[9]。本研究产房仔猪RVA 阳性率为21.93%,显著低于李国平[9]等1999年检测的福建省10日龄以内拉稀仔猪66%的阳性率。总体而言,近年来随着规模化猪场越来越多,产房仔猪腹泻样品中RVA阳性率虽然有所降低,但仍然处于较高水平,况且RVA对仔猪健康影响较大,对规模化猪场造成的损失不容忽视。
本研究根据Genbank上RVA的VP7基因序列设计了一对用于VP7基因扩增的特异性引物,扩增片段大小为309 bp。对扩增出的14份RVA样本进行VP7基因测序,与28个参考毒株构建遗传进化树,发现14份序列分别为G3、G4、G5和G9型,G9型占比71.43%,为本地区主要流行基因型。此研究与谷拉强[10]等2022~2023年对我国部分地区A群轮状病毒分子流行病学检测G9型RVA占比为75.0%一致。本研究的10株G9型基因序列同源性在75.9%~100%,尤其是SMFC20230508和SMFC20230509、SMSX230110-1和SMJL230153-1、SMTN23-1和SMTN23-2 等从相近猪场分离到的毒株同源性为100%,提示轮状病毒对距离相近的猪场有较强的传染性。
4 结论
近年来三明地区多次从国外引种,并保持多病种阴性。但是由于RVA人畜共患且传染性强,基因型复杂多样等特点为猪场防控本病带来不小压力。通过本研究可以了解福建省三明地区RVA流行情况和优势基因型,为本地区轮状病毒防控提供参考。■
参考文献:
[1] 杰弗里·J.齐默曼,洛克·A卡里克,亚历杭德罗·拉米雷斯,等.猪病学[M].杨汉春主译,11版.沈阳:辽宁科学技术出版社,2021:742.
[2] Matthijnssens J,Ciarlet M,Rahman M,et al.Recommendations for the classification of group a rotaviruses using all 11 genomic RNA segments[J].Archives Of Virology,2008,153:1621-9.doi:10.1007/s00705-008-0155-1.
[3] GREENBERG H,MCAULIFFE V,VALDESUSO J,et al.Serological analysis of the subgroup protein of royavirus,using monoclonal antibodies[J].Infect and Immun,1983,39(1):91-99.
[4] Vlasova A N,Amimo J O,Saif L J.Porcine Rotaviruses: Epidemiology,Immune Responses and Control Strategies[J].Viruses 2017,9,48.
[5] Midgley S E,Bányai K,Buesa J,et al.Diversity and zoonotic potential of rotaviruses in swine and cattle across Europe[J].Veterinary Microbiology.2012,156,238–245.
[6] 何晓明,田小艳,王东东,等.2021—2022年我国部分地区猪轮状病毒分子流行病学调查[J].畜牧与兽医,2024,56(3):77-85.
[7] Qiao Mengli,Li Meizhen,Li Yang,et al.Recent Molecular Characterization of Porcine Rotaviruses Detected in China and Their Phylogenetic Relationships with Human Rotaviruses[J].Viruses 2024,16,453.
[8] Tao Ran,Chang Xinjian,Zhou Jinzhu,et al.Molecular epidemiological investigation of group A porcine rotavirus in East China.[J].Frontiers in Veterinary Science,2023,10:1138419.doi: 10.3389/fvets.2023.1138419.
[9] 李国平,伊顺仁.仔猪轮状病毒的感染情况调查[J].福建畜牧兽医,1999(2):21.
[10] 谷拉强,陶 然,程 曦,等.2022—2023年我国部分地区猪A群轮状病毒分子流行病学调查分析[J].南方农业学报,2023,54(10):3083-3091.
收稿日期:2024-11-19
作者简介:陈小丽(1982—),女,本科。研究方向:动物传染病。

