基于超声影像组学特征构建的联合模型鉴别1期三阴性乳腺癌与纤维腺瘤的临床价值


摘" " 要" " 目的" " 探讨基于超声影像组学特征构建的联合模型对1期三阴性乳腺癌(TNBC)与纤维腺瘤的鉴别诊断价值。方法" " 选取我院经病理确诊的乳腺病变患者340例,包括1期TNBC患者133例(TNBC组)和纤维腺瘤患者207例(纤维腺瘤组),再将数据集以7∶3比例随机分为训练集(238例)和验证集(102例)。比较TNBC组与纤维腺瘤组常规超声检查结果的差异,采用多因素Logistic回归分析筛选鉴别1期TNBC与纤维腺瘤的独立影响因素。基于训练集数据,使用3D-slicer软件的Radiomics扩展包提取超声影像组学特征,通过最小绝对收缩和选择算子和Logistic回归筛选最优特征,计算影像组学评分(Radscore)。分别构建临床模型、超声影像组学模型及联合模型,绘制受试者工作特征(ROC)曲线评估各模型对1期TNBC与纤维腺瘤的鉴别诊断效能。结果" " TNBC组与纤维腺瘤组BI-RADS分类、纵横比、后方回声、钙化、形态、Adler血流分级比较差异均有统计学意义(均Plt;0.05)。多因素Logistic回归分析显示,BI-RADS分类为鉴别1期TNBC与纤维腺瘤的独立危险因素(OR=1.22,P=0.002)。共提取851个超声影像组学特征,在对数据集进行标准化和归一化后,最终筛选获得12个最优特征,计算获得训练集中TNBC组和纤维腺瘤组Radscore分别为(-4.31±0.55)分、(3.75±0.75)分;验证集中TNBC组和纤维腺瘤组Radscore分别为(-4.24±0.32)分、(2.94±0.68)分,两组比较差异均有统计学意义(均Plt;0.05)。由于年龄在鉴别乳腺肿瘤良恶性中具有重要的参考价值,故本研究纳入年龄、BI-RADS分类构建临床模型,纳入年龄、BI-RADS分类、Radscore构建联合模型。ROC曲线分析显示,临床模型、超声影像组学模型、联合模型鉴别诊断训练集和验证集中1期TNBC与纤维腺瘤的曲线下面积分别为0.954、0.837、0.983和0.881、0.815、0.942,以联合模型的曲线下面积最高,与其他模型比较差异均有统计学意义(均Plt;0.05)。结论" " 基于年龄、BI-RADS分类、超声影像组学特征构建的联合模型对1期TNBC与纤维腺瘤具有良好的鉴别诊断价值。
关键词" " 超声检查;影像组学;三阴性乳腺癌;纤维腺瘤;鉴别诊断
[中图法分类号]R445.1;R737.9" " " [文献标识码]A
Clinical value of a combined model based on ultrasound radiomics features in
differentiating stage 1 triple negative breast cancer from fibroadenoma
FU Qihuan,YAN Yulian,KONG Yiting,YU Shuqi,LIU Rong
Department of Ultrasound,the First Clinical Medical College of China Three Gorges University,Yichang Central People’s Hospital,Yichang 443000,China
ABSTRACT" " Objective" " To investigate the diagnostic value of a combined model based on ultrasound radiomics features in differentiating stage 1 triple negative breast cancer(TNBC) from fibroadenoma.Methods" " A total of 340 patients with pathologically confirmed breast lesions in our hospital were selected,including 133 patients with stage 1 TNBC(TNBC group) and 207 patients with fibladenoma(fibladenoma group).The data set was randomly divided into a training set(238 cases) and a validation set(102 cases) in a ratio of 7∶3.The differences of conventional ultrasound examination between the TNBC group and the fibladenoma group were compared,and multivariate Logistic regression analysis was used to screen independent influencing factors for differentiating stage 1 TNBC from fibroadenoma.The Radiomics extension package of 3D-slicer software was used to extract the ultrasound radiomics features,the minimum absolute contraction and selection operator and Logistic regression were used to screen the optimal features,the Radscore was caculated.The clinical model,ultrasound radiomics model and combined model were constructed,and receiver operating characteristic(ROC) curve was drawn to evaluate the differential diagnostic efficacy of stage 1 TNBC and fibroadenoma.Results" " There were gignificant differences in BI-RADS classification,aspect ratio,posterior echo,calcification,morphology and Adler blood flow grading between the TNBC group and the fibroadenoma group(all Plt;0.05).Multivariate Logistic regression analysis showed that BI-RADS classification was independent risk factors for differentiating stage 1 TNBC from fibroadenoma(OR=1.22,P=0.002).Totally,851 ultrasound radiomics features were extracted.Following the normalisation of the data set,a total of 12 optimal features were ultimately selected.The Radscore of the TNBC group and fibroadenoma group in training set were (-4.31±0.55)points and (3.75±0.75)points,respectively.The Radscore of the TNBC group and fibronenoma group were in verification set were (-4.24±0.32)points and (2.94±0.68) points,respectively.The differences were statistically significant(all Plt;0.05).Since age has an important reference value in differentiating benign from malignant breast tumors,age and BI-RADS classification were included in this study to construct a clinical model,age,BI-RADS classification and Radscore were included" to construct a combined model.ROC curve analysis showed that the area under the curve of clinical model,ultrasound radiomics model,combined model for differential diagnosing stage 1 TNBC and fibroadenoma in training set and validation set were 0.954,0.837,0.983 and 0.881,0.815,0.942,respectively.The combined model exhibited the highest area under the curve,and the differences were statistically significant compared with other models (all Plt;0.05).Conclusion" " The combined model based on age,BI-RADS and ultrasound radiomics features has a good value in the differential diagnosis of stage 1 TNBC and fibroadenoma.
KEY WORDS" " Ultrasonography;Radiomics;Triple negative breast cancer;Fibroadenoma;Differential diagnosis
三阴性乳腺癌(triple negative breast cancer,TNBC)被认为是最具侵袭性的乳腺癌类型,其特征在于雌激素受体、孕激素受体及人表皮生长因子受体-2表达均呈阴性,约占新诊断乳腺癌的10%[1]。与其他分子亚型相比,TNBC更具恶性生物学行为,且TNBC常表现为无钙化,因此在乳腺钼靶检查中的诊断准确率相对较低,约18%的TNBC在最初的钼靶检查中可能被漏诊。乳腺超声筛查有助于识别高危患者,但受超声医师经验及水平的影响,判别体积较小的乳腺肿瘤时可能存在一定难度。TNBC的MRI征象包括肿瘤增强、T2高信号、边缘光滑及边缘增强,但亦可呈良性表现如肿瘤呈椭圆形或圆形、边界清晰、后方回声增强等[2],易导致假阴性结果。影像组学是一种新兴的诊断方法,其可从影像图像中获取肉眼难以识别的特征用于疾病诊断、治疗反应评估和预后预测。Hong等[3]研究联合影像组学评分(Radscore)和BI-RADS分类构建列线图模型,发现其在鉴别BI-RADS 4、5类乳腺肿瘤良恶性中有一定的临床价值。既往研究[4]也证实基于超声图像的纹理特征分析在鉴别早期浸润性乳腺癌良恶性方面具有潜在的诊断性能。临床中将1期TNBC定义为肿瘤最大径lt;2.0 cm、癌细胞未出现转移的TNBC。本研究旨在探讨基于超声影像组学特征构建的联合模型对1期TNBC与纤维腺瘤的鉴别诊断价值。
资料与方法
一、研究对象
选取2020年2月至2023年11月我院收治的女性乳腺病变患者340例,包括1期TNBC患者133例(TNBC组)和纤维腺瘤患者207例(纤维腺瘤组)。TNBC组年龄35~75岁,平均(53.2±12.1)岁,肿瘤最大径0.5~1.6 cm,平均(1.49±0.40)cm,其中行保乳手术121例,改良根治术12例;纤维腺瘤组年龄22~56岁,平均(39.5±10.0)岁,肿瘤最大径0.6~1.9 cm,平均(1.31±0.40)cm。以7∶3比例随机分为训练集(238例,TNBC组89例,纤维腺瘤组149例)和验证集(102例,TNBC组44例,纤维腺瘤组58例)。纳入标准:①均行手术治疗,并经术后病理确诊;②肿瘤最大径均lt;2.0 cm;③临床及影像检查资料完整;④TNBC组患者未接受过抗癌治疗(化疗、放疗或内分泌治疗)。排除标准:①病理结果不明确;②有腋窝淋巴结及远处转移;③靶病灶在超声图像中不完全可见;④病理提示有弥漫性广泛导管内成分。本研究经我院医学伦理委员会批准,为回顾性研究故免除患者知情同意。
二、仪器与方法
1.超声检查:使用迈瑞Resona 9S彩色多普勒超声诊断仪,L11-3U探头,频率3~11 MHz。患者取仰卧位,调整成像参数使目标肿瘤得到最佳可视化,记录肿瘤最大径、纵横比、内部回声类型、后方回声、钙化、边界、形态、血流情况(Adler血流分级),并进行BI-RADS分类,留存肿瘤最大径切面的灰阶超声图像。以上操作均由2名经验丰富的超声医师完成,所有参数均重复测量3次取平均值。对于多发乳腺肿瘤患者,本研究仅纳入BI-RADS分类最高者进行分析,以保证每次观察的统计独立性。
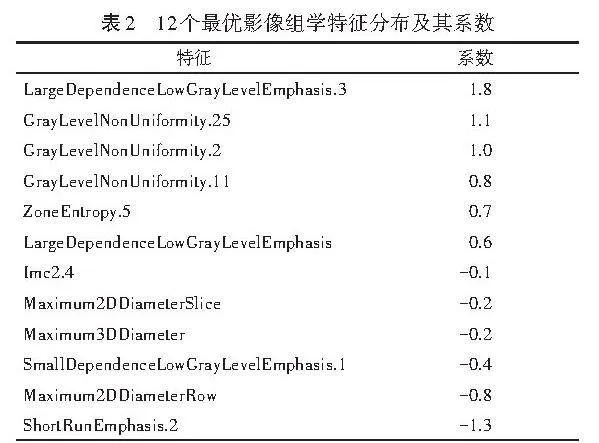
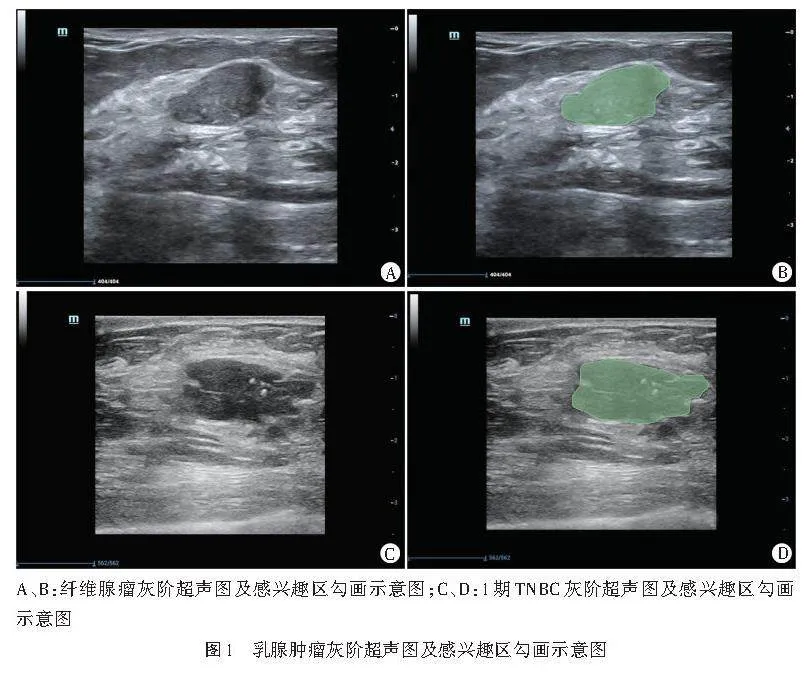
2.特征提取、筛选及超声影像组学模型构建:将留存的灰阶超声图像以DICOM格式导入3D-slicer软件进行影像组学分析。由两名经验丰富的超声医师沿乳腺肿瘤边缘手动勾画感兴趣区,使其尽可能包括整个病灶(图1),应用“Radiomics”开源扩展包提取影像组学特征,包括肿瘤的形态特征、一阶直方图特征、二阶纹理特征等。采用Spearman相关分析法评估两名超声医师分割特征的相关性,确保所选特征的稳定性,rgt;0.80则被认定为特征稳定。采用最大相关性最小冗余算法优化特征选择,以减少特征间的冗余;采用最小绝对收缩和选择算子(LASSO)算法和十折交叉验证法,通过调整惩罚参数(λ)筛选出最优特征。再分别通过其系数加权计算Radscore,并以此作为超声影像组学模型。
三、统计学处理
应用SPSS 24.0统计软件,计量资料以x±s表示,采用t检验;计数资料以例或率表示,采用χ2检验。应用R 4.2.2语言进行影像组学分析及模型构建。采用多因素Logistic回归分析筛选鉴别1期TNBC与纤维腺瘤的独立影响因素。由于既往研究[4-9]认为年龄在鉴别乳腺肿瘤良恶性中具有重要的参考价值,故本研究也将年龄纳入多因素Logistic回归并构建临床模型,基于上述独立影响因素及Radsore构建联合模型。绘制受试者工作特征(ROC)曲线评估各模型对1期TNBC与纤维腺瘤的鉴别诊断效能,曲线下面积(AUC)比较采用Delong检验;校准曲线评估模型预测概率与实际概率的一致性。Plt;0.05为差异有统计学意义。
结" 果
一、TNBC组与纤维腺瘤组超声检查结果比较
TNBC组与纤维腺瘤组纵横比、后方回声、钙化、形态、Adler血流分级及BI-RADS分类比较差异均有统计学意义(均Plt;0.05);最大径、内部回声类型、边界比较差异均无统计学意义。见表1。
二、多因素Logistic回归分析及临床模型构建
多因素Logistic回归分析显示,年龄、BI-RADS分类均为鉴别1期TNBC与纤维腺瘤的独立危险因素(OR=1.05、1.22,P=0.024、0.002)。以此构建临床模型,方程式为:Logit(P)=-2.197+1.058×年龄+1.257×BI-RADS分类。
三、超声影像组学特征筛选及模型构建
基于训练集数据,每张图像均提取了851个超声影像组学特征。经LASSO回归和十折交叉验证法筛选,最终获得12个系数非零的特征。见图2和表2。训练集中TNBC组和纤维腺瘤组Radscore分别为(-4.31±0.55)分、(3.75±0.75)分;验证集中TNBC组和纤维腺瘤组Radscore分别为(-4.24±0.32)分、(2.94±0.68)分,两组比较差异均有统计学意义(均Plt;0.05)。
四、联合模型构建
纳入Radscore、年龄及BI-RADS分类构建联合模型,方程式为:Logit(P)=-6.718+2.564×年龄+3.256×BI-RADS分类-4.342×Radscore。
五、模型的诊断效能及验证
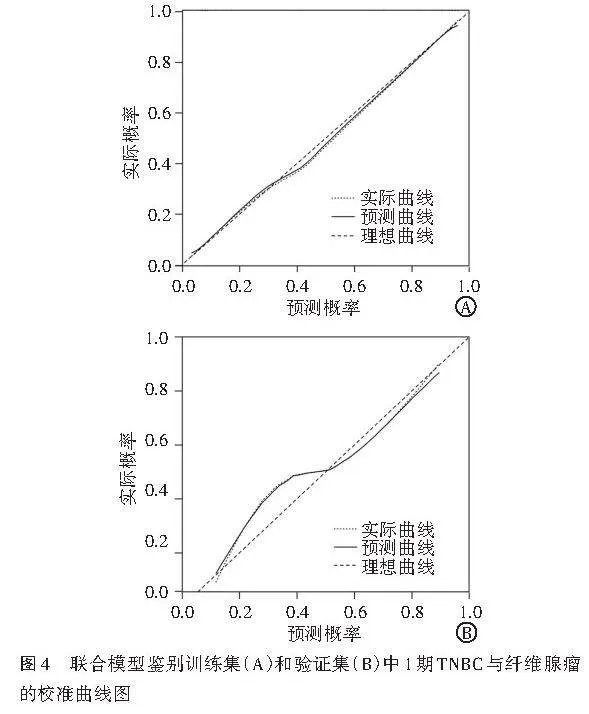
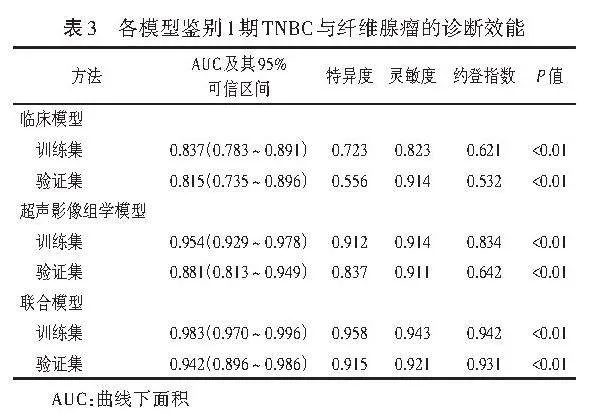
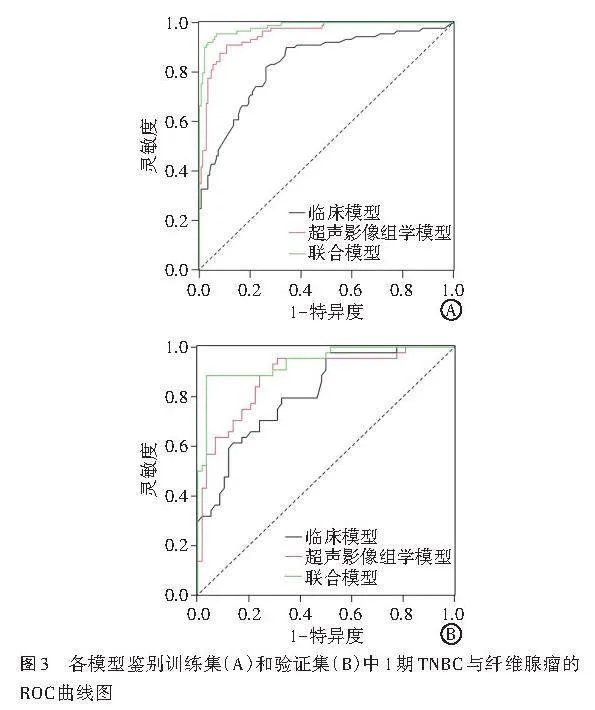
ROC曲线分析显示,临床模型鉴别诊断训练集和验证集中1期TNBC与纤维腺瘤的AUC分别为0.837、0.815;超声影像组学模型鉴别训练集和验证集中1期TNBC与纤维腺瘤的AUC分别为0.954、0.881;联合模型鉴别训练集和验证集中1期TNBC与纤维腺瘤的AUC分别为0.983、0.942,均高于临床模型和超声影像组学模型的AUC,差异均有统计学意义(均Plt;0.05)。见图3和表3。校准曲线分析显示,联合模型预测概率与实际概率具有良好的一致性。见图4。
讨" 论
乳腺癌是我国女性最常见的癌症类型,占新诊断癌症病例的16.72%[9]。2023年美国癌症统计报告[10]显示乳腺癌发病率居所有癌症首位。由于1期TNBC肿瘤体积较小,常规超声检查中肉眼难以分辨其良恶性图像特征,术前准确诊断较为困难。超声影像组学可从超声图像中提取肉眼无法识别的高通量信息,将影像图像转化为具有高分辨率、可挖掘的定量数据。本研究旨在探讨基于超声影像组学特征构建的联合模型对1期TNBC与纤维腺瘤的鉴别诊断价值。
本研究结果显示,TNBC组与纤维腺瘤组纵横比、后方回声、钙化、形态、Adler血流分级及BI-RADS分类比较差异均有统计学意义(均Plt;0.05),与既往研究[11-14]结果相符,提示在临床工作中当发现乳腺肿瘤纵横比gt;1、后方回声增强、内部有钙化、形态不规则、血流丰富、BI-RADS分类4A及以上时,需警惕恶性病变的可能。Young等[15]研究显示,TNBC较纤维腺瘤更多表现为内部低回声,但本研究中大部分TNBC(81/133,60.9%)和纤维腺瘤(143/207,69.1%)均表现为内部低回声,两组比较差异无统计学意义。这一结果可以归因于TNBC的高度去分化特性和易形成坏死性囊肿,超声表现多为低回声[16];纤维腺瘤由腺上皮和纤维组织构成,较少出现细胞坏死或囊性病灶,一般情况下其内部回声较TNBC更高,但当病灶体积较小时TNBC与纤维腺瘤的内部回声从肉眼观察难以准确分辨。Du等[4]研究显示,患者年龄、BI-RADS分类及Radscore均为鉴别TNBC与纤维腺瘤的独立预测因子,且BI-RADS 4B类及以上的TNBC患者(56例)占比明显多于纤维腺瘤患者(27例),差异有统计学意义(Plt;0.01)。本研究中13.0%(27/207)的纤维腺瘤患者和38.3%(51/133)的TNBC患者被归为BI-RADS 4B类及以上,且二者年龄分别为(39.5±10.0)岁、(53.2±12.1)岁,两组BI-RADS分类、年龄比较差异均有统计学意义(均Plt;0.01)。由于大量研究[4-9]认为年龄在鉴别乳腺肿瘤良恶性中具有重要的参考价值,故本研究也将年龄纳入多因素Logistic回归,结果显示年龄、BI-RADS分类均为鉴别1期TNBC与纤维腺瘤的独立危险因素(OR=1.05、1.22,P=0.024、0.002),由此构建的临床模型在鉴别1期TNBC与纤维腺瘤中具有良好的诊断效能,其在训练集和验证集的AUC分别为0.837、0.815,提示在临床实践中,患者年龄和BI-RADS分类可以作为鉴别纤维腺瘤与1期TNBC的有效参数。
既往[17-18]研究显示,纹理分析在基于超声形态学特征的临床诊断、区分病变良恶性和乳腺癌亚型、评估新辅助化疗疗效及预测无病生存期[14]等方面均表现良好,充分证实了影像组学在临床诊治中的重要作用。Lee等[19]研究纳入了715 例纤维腺瘤和186例TNBC患者的图像资料,使用惩罚逻辑回归和LASSO算法从730个影像组学特征中最终筛选出26个特征并建立模型,且该模型鉴别纤维腺瘤与TNBC的AUC为0.838,但该研究并未对患者的超声图像特征及临床信息进行分析。此外,Moon等[20]应用基于计算机辅助诊断的超声纹理特征鉴别诊断TNBC与纤维腺瘤,结果显示其AUC为0.840,但该研究仅纳入了169例患者,其模型的重复性和鲁棒性可能并不理想。本研究从238例乳腺病变患者的超声图像中提取影像组学特征,并对其进行标准化和归一化处理,经特征降维后最终筛选出12个系数非零的最优特征,通过计算获得训练集和验证集中TNBC组、纤维腺瘤组在Radscore分别为(-4.31±0.55)分、(3.75±0.75)分和(-4.24±0.32)分、(2.94±0.68)分,两组比较差异均有统计学意义(均Plt;0.05),与研究[4,19-20]结果相似,表明Radscore可作为预测TNBC和纤维腺瘤的独立生物标志物,对于指导临床实践和提高诊治水平具有重要的意义。本研究ROC曲线分析显示,超声影像组学模型鉴别训练集和验证集中1期TNBC与纤维腺瘤的AUC分别为0.954和0.881,表明超声影像组学特征在鉴别1期TNBC与纤维腺瘤方面亦具有较高的诊断价值。本研究进一步纳入年龄、BI-RADS分类、Radscore构建了联合模型,ROC曲线分析显示其鉴别训练集和验证集中1期TNBC与纤维腺瘤的AUC分别为0.983、0.942,均高于临床模型和超声影像组学模型的AUC,差异均有统计学意义(均Plt;0.05);校准曲线分析显示联合模型在训练集和验证集的预测概率与实际概率具有良好的一致性。由此可见,联合模型在鉴别1期TNBC与纤维腺瘤中具有最优的诊断效能。
本研究的局限性:①为单中心、回顾性研究;②纳入患者非连续病例且样本量相对较小,可能存在选择偏倚;③提取超声影像组学特征时于肿瘤最大径切面手动勾画ROI,可能无法完全准确地反映整个肿瘤的特征。今后需行多中心的前瞻性研究进一步验证。
综上所述,基于超声影像组学特征、年龄、BI-RADS分类构建的联合模型对1期TNBC与纤维腺瘤具有良好的鉴别诊断效能,对于指导临床医师制定治疗方案具有重要的意义。
参考文献
[1] Karim AM,Kwon JE,Ali T,et al.Triple-negative breast cancer:epidemiology,molecular mechanisms,and modern vaccine-based treatment strategies[J].Biochem Pharmacol,2023,212:115545.
[2] Ohashi A,Kataoka M,Iima M,et al.A multiparametric approach to predict triple-negative breast cancer including parameters derived from ultrafast dynamic contrast-enhanced MRI[J].Eur Radiol,2023,33(11):8132-8141.
[3] Hong ZL,Chen S,Peng XR,et al.Nomograms for prediction of breast cancer in breast imaging reporting and data system(BI-RADS) ultrasound category 4 or 5 lesions:a single-center retrospective study based on radiomics features[J].Front Oncol,2022,12:894476.
[4] Du Y,Zha HL,Wang H,et al.Ultrasound-based radiomics nomogram for differentiation of triple-negative breast cancer from fibroadenoma[J].Br J Radiol,2022,95(1133):20210598.
[5] Tagliafico AS,Piana M,Schenone D,et al.Overview of radiomics in breast cancer diagnosis and prognostication[J].Breast,2020,49(2):74-80.
[6] Teichgraeber DC,Guirguis MS,Whitman GJ.Breast cancer staging:updates in the AJCC cancer staging manual,8th edition,and current challenges for radiologists,from the AJR special series on cancer staging[J].Am J Roentgenol,2021,217(2):11-13.
[7] Candelaria RP,Spak DA,Rauch GM,et al.BI-RADS ultrasound lexicon descriptors and stromal tumor-infiltrating lymphocytes in triple-negative breast cancer[J].Acad Radiol,2022,29(Suppl 1):S35-S41.
[8] Qingyu C,Jianguo X,Jun Z.Identify the triple-negative and non-triple-negative breast cancer by using texture features of medicale ultrasonic image:a STROBE-compliant study[J].Medicine(Baltimore),2021,100(22):e25878.
[9] 张思维,郑荣寿,孙可欣,等.2016年中国恶性肿瘤分地区发病和死亡估计:基于人群的肿瘤登记数据分析[J].中国肿瘤,2023,32(5):321-332.
[10] Siegel RL,Miller KD,Wagle NS,et al.Cancer statistics,2023[J].CA Cancer J Clin,2023,73(1):17-48.
[11] 李明,李娜,陆欣贤,等.超声特征和几何圆度鉴别诊断最大径lt;2 cm三阴性乳腺癌和纤维腺瘤的价值[J].临床超声医学杂志,2021,23(3):175-178.
[12] Yang L,Zhang B,Ren F,et al.Rapid segmentation and diagnosis of breast tumor ultrasound images at the sonographer level using deep learning[J].Bioengineering(Basel),2023,10(10):1220.
[13] Leon-Ferre RA,Goetz MP.Advances in systemic therapies for triple negative breast cancer[J].BMJ,2023,381:e071674.
[14] Wang H,Li X,Yuan Y,et al.Association of machine learning ultrasound radiomics and disease outcome in triple negative breast cancer[J].Am J Cancer Res,2022,12(1):152-164.
[15] Young GY,Hee JC,Hee HK,et al.Sonographic features that can be used to differentiate between small triple-negative breast cancer and fibroadenoma[J].Ultrasonography,2018,37(2):149-156.
[16] Li X,Zhu X,Jiang S,et al.The value of elastography strain rate ratio in benign and malignant BI-RADS-US 3-4 breast masses[J].Biomol Biomed,2024,24(3):625-632.
[17] Huang Y,Zhu T,Zhang X,et al.Longitudinal MRI-based fusion novel model predicts pathological complete response in breast cancer treated with neoadjuvant chemotherapy:a multicenter,retrospective study[J].EClinicalMedicine,2023,58:101899.
[18] Yu FH,Miao SM,Li CY,et al.Pretreatment ultrasound-based deep learning radiomics model for the early prediction of pathologic response to neoadjuvant chemotherapy in breast cancer[J].Eur Radiol,2023,33(8):5634-5644.
[19] Lee SE,Han K,Kwak JY,et al.Radiomics of US texture features in differential diagnosis between triple-negative breast cancer and fibroadenoma[J].Sci Rep,2018,8(1):13546.
[20] Moon WK,Huang YS,Lo CM,et al.Computer-aided diagnosis for distinguishing between triple-negative breast cancer and fibroadenomas based on ultrasound texture features[J].Med Phys,2015,42(6):3024-3035.
(收稿日期:2024-03-11)
作者单位:三峡大学第一临床医学院 宜昌市中心人民医院超声科,湖北 宜昌 443000
通讯作者:刘蓉,Email:stream0917@163.com

