基于超声影像组学和临床特征构建的联合模型诊断早期卵巢癌的临床价值


摘" " 要" " 目的" " 基于超声影像组学和临床特征构建联合模型,探讨其诊断早期卵巢癌的临床价值。方法" " 选取2012年1月至2023年1月于我院接受手术治疗的卵巢肿瘤患者272例,按7∶3比例随机分为训练集190例和内部验证集82例;另选2023年2月至2024年5月杭州市第一人民医院收治的卵巢肿瘤患者80例作为外部验证集。所有患者均行常规超声检查获得肿瘤位置、最大径、形态、外轮廓分界、Adler血流分级、肿瘤内部成分构成、肿瘤实性成分最大径、肿瘤内部乳头数量及腹水情况;收集患者年龄、绝经情况及血清肿瘤标志物。根据术后病理结果分为早期卵巢癌组和良性组,比较各数据集中两组上述参数的差异。基于训练集患者的术前二维超声灰阶图像提取超声影像组学特征,采用贪婪递归特征去除策略和最小绝对收缩和选择算子回归分析降维,保留系数非零的最优特征构建影像组学评分(Radscore)。采用单因素和多因素Logistic回归筛选诊断早期卵巢癌的独立影响因素,分别构建临床模型、联合模型并绘制列线图可视化。采用受试者工作特征(ROC)曲线、校准曲线、临床决策曲线评估各模型的区分度、校准度及临床适用性,并进行内部和外部验证。结果" " 训练集中两组人附睾蛋白4(HE4)、肿瘤实性成分最大径、肿瘤最大径、肿瘤内部成分构成、Adler血流分级、腹水比较差异均有统计学意义(均Plt;0.05);内部验证集中两组HE4、糖类抗原125(CA125)、肿瘤实性成分最大径、肿瘤最大径、Adler血流分级、腹水比较差异均有统计学意义(均Plt;0.05);外部验证集中两组HE4、CA125、肿瘤最大径、Adler血流分级比较差异均有统计学意义(均Plt;0.05)。共提取1050个超声影像组学特征,经筛选及降维后保留13个系数非零的最优特征并计算Radscore即为影像组学模型。根据单因素和多因素Logistic回归分析结果,纳入Adler血流分级、肿瘤实性成分最大径、肿瘤最大径构建诊断早期卵巢癌的临床模型;纳入肿瘤实性成分最大径、Adler血流分级、Radscore构建诊断早期卵巢癌的联合模型。ROC曲线分析显示,联合模型在训练集、内部验证集、外部验证集中的曲线下面积分别为0.931、0.881、0.851,均高于临床模型(0.814、0.714、0.833)和影像组学模型(0.892、0.831、0.833),差异均有统计学意义(均Plt;0.05)。校准曲线分析显示,联合模型在训练集、内部验证集和外部验证集的校准度均较好。临床决策曲线分析显示,在训练集和外部验证集中,联合模型在0.05~1.00概率阈值范围内的临床净获益最大;在内部训练集中,联合模型在0.30~0.60概率阈值范围内的临床净获益最大,影像组学模型在0.18~0.30及0.60~0.90概率阈值范围内则可获得更大的临床净获益。结论" " 基于超声影像组学和临床特征构建的联合模型可无创、准确地诊断早期卵巢癌,具有良好的泛化能力,有一定的临床价值。
关键词" " 超声检查;影像组学;卵巢癌,早期;鉴别诊断
[中图法分类号]R445.1;R737.31" " " [文献标识码]A
Clinical value of a combined model based on ultrasound radiomics and clinical features in the diagnosis of early ovarian cancer
HE Liying1,CHANG Yuhao2,MA Qiang1,WEI Wei1,YAN Na1,ZHU Feifei1,JIANG feng1
1.Department of Ultrasound,the First Affiliated Hospital of Wannan Medical College,Yijishang Hospital,Wuhu 241000,China.
2.Department of Ultrasound,Hangzhou First People’s Hospital,Hangzhou 310000,China
ABSTRACT" " Objective" " To establish a combined model based on ultrasound radiomics and clinical features,and to explore the clinical value of the model" in the diagnosis of early ovarian cancer.Methods" " A total of 272 patients with ovarian tumors who received surgical treatment in our hospital from January 2012 to January 2023 were selected,and they were randomly divided into 190 cases in training set and 82 cases in internal verification set according to the ratio of 7∶3.While 80 patients with ovarian tumor in Hangzhou First People’s Hospital from February 2023 to May 2024 were selected as independent external validation set.All patients underwent routine ultrasound examination to obtain tumor location,maximum diameter,morphology,outer contour boundary,Adler blood flow grading,tumor internal composition,maximum diameter of solid tumor components,number of papillae within the tumor,and presence of ascites.The age,menopausal status,and serum tumor marker levels of patient were collected.According to the postoperative pathological results,the patients were divided into early ovarian cancer group and benign group,and the differences of above parameters between the two groups in each dataset were compared.The ultrasound radiomics features were extracted based on preoperative two-dimensional ultrasound grayscale images of patients in the training set,the greedy recursive feature removal strategy and the minimum absolute shrinkage and selection operator regression analysis were used to reduce the dimensionality,and the optimal features with non-zero coefficients were retained to construct the radiomics score(Radscore).Single factor and multiple factor Logistic regression were used to screen the independent influencing factors in the diagnosis of early ovarian cancer.A clinical model and a combined model were constructed,and visualized with Nomogram.The discrimination,calibration and clinical applicability of each model were evaluated by receiver operating characteristic(ROC) curve,calibration curve and clinical decision curve,and conduct internal and external validation.Results" " There were significant differences in human epididymis protein 4(HE4),maximum diameter of solid tumor components,maximum diameter,tumor internal composition,Adler blood flow grading and ascites between the two groups in training set(all Plt;0.05).There were significant differences in HE4,CA125,maximum diameter of solid tumor components,maximum diameter,Adler blood flow grading and ascites between the two groups in internal validation set(all Plt;0.05).There were significant differences in HE4,CA125,maximum diameter,Adler blood flow grading between the two groups in external validation set(all Plt;0.05).A total of 1050 ultrasound radiomics" features were extracted,and after screening and dimensionality reduction,13 optimal features with non-zero coefficients were retained and Radscore was calculated as the radiomics model.According to the results of univariate and multivariate Logistic regression analysis, a clinical model for diagnosing early ovarian cancer was constructed by incorporating the Alder blood flow grading,maximum diameter of tumor solid components and maximum diameter,and a combined model for diagnosing early ovarian cancer was constructed by incorporating the maximum diameter of tumor components, Adler blood flow grading and Radscore.ROC curve analysis showed that the area under the curve of the combined model in training set,internal validation set and external validation set were 0.931,0.881,and 0.851,respectively,which were higher than those of the clinical model(0.814,0.714,0.833) and the radiomics model(0.892,0.831,0.833),the differences were statistically significant(all Plt;0.05).Calibration curve analysis showed that the combined model had good calibration performance in training set,internal validation set,and external validation set.Clinical decision curve analysis showed that the combined model had the highest net benefit within the threshold range of 0.05~1.00 in training set and external validation set,while it had the highest clinical net benefit within the threshold range of 0.30~0.60 in internal training set,and the radiomics model showed higher net benefit within the threshold ranges of 0.18~0.30 and 0.60~0.90.Conclusion" " The combined model based on ultrasound radiomics and clinical features can non invasively and accurately diagnose early ovarian cancer,with good generalization ability and certain clinical value.
KEY WORDS" " "Ultrasonography;Radiomics;Ovarian cancer,early;Differential diagnosis
卵巢癌发病率较高,是女性常见的生殖系统疾病[1]。研究[2]报道2020年全球有30多万新发卵巢癌患者,20多万患者死于卵巢癌相关疾病,仅不足30%的患者在早期得到诊治。早期卵巢癌的临床症状较隐匿,影像学特征容易出现重叠,肿瘤标志物常处于正常水平[3]。故在临床工作中,通过检查者肉眼识别的影像学检查、实验室检查和患者的临床症状等传统手段来诊断早期卵巢癌极其困难。影像组学是一种新兴的医学诊断方法,其通过提取肉眼难以识别的高通量影像特征,并将这些特征信息转化成定量参数进行分析和建模,从而提高了对疾病的鉴别诊断和预测预后的能力[4]。应用超声影像组学鉴别早期卵巢癌的研究目前鲜有报道,如何利用非侵入性的方法提高早期卵巢癌的诊断准确率是目前临床研究的热点和难点。基于此,本研究构建了一种基于超声影像组学和临床特征的联合模型,并探讨其鉴别早期卵巢癌与良性卵巢肿瘤的临床价值,旨在寻找一种准确、无创诊断早期卵巢癌的有效工具。
资料与方法
一、研究对象
选取2012年1月至2023年1月于我院接受手术治疗的卵巢肿瘤患者272例,根据术后病理结果分为良性组142例(浆液性肿瘤80例、黏液性肿瘤37例、纤维-卵泡膜细胞瘤17例、良性Brenner瘤8例)和早期卵巢癌组130例(上皮性肿瘤104例、生殖性肿瘤18例、性索间质肿瘤6例、其他2例)。并按7∶3的比例随机分为训练集190例和内部验证集82例。另选2023年2月至2024年5月杭州市第一人民医院收治的卵巢肿瘤患者80例作为外部验证集,其中良性组36例(浆液性肿瘤15例、黏液性肿瘤5例、纤维-卵泡膜细胞瘤15例、良性Brenner瘤1例),早期卵巢癌组44例(上皮性肿瘤30例、生殖性肿瘤6例、性索间质肿瘤3例、其他2例)。纳入标准:①术前均行常规超声检查(经腹部、经腔内超声或两者联合应用);②经手术病理证实来源卵巢的肿瘤;③临床资料完整;④术前未行穿刺、放化疗等临床治疗。排除标准:①典型良性病变、单发性和多房性纯囊性肿物;②超声图像质量差,临床资料不完整;③多发病灶;④合并其他肿瘤病变。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.超声检查:使用开立P60、Philips Affiniti 70w彩色多普勒超声诊断仪,腔内探头频率3~10 MHz,腹部探头频率1~5 MHz。参照O-RADS标准,采用经腔内超声检查或经腔内超声联合经腹部超声检查获取完整卵巢肿瘤图像。经腹部检查时患者取平卧位,经阴道检查前患者需排空膀胱,取膀胱截石位。常规探查并记录肿瘤位置、最大径、形态、边缘、Adler血流分级、肿瘤内部成分构成、肿瘤实性成分最大径、肿瘤内部乳头(实性成分高度≥3 mm)数量及腹水情况。其中肿瘤内部成分构成根据卵巢肿瘤内部囊性与实性成分占比,分为4种类型:以实性为主(2/3≤实性成分占比≤4/5)、完全实性(实性成分占比gt;4/5)、以囊性为主(囊性成分占比gt;2/3)、混合型(1/3≤实性成分占比≤2/3)。腹水判别标准为当子宫前位时液体超过道格拉斯窝并延伸至宫底,子宫后位时液体达到子宫前/上方。由2名具有5年以上工作经验的主治超声医师分别进行检查,若结果出现分歧则请1名具有10年以上工作经验的副高级超声医师进行最终判断,所有超声医师对病理结果和临床表现均不知情。
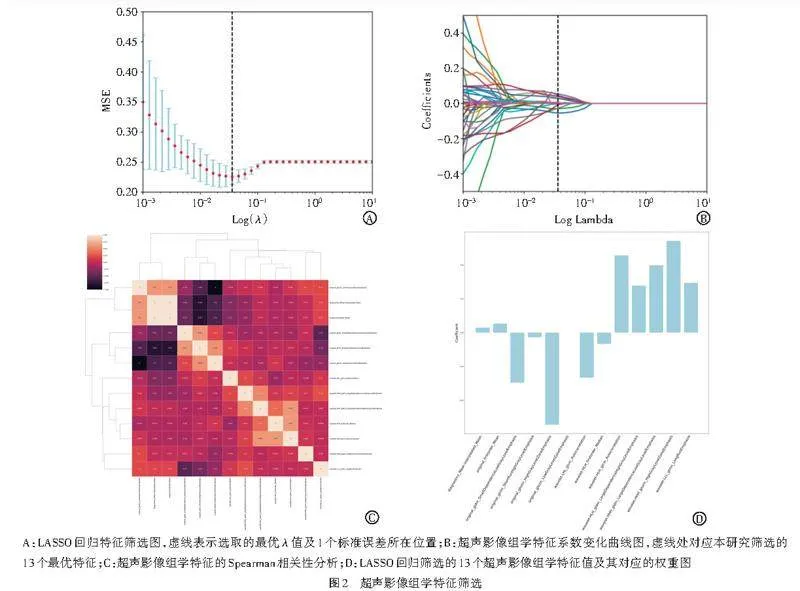
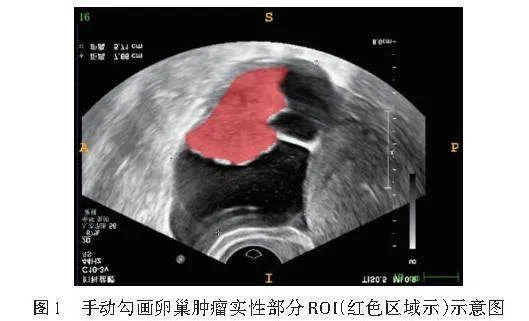
2.超声影像组学特征提取及模型构建:导出患者术前超声图像资料,将JPEG格式的图像转换成Nii.gz格式。由1名具有5年工作经验的主治超声医师在不知晓病理结果的前提下,应用ITK-SNAP软件沿肿瘤实性部分手动勾画感兴趣区(ROI),使用开源软件Python(https://www.python.org/)中的PyRadiomics软件包提取ROI的影像组学特征(图1)。随机抽取30张图像,由另1名主治超声医师以相同方法独立勾画ROI,提取影像组学特征,并于2周后重复上述操作,计算其在观察者内和观察者间的组内相关系数(ICC),将ICCgt;0.75的特征纳入后续分析。使用IQR方法去除gt;1.5倍四分位距范围的样本值,采用Mann-Whitney U检验筛选出差异有统计学意义的特征。对于重复性高的特征,采用Spearman秩相关系数计算特征间的相关性,当rgt;0.9时,保留更具低相关性的特征。采用递归算法实现贪婪策略,每次删除冗余度最大的特征直至保留最优特征集合。对最终筛选出的特征进行max-min标准化处理,以消除不同特征间的单位和量纲影响,确保结果可靠性。同时为避免特征过度拟合,选择最小绝对收缩和选择算子(LASSO)回归分析,通过十折交叉验证最优λ值,并基于具有非零系数的特征计算影像组学评分(Radscore)。
3.临床资料收集:询问患者年龄、绝经情况,收集血清肿瘤标志物,包括糖类抗原199(CA199)、糖类抗原125(CA125)、糖类抗原153(CA153)、癌胚抗原(CEA)、人附睾蛋白4(HE4)等。
三、统计学处理
应用R 4.1.2、Python 3.12.4统计软件,符合正态分布的计量资料以x±s表示,采用独立样本t检验;不符合正态分布的计量资料以M(IQR)表示,采用Mann-Whitney U检验。计数资料以例或率表示,采用χ2检验。采用单因素和多因素Logistic回归分析筛选诊断早期卵巢癌的独立影响因素,基于此构建临床模型,将其联合Radscore构建联合模型并绘制列线图。绘制受试者工作特征(ROC)曲线评估模型的区分度,曲线下面积(AUC)比较采用Delong检验;校准曲线评估模型的校准度;临床决策曲线评估模型的临床适用性,并进行内部和外部验证。Plt;0.05为差异有统计学意义。
结" 果
一、各数据集中良性组与早期卵巢癌组临床资料、超声检查结果比较及临床模型构建
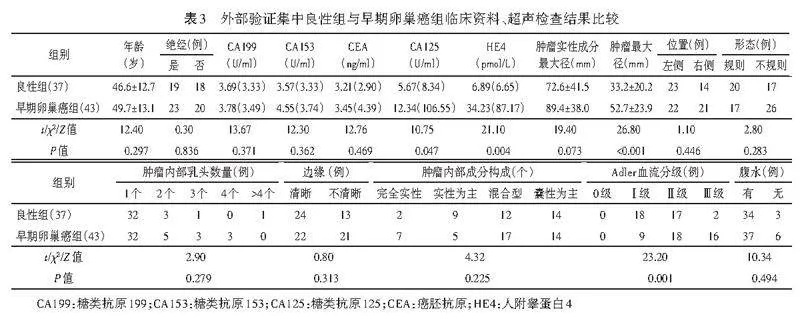
训练集中两组HE4、肿瘤实性成分最大径、肿瘤最大径、肿瘤内部成分构成、Adler血流分级、腹水比较差异均有统计学意义(均Plt;0.05)。内部验证集中两组HE4、CA125、肿瘤实性成分最大径、肿瘤最大径、Adler血流分级、腹水比较差异均有统计学意义(均Plt;0.05)。外部验证集中两组HE4、CA125、肿瘤最大径、Adler血流分级比较差异均有统计学意义(均Plt;0.05)。见表1~3。
单因素及多因素Logistic回归分析显示,Adler血流分级、肿瘤实性成分最大径、肿瘤最大径均为诊断早期卵巢癌的独立影响因素(均Plt;0.05);由此构建临床模型,方程式为:Logit(P)=-3.617+2.435×Adler血流分级+0.007×肿瘤实性成分最大径+0.004×肿瘤最大径。
二、超声影像组学特征筛选及模型构建
共提取了1050个超声影像组学特征,提取的特征种类包括Firstorder、GLCM、GLDM、GLSZM、NGTDM、Shape2d、Log Kernel Size(4,5)、Wavelet Based Features。采用Mann-Whitney U检验筛选出478个Plt;0.05的影像组学特征,进一步采用递归算法实现贪婪策略、max-min标准化方法及LASSO回归分析后,筛选出了13个最优特征,基于此计算Radscore即为影像组学模型。见图2。公式为:Radscore=2.6+0.03×diagnostics_ Mask-interpolated_Mean+0.06×original_firstorder_ Mean-0.008×original_gldm_SmallDependenceLowGray LevelEmphasis-0.048×original_glrlm_ShortRunHighGray LevelEmphasis-0.01×original_glszm_HighGrayLevelZone Emphasis-0.18×original_glszm_LowGrayLevelZoneEmphasis-0.0007×wavelet-LHL_glcm_Autocorrelation-0.2×wavelet-HLH_firstorder_Median+0.93×wavelet-HLH_ glcm_Autocorrelation+0.002×wavelet-HLH_gldm_Large DependenceHighGrayLevelEmphasis+0.078×wavelet-HHH_gldm_LargeDependenceLowGrayLevelEmphasis+0.20×wavelet-HHH_glszm_HighGrayLevelZoneEmphasis+0.81×wavelet-LLL_glrlm_LongRunEmphasis。
三、联合模型构建
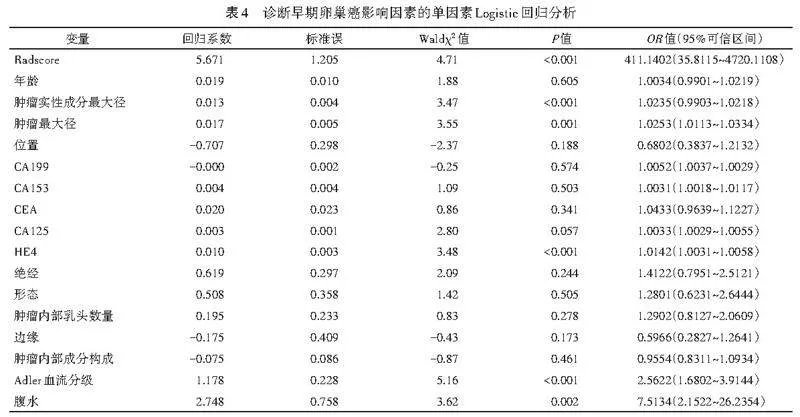
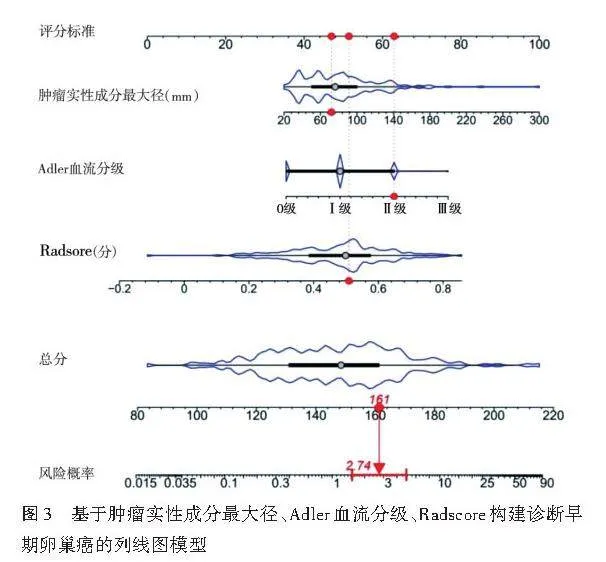
单因素Logistic回归分析显示,Radscore、肿瘤最大径、肿瘤实性成分最大径、HE4、Adler血流分级、腹水均为诊断早期卵巢癌的影响因素(均Plt;0.05)。见表4。将其纳入多因素Logistic回归分析,结果显示Radscore、Adler血流分级、肿瘤实性成分最大径均为诊断早期卵巢癌的独立影响因素(均Plt;0.05)。见表5。由此构建联合模型,方程式为:Logit(P)=-5.255+4.677×Radscore+0.011×肿瘤实性成分最大径+1.019×Adler血流分级。绘制的列线图见图3。
四、模型的效能评估及验证
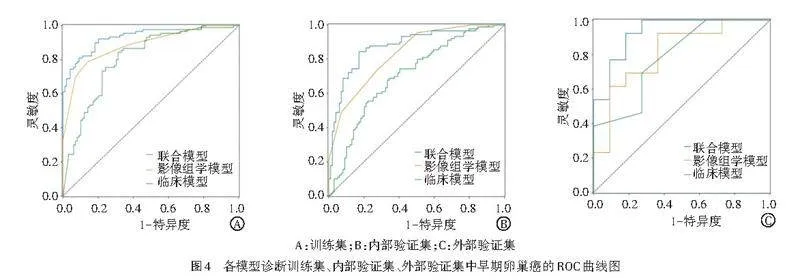
ROC曲线分析显示,联合模型诊断训练集、内部验证集、外部验证集中早期卵巢癌的AUC分别为0.931、0.881、0.851,均高于临床模型(0.814、0.714、0.833)和影像组学模型(0.892、0.831、0.833),差异均有统计学意义(均Plt;0.05)。见表6和图4。
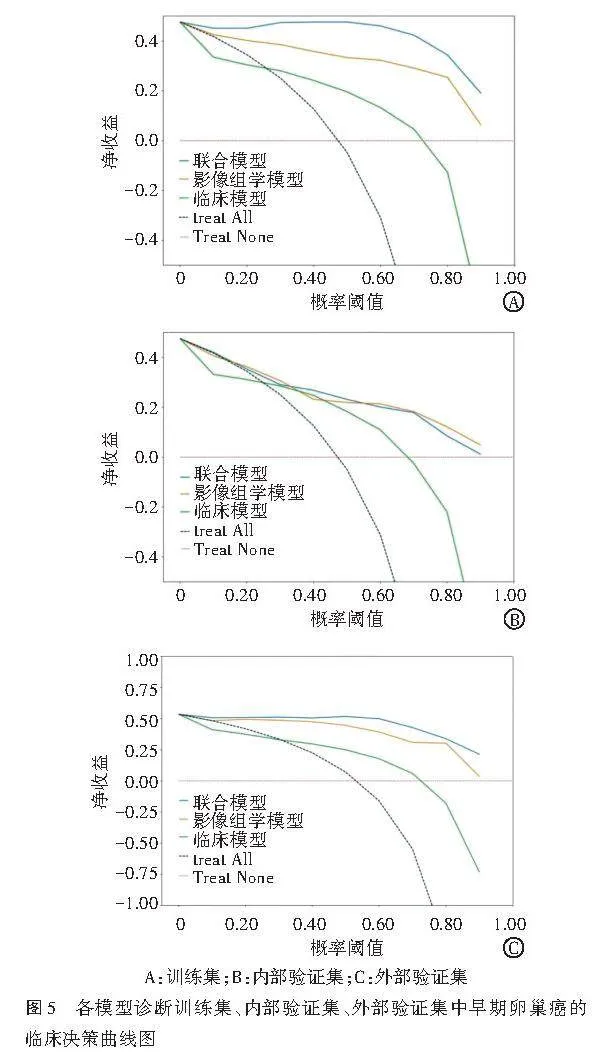
临床决策曲线分析显示,在训练集和外部验证集中,联合模型在0.05~1.00概率阈值范围内的临床净获益最大;在内部训练集中,联合模型在0.30~0.60概率阈值范围内的临床净获益最大,影像组学模型在0.18~0.30及0.60~0.90概率阈值范围内则可获得更大的临床净获益。见图5。
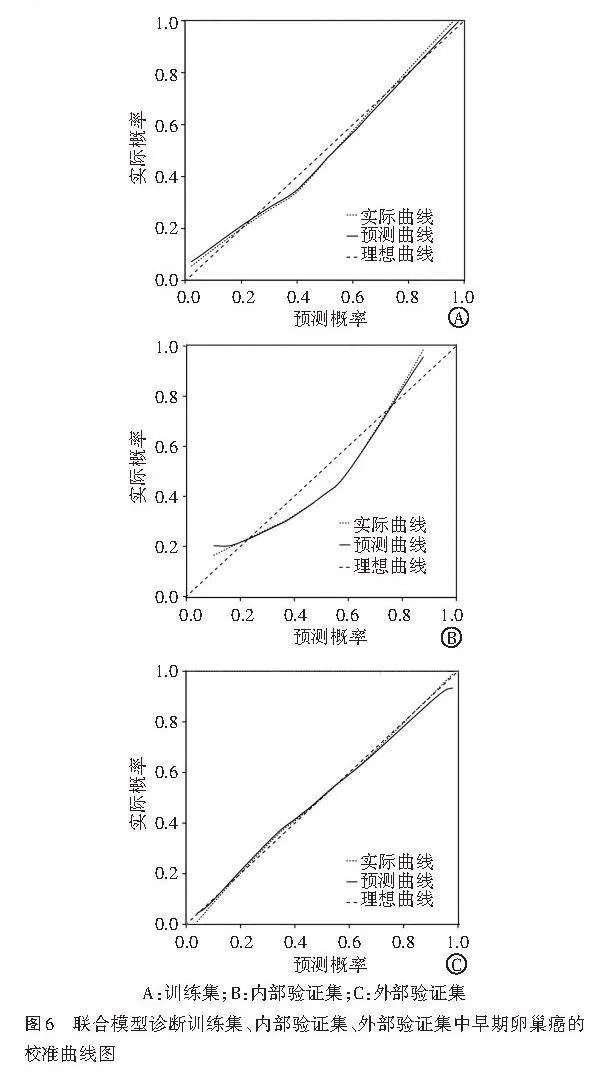
校准曲线分析显示,联合模型在训练集、内部验证集和外部验证集中的预测曲线与实际曲线贴合较好,校准度均较好。见图6。
讨" 论
卵巢癌病死率位居妇科恶性肿瘤首位[5],早期卵巢癌的临床症状较隐匿,患者发现时常已为晚期,约2/3的晚期卵巢癌患者在治疗后可复发,5年生存率仅20%~40%,而早期卵巢癌患者治疗后5年生存率可达70%,可见及早诊断卵巢癌可以改善患者预后[6]。目前卵巢癌的早期筛查主要依据肉眼观察的影像学和血清肿瘤标志物等,缺乏客观有效的诊断手段[7],如CA125对早期卵巢癌的诊断灵敏度仅40%[8]。介入性穿刺活检可以获得肿瘤的病理结果,但其有创,且仅反映局部组织病理,不能全面了解整体肿瘤的性质[9]。因此探寻一种非侵入性的诊断方法以提高早期卵巢癌的诊断准确率,是目前研究的热点和难点。基于此,本研究基于超声影像组学和临床特征构建联合模型,并探讨其诊断早期卵巢癌的临床价值。
本研究结果显示,训练集良性组与早期卵巢癌组HE4、肿瘤内部实性成分最大径、肿瘤最大径、肿瘤成分构成、Adler血流分级、腹水比较,差异均有统计学意义(均Plt;0.05);单因素及多因素Logistic回归显示,肿瘤实性成分最大径、Adler血流分级均为诊断早期卵巢癌的独立危险因素(均Plt;0.05),与Cao等[10]研究结果部分相似。该研究认为囊性病变伴实性成分的恶性风险概率高于多房囊肿(42.57% vs. 17.02%,Plt;0.05)。分析其原因,实性成分的肿瘤细胞更具侵袭性,容易侵入周围组织和血管,增加了肿瘤的扩散能力[11]。一般而言,肿瘤的Adler血流分级越高,则其内血管数量更丰富,血流量越多,促进了肿瘤细胞的生长和增殖,而肿瘤细胞在快速增殖过程中通过分泌血管内皮生长因子等刺激周围正常组织新生血管生成,极易导致肿瘤细胞进入血液或淋巴系统[12]。本研究虽比较了血清肿瘤标志物参数,但Logistic回归分析显示其并非诊断早期卵巢癌的独立影响因素,分析可能与本研究收集的卵巢癌病理组织类型较多有关。
近年来,较多研究应用超声影像组学进行卵巢癌的鉴别诊断、分子分型和预测预后等。Qi等[13]基于279例卵巢肿瘤患者的超声图像提取影像组学特征并计算Radscore,结果证实其能较好地鉴别良性、恶性、交界性卵巢肿瘤(AUC为0.839)。Tang等[14]构建的超声影像组学模型在术前鉴别Ⅰ型与Ⅱ型上皮卵巢癌方面有良好的诊断效能,该模型在训练集和测试集的AUC分别为0.817和0.731;Yao等[15]等基于超声影像组学特征构建了术前预测卵巢上皮癌患者5年无进展生存的预测模型,且该模型预测效能良好(AUC为0.868)有助于临床治疗决策的制定。但上述研究缺少独立外部验证集,模型的泛化能力有限,其通用性亦存在局限,故本研究增加独立数据集进行外部验证,提高了模型的鲁棒性和泛化能力。既往研究[16]多将超声图像上整个肿瘤作为ROI提取影像组学特征,而本研究以肿瘤内部实性成分作为ROI,减少了图像间相同特征的重复性,消除冗余,减少了特征间共线性,从而提高模型的诊断效能。本研究对训练集190例患者的超声图像手动勾画ROI,共提取了1050个影像组学特征,通过降维、筛选后最终获得13个最优特征并计算Radscore,ROC曲线分析显示其诊断训练集、内部验证集和外部验证集中早期卵巢癌的AUC分别为0.892、0.831和0.814,提示其诊断效能均较好,表明超声影像组学在诊断早期卵巢癌方面准确可靠。
既往研究[17-18]大多基于CT和MRI影像组学构建诊断模型,基于超声影像组学诊断早期卵巢癌的研究较少。本研究基于超声影像组学特征和临床特征构建了诊断早期卵巢癌的联合模型,并绘制列线图可视化,有利于临床医师简便、直观地量化独立影响因素的相对贡献,从而提高对早期卵巢癌的诊断准确率,以减少不必要的手术和微创治疗。本研究结果显示,联合模型诊断训练集、内部验证集和外部验证集中早期卵巢癌的AUC分别为0.931、0.881和0.851,其诊断效能与既往研究[17-18]中基于CT和MRI的影像组学模型相似(AUC分别为0.856、0.867)。临床决策曲线分析显示,在训练集和外部验证集中,联合模型在0.05~1.00概率阈值范围内的临床净获益最大,表明其具有较好的临床适用性。但在内部训练集中,联合模型在0.30~0.60概率阈值范围内的临床净获益最大,影像组学模型在0.18~0.30及0.60~0.90概率阈值范围内则具有更大的临床净获益。分析原因可能为在低概率阈值范围和高概率阈值范围内,影像组学模型较简单,而联合模型整合特征过于复杂,导致在该概率阈值范围内的诊断效能低于影像组学模型。校准曲线分析显示,联合模型在训练集、内部验证集、外部验证集的预测曲线与实际曲线均贴合较好,表明校准度均较好。
综上所述,基于超声影像组学、临床特征构建的联合模型可无创、准确地诊断早期卵巢癌,具有较高的临床应用价值。但本研究为回顾性研究,样本选择存在偏倚,未来应增加样本展开前瞻性研究;且基于超声影像组学和临床特征构建的联合模型目前尚处于初步研究阶段,未来需结合超声造影、超声弹性成像等多模态超声图像特征进一步探讨,以提高联合模型的诊断效能。
参考文献
[1] Hiett AK,Sonek JD,Guy M,et al.Performance of IOTA Simple Rules,Simple Rules risk assessment,ADNEX model and O-RADS in differentiating between benign and malignant adnexal lesions in North American women[J].Ultrasound Obstet Gynecol,2022,59(5):668-676.
[2] Siegel RL,Miller KD,Wagle NS,et al.Cancer statistics,2023[J].CA Cancer Clin,2023,73(1):17-48.
[3] Wheeler V,Umstead B,Chadwick C.Adnexal masses:diagnosis and management[J].Am Fam Physician,2023,108(6):580-587.
[4] Wang X,Lu Z.Radiomics analysis of PET and CT components of 18F-FDG PET/CT imaging for prediction of progression-free survival in advanced high-grade serous ovarian cancer[J].Front Oncol,2021,13(11):1035-1047.
[5] Forstner R.Early detection of ovarian cancer[J].Eur Radiol,2020,30(10):5370-5373.
[6] Liu P,Liang X,Liao S,et al.Pattern classification for ovarian tumors by integration of radiomics and deep learning features[J].Curr Med Imaging,2022,18(14):1486-1502.
[7] 高越.基于血小板及盆腔超声图像的多维度卵巢癌早期诊断体系建立的探索[D].武汉:华中科技大学,2023.
[8] 辛玉琦,巨宇叶,王晓慧.卵巢癌生物标志物及早期诊断的研究进展[J].国际妇产科学杂志,2020,47(5):544-549.
[9] 贺子英.基于计算机断层扫描的影像组学鉴别良性、交界性和早期恶性卵巢肿瘤的研究[D].南宁:广西医科大学,2022.
[10] Cao L,Wei M,Liu Y,et al.Validation of American College of Radiology Ovarian-Adnexal Reporting and Data System Ultrasound(O-RADS US):analysis on 1054 adnexal masses[J].Gynecol Oncol,2021,162(1):107-112.
[11] Mimura R,Kato F,Tha KK,et al.Comparison between borderline ovarian tumors and carcinomas using semi-automated histogram analysis of diffusion-weighted imaging:focusing on solid components[J].Jpn J Radiol,2016,34(3):229-237.
[12] Yi YY,Li C,Zhu WJ,et al.Diagnostic performance of contrast-enhanced ultrasound(CEUS) combined with ovarian-adnexal reporting and data system(O-RADS) ultrasound risk stratification for adnexal masses:a systematic review and Meta-analysis[J].Clin Radiol,2024,79(9):1167-1175.
[13] Qi L,Chen D,Li C,et al.Diagnosis of ovarian neoplasms using nomogram in combination with ultrasound image-based radiomics signature and clinical factors[J].Front Genet,2021,12(3):1245-1258.
[14] Tang ZP,Ma Z,He Y,et al.Ultrasound-based radiomics for predicting different pathological subtypes of epithelial ovarian cancer before surgery[J].BMC Med Imaging,2022 ,22(1):147-159.
[15] Yao F,Ding J,Hu Z,et al.Ultrasound-based radiomics score:a potential biomarker for the prediction of progression-free survival in ovarian epithelial cancer[J].Abdom Radiol(NY),2021,46(10):4936-4945.
[16] Tang ZP,Ma Z,He Y,et al.Ultrasound-based radiomics for predicting different pathological subtypes of epithelial ovarian cancer before surgery[J].BMC Med Imaging,2022,22(1):147-165.
[17] Chen J,Yang F,Liu C,et al.Diagnostic value of a CT-based radiomics nomogram for discrimination of benign and early stage malignant ovarian tumors[J].Eur J Med Res,2023,28(1):609-620.
[18] Cheng M,Tan S,Ren T,et al.Magnetic resonance imaging radiomics to differentiate ovarian sex cord-stromal tumors and primary epithelial ovarian cancers[J].Front Oncol,2023,13(12):107-119.
(收稿日期:2024-06-22)
基金项目:皖南医学院中青年科研基金项目(WK2023ZQNZ29)
作者单位:1.皖南医学院第一附属医院 弋矶山医院超声科,安徽 芜湖 241000;2.杭州第一人民医院超声科,浙江 杭州 310000
通讯作者:江峰,Email:yjsjf@163.com

