福尔马林固定石蜡包埋组织样本的蛋白质组制备技术研究



关键词 福尔马林固定石蜡包埋样本;样本制备;蛋白质组;质谱;液相色谱-串联质谱联用
基于质谱的蛋白质组学技术在发现疾病诊断生物标志物和指导疾病分类治疗方面发挥了重要的作用[1-3]。离体组织样本可能丧失生物功能和结构,为便于长期保存和分析,常采用福尔马林固定剂处理,将其制备成福尔马林固定石蜡包埋(FFPE)组织样本[4-5]。FFPE 组织样本关联大量的临床信息,对疾病研究至关重要。然而,组织样本经过甲醛固定和封蜡处理后,给后续的蛋白质组学样本制备带来了挑战:组织样本经石蜡包裹,与外界完全隔离,经甲醛固定后,样本的蛋白质与蛋白质之间或蛋白质与核酸之间会发生交联反应,降低蛋白质的溶解性和酶解效率[6-7],同时,样本的蛋白质产生位置修饰,影响蛋白质组鉴定的准确性。
二甲苯(Xylene)常用于溶解石蜡[8],但由于其具有挥发性和毒性,被世界卫生组织列为致癌物质。为降低对研究人员健康的影响, Triton X-100 被开发用于替代二甲苯脱蜡[9]。FFPE 组织样本蛋白提取过程中常用的裂解液包括RapiGest、三氟乙醇(TFE)和12 烷基硫酸钠(SDS)。SDS 虽为强效细胞裂解剂,但与质谱仪器不兼容,限制了其应用[10-11]。相比之下, RapiGest 和TFE 具备有效的蛋白裂解能力,并与质谱仪器具有较好的兼容性。Coscia 等[12]以50% TFE/300 mmol/L Tris-HCl 为裂解液,完成了卵巢癌患者FFPE 蛋白质组样本的制备,通过质谱分析共鉴定出4588 种蛋白质,体现了TFE 在蛋白质组样本制备中的有效性。RapiGest 是一种与质谱兼容的酸不稳定性表面活性剂,能够增加疏水性蛋白或肽段的溶解度,提升蛋白质酶解的效率[13-14]。Wu 等[15]建立了NanoTPOT 微量样本制备方案,该方案在60 ℃条件下使用0.1% RapiGest 裂解细胞,从0.5 μg Hela 蛋白中鉴定出5474 种蛋白质。目前,常使用的蛋白酶切方案包括过滤辅助样品制备(FASP)技术[16]、原位酶切(iST)技术[17]和单体系固相增强样品制备(SP3)技术[18-19]。FASP 酶切方案根据滤膜分子量大小截留蛋白质,适用于各种裂解液提取的蛋白质,但操作较繁琐,在微量样本中的效果可能有限。iST 和SP3 实验方案都是在单一容器内完成样本制备,简化了操作步骤,适用于微量样本的蛋白质组样本制备。
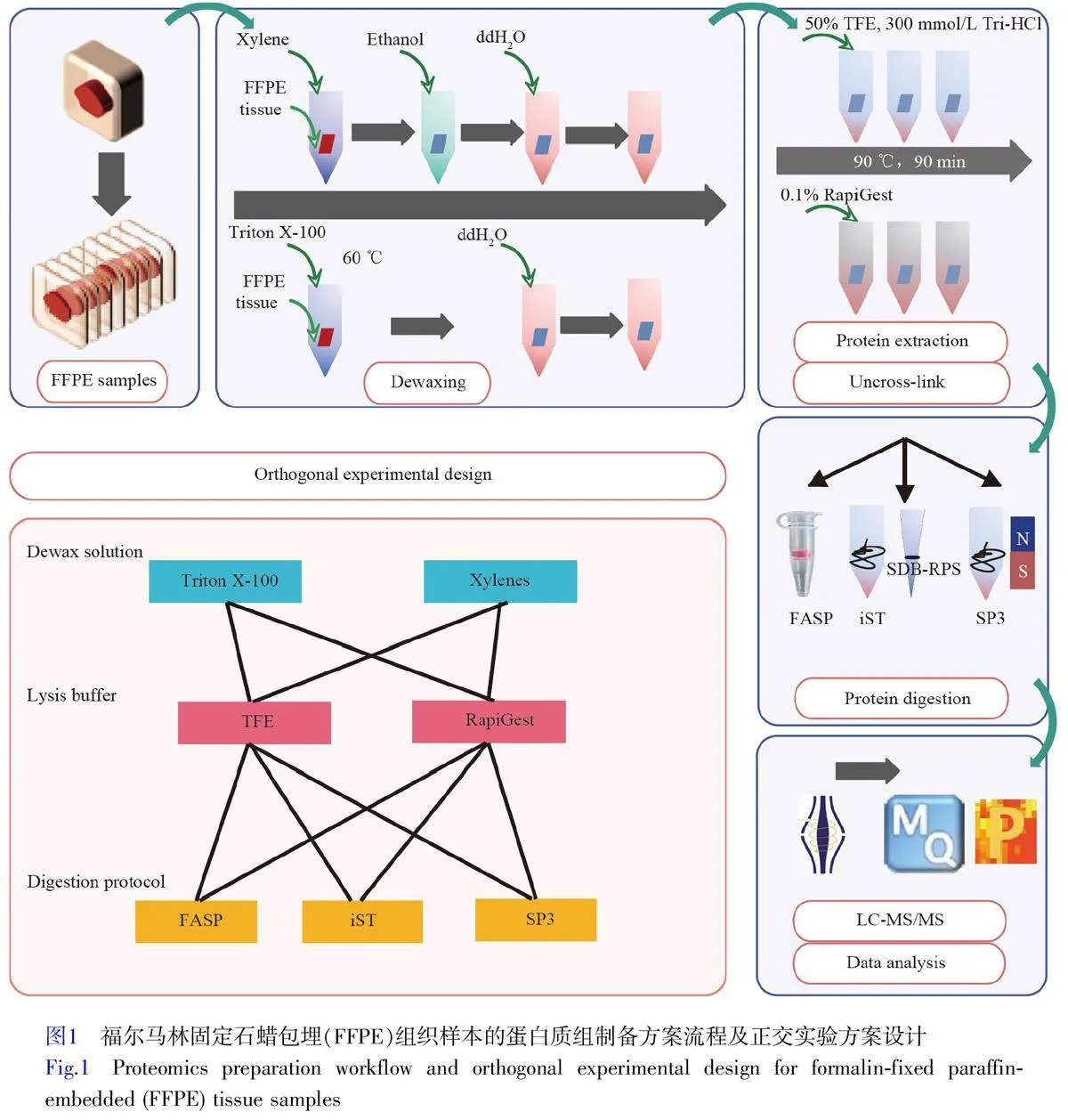
为了探索FFPE 蛋白质组样本的最佳制备条件,本研究选择2 种脱蜡液(Triton X-100 和Xylene)、2 种裂解液(TFE 和RapiGest)以及3 种酶切方案(iST、SP3 和FASP)作为技术基础,通过正交实验设计了12 种样本制备方案,分别为TTF(Triton-TFE-FASP)、TTI(Triton-TFE-iST)、TTS(Triton-TFE-SP3)、TRF(Triton-RapiGest-FASP)、TRI(Triton-RapiGest-iST)、TRS(Triton-RapiGest-SP3)、XTF(Xylene-TFEFASP)、XTI(Xylene-TFE-iST)、XTS(Xylene-TFE-SP3)、XRF(Xylene-RapiGest-FASP)、XRI(Xylene-RapiGest-iST)和XRS(Xylene-RapiGest-SP3)。从蛋白质和肽段的鉴定深度、鉴定稳定性和蛋白丰度的定量水平等方面对各方案进行了系统性评估。结果显示, TTI 技术方案在所有测试条件中表现最好,具有突出的鉴定重复性和稳定性,同时在蛋白质鉴定数量上也表现最佳。本研究为FFPE 组织样本的蛋白质组学分析提供了技术参考。
1 实验部分
1.1 仪器与试剂
Easy-nLC 1200 纳升级液相色谱仪、Orbitrap Fusion Lumos Tribrid 质谱仪、NanoDrop OneC 微量紫外分光光度计和ThermoMixer C 金属浴(美国Thermo Scientific 公司);Vacufuge Plus 真空离心浓缩仪(德国Eppendorf 公司);JY92-IIN 超声波细胞粉碎机(宁波新芝生物科技公司);电热恒温培养箱(上海一恒科技有限公司)。
Triton X-100非离子表面活性剂(≥99%)、TFE(≥90%)、氯乙酰胺(CAA,≥98%)和氨水(≥99%)(美国Sigma Aldrich 公司);二甲苯(≥99%,上海阿拉丁生化科技股份有限公司);RepiGest 表面活性剂(≥98%,美国Waters 公司);Tris-HCl(≥99%, pH 8.0)、三(2-羧乙基)膦(TCEP,≥97%)、三氟乙酸(TFA,≥99%)、甲酸(FA,gt;99%)、乙醇和乙腈(质谱纯)(美国Thermo Scientific 公司);测序级胰蛋白酶(Trypsin,质谱纯,北京酶知源生物科技有限公司);SDB-RPS 固相萃取盘(色谱纯,美国3M 公司)。
1.2 样本信息
本研究使用的FFPE 组织切片样本均来自中国医学科学院肿瘤医院,并已得到该医院伦理委员会的批准(审批编号:NCC2020C-209)。参与此项研究的个体已签署知情同意书,确保研究的伦理合规性。
所采用的样本均来自同一患者的肝细胞癌FFPE 组织切片,切片大小约为5 mm×5 mm,厚度为5 μm。
1.3 FFPE 组织样本的脱蜡与解交联
Triton X-100 脱蜡流程[9] (1)将FFPE 组织切片在60 ℃恒温箱中处理10 min;(2)将切片转移至1% Triton X-100 中(60 ℃),浸泡15 min,重复1 次;(3)用去离子水洗涤切片,每次浸泡5 min,重复2 次。
二甲苯脱蜡流程[8] (1)FFPE 切片在60 ℃恒温箱中处理10 min;(2)将切片转移至二甲苯中,室温浸泡10 min,重复1 次;(3)依次使用100%、95%、85%和75%乙醇溶液浸泡切片,其中前两个浓度各重复2 次,每次浸泡时间为5 min;(4)将切片转移至去离子水中浸泡5 min,重复2 次。
蛋白质提取和解交联流程[12] (1)向样品中加入50% TFE/300 mmol/L Tris-HCl 或0.1% RapiGest,进行水浴超声处理1 h;(2)样品置于90 ℃金属浴中加热90 min;(3)再次进行水浴超声处理1 h。
1.4 蛋白质酶切和肽段脱盐
FASP 酶切方案 (1)将样品转入截留分子量为30 kDa 的超滤离心管中,加入TCEP(5 mmol/L)和CAA(25 mmol/L)混合液至终体积为200 μL,置于37 ℃金属浴中孵育1 h;(2)以16000 r/min 离心15 min,弃去滤过液,并更换套管;(3)加入1 μg Trypsin,在37 ℃金属浴中酶切16 h,转速为1500 r/min;(4)离心,收集酶切液。
iST 酶切方案 (1)将蛋白样品转移至EP 管中,加入TCEP(5 mmol/L)和CAA(25 mmol/L)至终体积为200 μL,在37 ℃金属浴中孵育1 h;(2)将液体样品置于真空干燥机中,干燥至约20 μL;(3)加入1 μg Trypsin,在37 ℃金属浴中酶切16 h,转速为1500 r/min;(4)离心,收集上清液。
SP3 酶切方案 (1)在蛋白样品中加入TCEP(5 mmol/L)和CAA(25 mmol/L)至终体积为200 μL,在37 ℃金属浴中孵育1 h;(2)加入经去离子水清洗过的磁珠,再加入纯乙醇,使乙醇含量超过50%,在24 ℃金属浴中孵育5 min,转速为1000 r/min;(3)17000 r/min 离心5 min,再置于磁力架上吸附磁珠,去除上清液;(4)加入200 μL 乙醇-水(80∶20, V/V)洗涤2 次;(5)加入1 μg Trypsin,在37 ℃金属浴中孵育16 h,转速为1500 r/min;(6)离心,然后再用磁力架吸附磁珠,收集上清液。在收集的各样品酶切液中加入TFA 至终浓度为1%,待脱盐。
SDB-RPS-Tip 脱盐 (1)将2 层SDB-RPS 膜转移至100 μL 移液头中,并用0.2% TFA 洗涤1 次;(2)将酶切液加至SDB-RPS-Tip 柱中,离心(4000 r/min, 1 min)去除废液;(3)采用0.2% TFA 洗涤3 次;(4)采用5%氨水的ACN-ddH2O(80∶20,V/V)洗脱肽段。收集的肽段在真空离心浓缩仪中热干,于–80 ℃保存,供LC-MS/MS 分析。
1.5 LC-MS/MS分析
使用EASY-nLC 1200系统与Orbitrap Fusion Lumos Tribrid 质谱仪进行分析。肽段在自制的C18 柱(内径为100 μm,柱长为30 cm)上分离。流动相A 为0.1% FA,流动相B 为80% ACN/0.1% FA。肽段以600 nL/min 的流速在135 min 内洗脱。梯度洗脱程序如下:0~13 min, 3%~10% B;13~99 min, 10%~22% B;99~120 min, 22%~30% B;120~123 min, 35%~90% B;123~135 min, 90% B。MS1 和MS2 均使用Orbitrap 质量分析器分析。MS1 扫描范围为m/z 350~1550,分辨率为120000。全扫描的自动增益控制(AGC)目标设定为4×105,最大离子注入时间(MIT)为60 ms。选择用于MS/MS 的前体离子的离子隔离宽度为m/z 1.6,在30%的标准化碰撞能量下进行碎裂。MS2 分辨率设定为15000, AGC 为5×104, MIT 为30 ms。前体离子的动态排除时间为18s。
1.6 数据分析
质谱原始数据使用MaxQuant 软件(版本号:2.0.3)[20]进行分析,在Uniprot 下载用于人类蛋白质组检索数据库。MaxQuant 设置参数如下:蛋白水解酶为Trypsin,最大漏切位点为2;母离子质量偏差为20 ppm (10–6),子离子质量偏差为4.5 ppm;Carbamidomethyl (C)被选为固定修饰,可变修饰选择甲硫氨酸氧化和N-乙酰化;错误发现率(FDR)lt;1%,其它设置参数选择默认值。基因本体(GO)富集分析使用R 语言的ClusterProfiler 软件包[21]完成,显著信号通路的选择标准为plt;0.05。数据分析与可视化使用Perseus、Excel 和GraphPad Prism 等工具软件完成。
2 结果与讨论
2.1 实验方案设计
本研究设计了一套正交实验方案,系统地评价了不同前处理方案对FFPE 组织样本蛋白质组定性与定量分析结果的影响(图1)。此方案包括2 种脱蜡方案(Triton X-100,标记为T;二甲苯,标记为X),2种裂解液(TFE,同样标记为T;RapiGest,标记为R),以及3种酶切方案(FASP,标记为F;iST,标记为I;SP3,标记为S)。以上元素组合形成12种不同的处理组合,分别为TTF、TTI、TTS、TRF、TRI、TRS、XTF、XTI、XTS、XRF、XRI 和XRS。每种组合方式进行3次重复实验,以确保实验结果可靠。
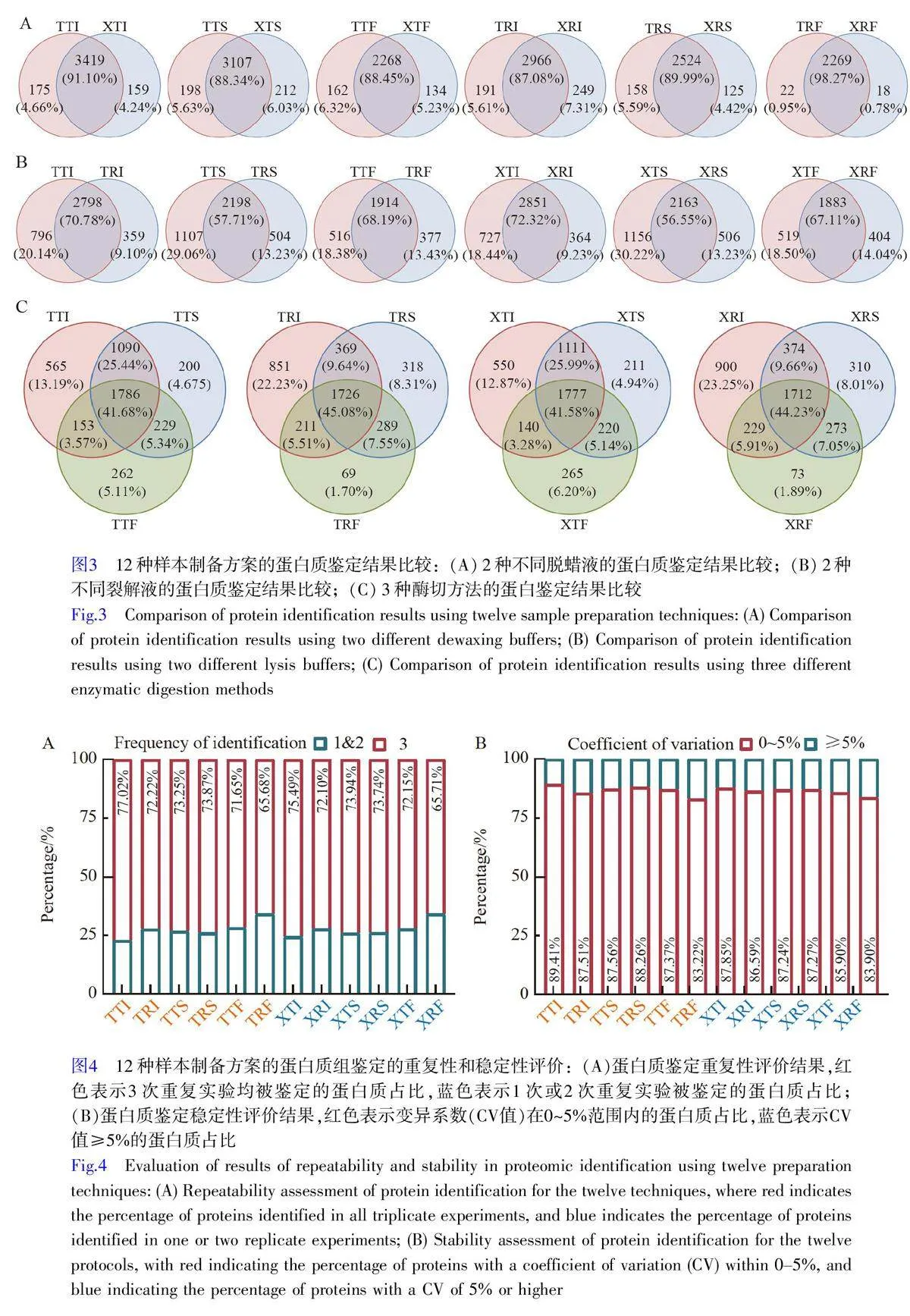
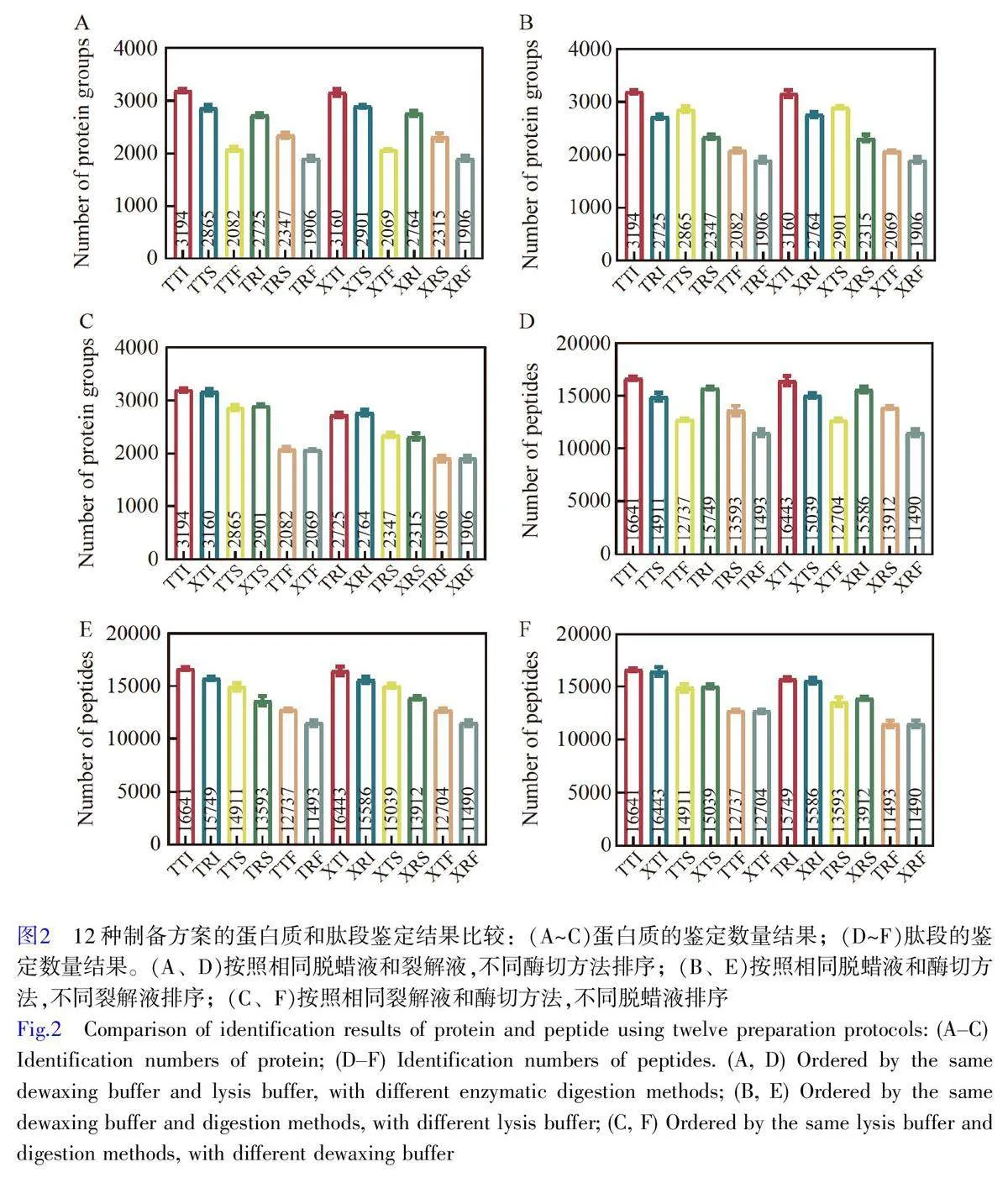
2.2 12种制备方案的蛋白质组对比分析结果
12种制备方案的平均蛋白质鉴定数量范围在1906~3194 之间,其中TTI 方案的平均蛋白质鉴定数量最多,达到3194 种蛋白质,比鉴定数最少的XRF 方案提升了1.68 倍(图2)。在3 种酶切方案中, iST 酶切方案(–I)鉴定的蛋白质数量和肽段数量均明显优于SP3(–S)和FASP(–F)酶切方案,其中, FASP 酶切方案鉴定的蛋白质数量最少。观察到TTI-TTS-TTF、TRI-TRS-TTF、XTI-XTS-XTF 和XRI-XRS-XTF 这4 种比较组合中趋势一致, –I 组的蛋白质鉴定数量和肽段鉴定数量都优于–S 组和–F 组, –F 组最低(图2A)。同时,观察到使用TFE(T)作为裂解液的效果明显优于RapiGest(R),例如,在TTI 与TRI、TTS 与TRS 等的对比中,选用TFE(-T-)的组合普遍优于RapiGest(-R-)。此外,无论选择Triton X-100 还是二甲苯作为脱蜡液,对FFPE 组织样本的蛋白质组分析结果影响较小,如TTI 与XTI、TTS 与XTS 等的比较显示,蛋白质和肽段鉴定数量之间的差异较小。
2.3 12 种制备方案的蛋白鉴定情况对比分析结果
通过韦恩图对比分析,对12 种制备方案的蛋白鉴定情况进行了系统研究。研究结果表明,使用Triton X-100 (T–)和二甲苯(X–)作为脱蜡液的差异较小,在各组配对方案中,如TTI-XTI 和TTS-XTS 等,不同脱蜡液特异性鉴定的蛋白质数量占比通常低于7%,表明2 种脱蜡方法之间的差异不显著(图3A)。相比之下, 2种不同的裂解液TFE(-T-)和RapiGest(-R-)之间的差异较为明显。在配对组,如TTI-TRI 和TTS-TRS 中,特异性鉴定蛋白质的占比大部分超过13%,其中, RapiGest(-R-)组的特异性鉴定蛋白质占比在9.10%~14.40%之间,而TFE(-T-)组在18.38%~30.22%之间(图3B)。上述结果表明, TFE 裂解液(-T-)在蛋白质组鉴定中具有明显优势。同时,在保持裂解液和脱蜡方式不变的情况下, iST(–I)酶切方案的特异性鉴定的蛋白质数量显著高于SP3(–S)和FASP(–F)酶切方案(图3C)。综上, TFE 和iST 酶切技术可显著提升FFPE 组织样本的蛋白质组鉴定效果,而脱蜡方式对蛋白质组鉴定的影响较小。
2.4 蛋白质定性结果的重复性和稳定性评估
对12种制备方案的重复性和稳定性进行了评估。采用各制备方案中3 次重复实验均能鉴定到的蛋白质的占比作为评估制备方案重复性的关键指标。在12 种方案中, 10 种方案的蛋白质鉴定重复占比超过70%,表现出较高的重复性(图4A)。然而, XRF 和TRF 方案的重复性较低,分别只有65.71%和65.68%。在所有方案中, TTI 和XTI 方案表现最佳, 3 次重复实验的鉴定百分比分别为77.02%和75.49%(图4A)。以鉴定蛋白质的变异系数(CV)衡量各制备方案的稳定性,除TRF 和XRF 方案外,其它方案的CVlt;5%的蛋白质占比均超过85%,显示出较高的稳定性(图4B)。特别是TTI 方案,其CVlt;5%的蛋白质占比高达89.41%,显示出极高的稳定性(图4B)。以上结果表明,绝大部分制备方案不仅具备良好的重复性,还展现出高度的稳定性,其中, TTI 方案的表现最优。
2.5 蛋白质定量检测结果的稳定性评估
按照蛋白质定量丰度对12 种制备方案进行降序排列。TTI 和XTI 方案鉴定的蛋白质丰度明显优于其它方案,尤其在低丰度蛋白质鉴定方面表现尤为突出(图5A)。将蛋白质丰度划分为4个区间:lt;107,107~108, 108~109和≥109。与其它方案相比, TTI 和XTI 在lt;107 区间的蛋白质较少,在107~109 区间的蛋白质数量显著增多,表明这2种方案可以提高对低丰度蛋白质的鉴定水平,有助于增加蛋白质鉴定数量和提高定量准确性(图5B)。
为进一步评估各种制备方案的蛋白质定量分析的效果,选取各制备方案中定量值最低的100 种蛋白质。通过交叉比对,挑选在各组实验中均为最低丰度范围的IMPA1(P29218)和CBPQ(Q9Y646)2 种蛋白质作为评价基准。TTI 和XTI 方案鉴定的2 种蛋白质的丰度水平明显高于其它处理组(图5C 和5D)。以上结果表明, TTI 和XTI 方案对低丰度蛋白质的鉴定性能优异,这也可能是这2 种方案在蛋白质鉴定数量和稳定性方面显著提升的主要原因。
2.6 TTI方案在FFPE蛋白质组研究中的性能优势
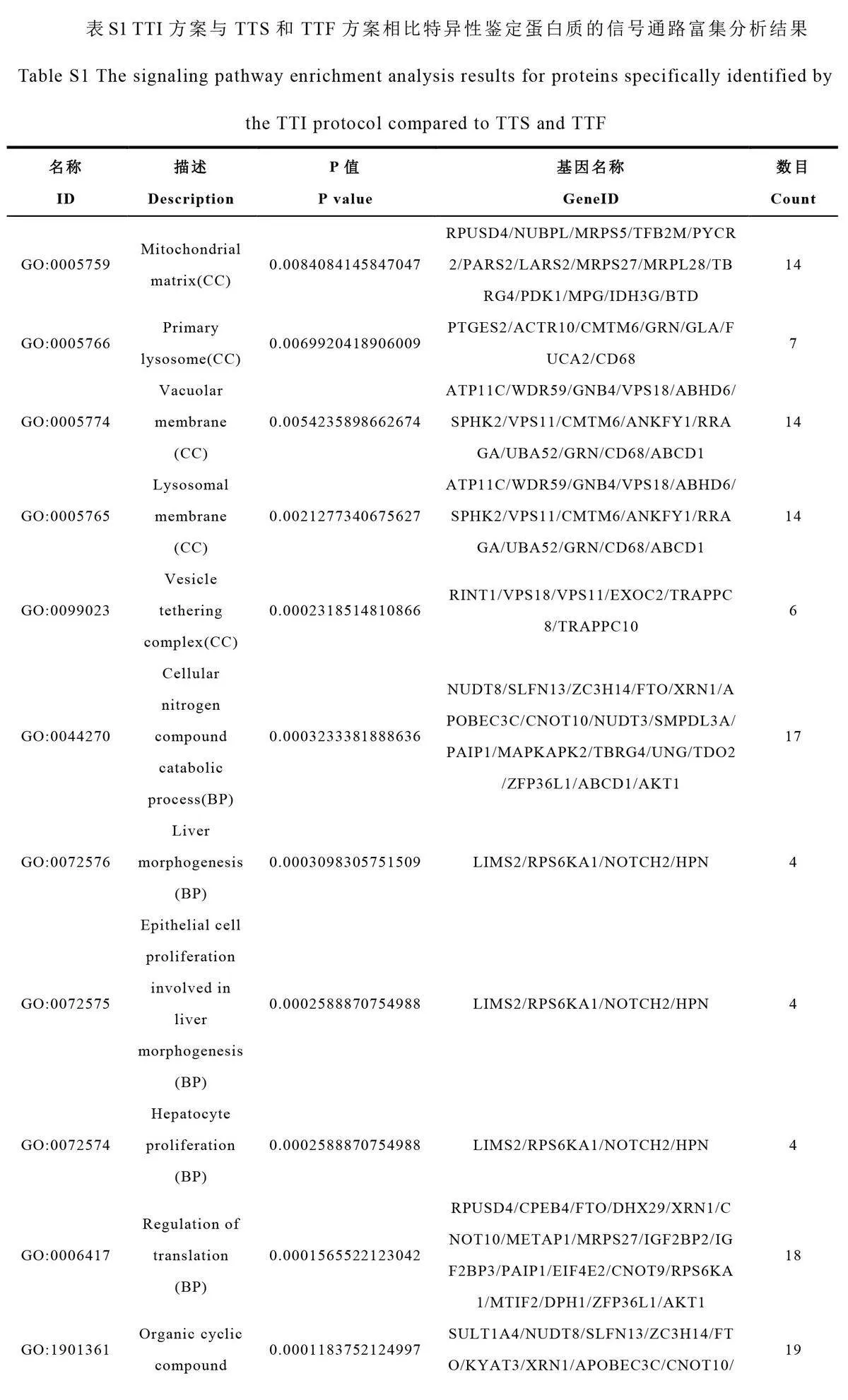
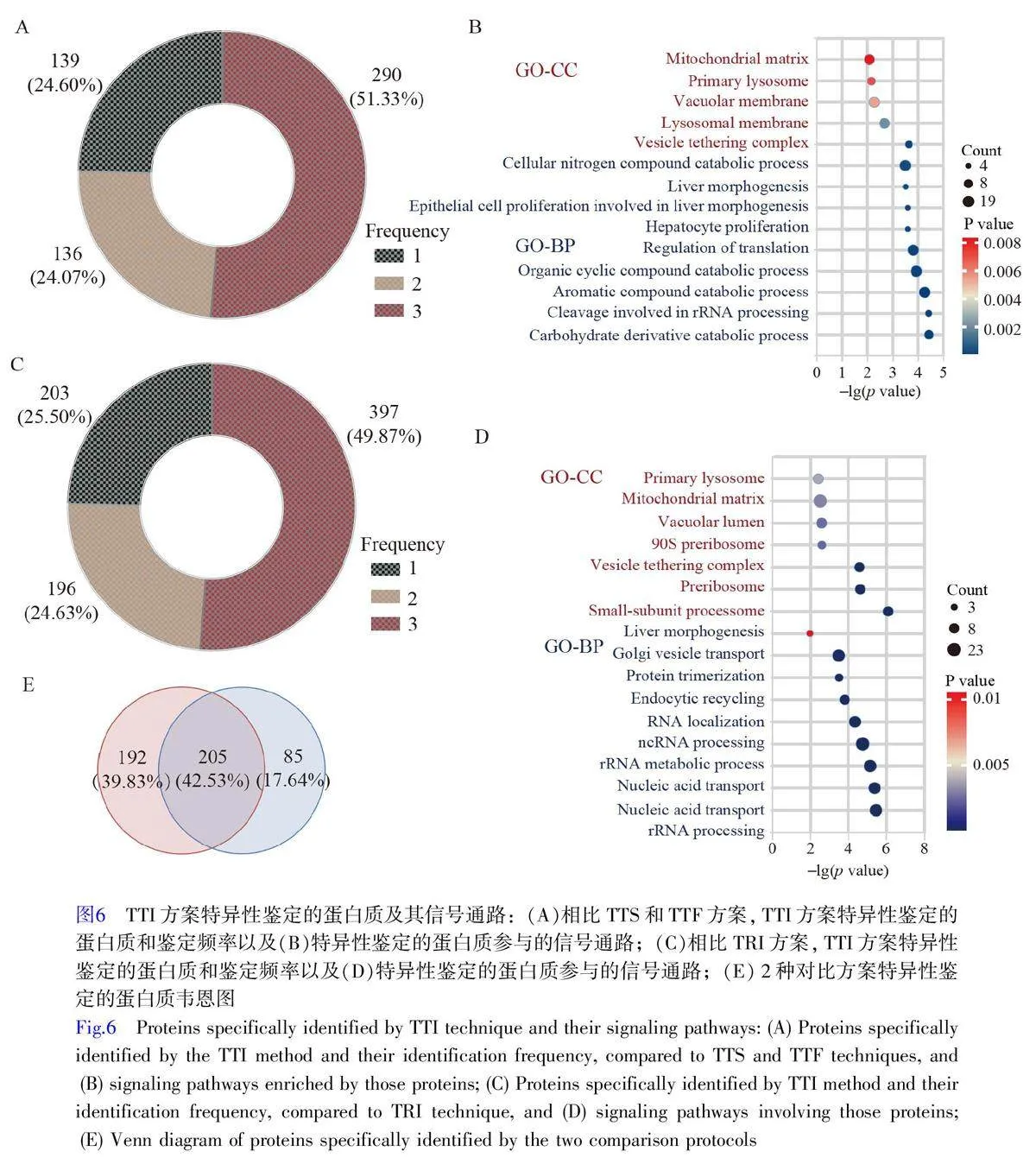
上述分析结果证明, TTI 方案是FFPE 蛋白质组研究的首选。基于肝细胞癌的FFPE 组织样本,本研究重点考察了TTI 方案在蛋白质组研究中的性能优势。比较了TTI 与TTS 和TTF方案的差异,发现TTI方案特异性鉴定出了565 种蛋白质,其中, 290种蛋白质在3 次重复实验中均被鉴定(图6A)。GO 富集分析结果显示,这290 种蛋白质主要位于囊泡锚定复合体、溶酶体膜和液泡膜等细胞结构(图6B,电子版文后支持信息表S1),并参与翻译调控、肝细胞增殖、上皮细胞增殖和肝脏形态发生等生物学过程。此外,在肝细胞增殖、上皮细胞增殖以及肝脏形态发生等过程的蛋白质鉴定方面, TTI 方案较TTS 和TTF 方案能识别更多相关蛋白质。
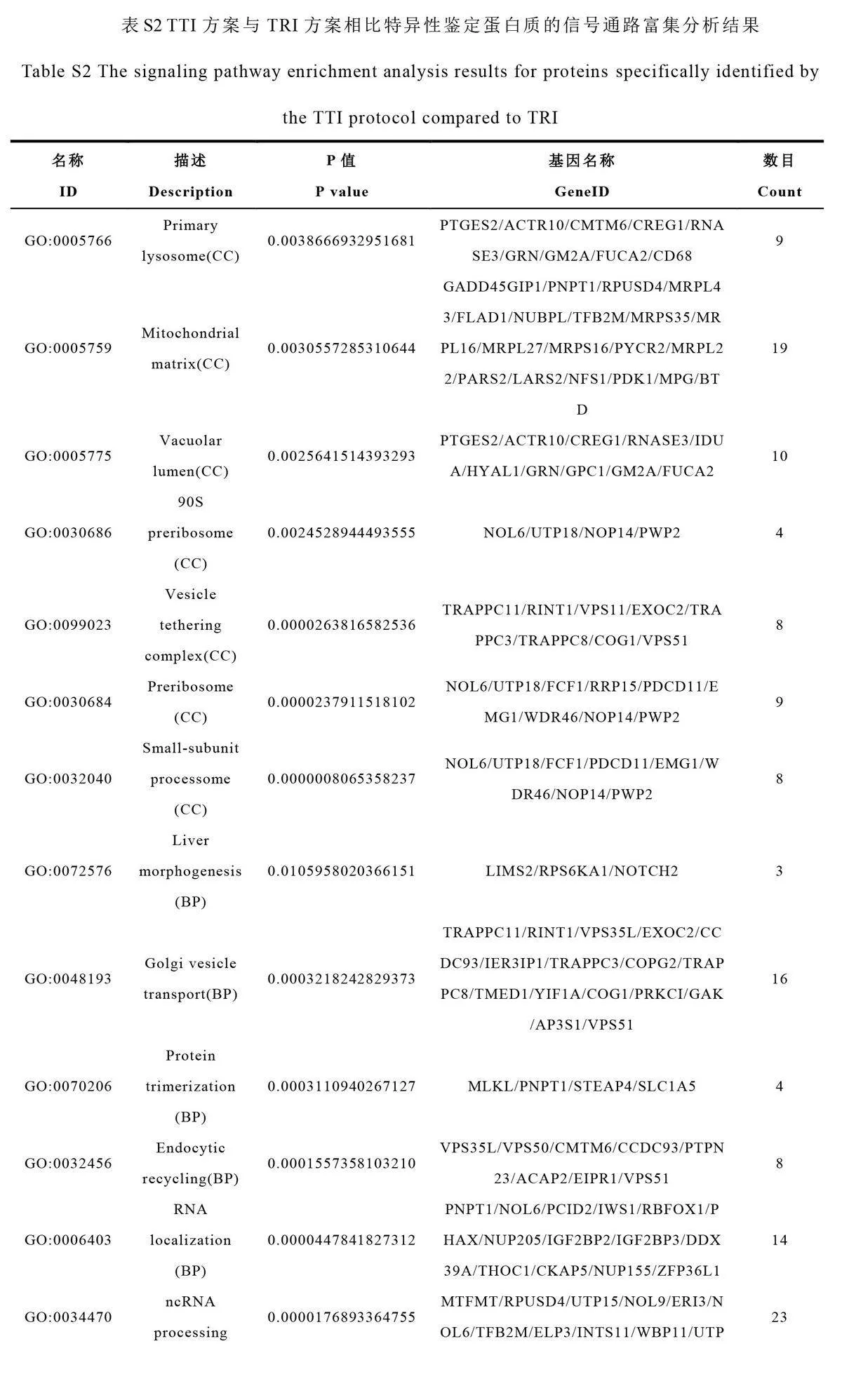
通过对TTI 和TRI 的韦恩图分析,研究了TFE(-T-)和RapiGest(-R-)2 种裂解液的效果。TTI 方案特异性鉴定出796 种蛋白质,其中397 种在3 次重复实验中均被鉴定(图6C)。GO 富集分析表明,这397 种蛋白质主要定位于小亚基过程体、前核糖体和囊泡锚定复合体等细胞结构,涉及rRNA 加工、核酸运输和肝脏形态发生等多个生物过程(图6D,电子版文后支持信息表S2)。以上结果进一步证明了TFE 裂解液在提高FFPE 组织样本蛋白质鉴定性能方面具有显著优势,为疾病临床研究提供了重要线索。
通过韦恩图分析发现, TTI 制备方案与TRI、TTS 和TTF 制备方案之间在蛋白质特异性鉴定方面具有高度相关性, 205种蛋白质在比较中显示出重叠,占TTI-TTS-TTF 特异性鉴定总蛋白质数目的70.69%。表明TTI 技术鉴定的特异性蛋白质具有高度独特性(图6E)。
综上所述,无论是基于iST酶切方案,还是基于TFE裂解液的TTI 技术,都显著提升了FFPE 蛋白质组的分析性能,特异性鉴定出超过200种蛋白质,这为肝细胞癌的发展机制提供了一个更加系统和全面的蛋白质组图谱,对于临床FFPE组织样本的蛋白质组研究具有重要的价值。
3 结论
本研究通过正交实验方法设计了12种样本制备方案,涉及脱蜡液、裂解液和酶切方案,以选择最适合FFPE 蛋白质组分析的实验方法。结果表明, Triton X-100和二甲苯作为脱蜡液对蛋白质组分析的影响较小,可使用Triton X-100替代二甲苯进行脱蜡。在裂解液方面, TFE 相较于RapiGest 展现出更高的蛋白质和肽段鉴定效率,并在特异性蛋白质鉴定方面表现更优。在酶切方案的比较中, iST方案在蛋白质和肽段的鉴定数目及特异性蛋白质鉴定方面显著优于SP3 和FASP 方案。
综合评估结果,推荐Triton X-100、TFE 和iST酶切方案的组合方案(TTI),此组合方案在蛋白质和肽段鉴定数量、重复性、稳定性和低丰度蛋白质鉴定等多个方面表现出卓越性能。TTI 方案通过特定蛋白质鉴定和信号通路富集分析,成功鉴定出200多种具有方法特异性的蛋白质,这些蛋白质在细胞生长、基因转录和肿瘤发展中发挥了关键作用,证明TTI 技术能够提供更全面的蛋白质组学信息,可为临床研究的深入进行提供技术支持。
支持信息

