肿瘤边界成像驱动的分子探针研究进展



关键词 边界生物医学;生物医学边界学;肿瘤边界;分子探针;磁学成像;光学成像;声学成像;核素成像;评述
边界生物医学(Boundarics in biomedicine)或生物医学边界学(Biomedical boundarics)是一门综合了生命科学、医学、化学、材料科学和信息科学等多领域学科的前沿交叉学科,用于研究和解决生命机体边界形成、判别及演进过程中的关键问题[1]。边界生物医学包含3 个核心层次:首先是生命机体与外界环境的边界;其次是生命机体内部各组成部分之间的边界;最后是生命机体疾病的边界。边界生物医学具有丰富的科学内涵,依据疾病类型可分为肿瘤边界生物医学、炎症边界生物医学、心脑血管病边界生物医学等;按照组织器官类型可分为脑部、眼部、肺部和肝腹部等特定区域的边界生物医学。边界生物医学研究对生命体起源的认知、内外环境交互作用、疾病的发生与演进机制的研究具有重要的科学意义,并可为重大疾病的早期诊断预防、个性化药物开发及预后评估等提供创新的理论依据、技术手段与解决方案。
肿瘤边界是实体瘤外层的恶性细胞与正常组织非恶性细胞的交界区域,涉及分子、细胞和组织等多个尺度的时空动态演进,肿瘤边界与肿瘤的发生、发展、侵袭和转移过程密切相关。最新的研究发现,肿瘤最外层是边界侵袭区,包含肿瘤结构边界与瘤旁微环境的功能边界,后者又包含了肿瘤细胞、高侵袭性肿瘤细胞、受损的正常细胞、免疫细胞及复杂的信号分子网络,是肿瘤演进的核心区域[2-3]。因此,对肿瘤结构与功能边界进行成像,不仅对于揭示肿瘤边界演进与微环境互动、肿瘤侵袭及转移的分子机制至关重要,而且对肿瘤良恶性的判别、个性化治疗方案的制定、疗效监测及预后评估等具有重要的临床意义,是推进肿瘤个性化医疗、提高患者生存质量的关键[4-5]。
分子探针作为一类能够增强成像信号的功能性物质,在肿瘤结构与功能边界成像过程中具有重要作用。目前,研究人员已开发了基于肿瘤特异性分子标志物及其微环境响应的分子探针。这些探针与磁学、光学、声学或核素等生物医学成像技术相结合,实现了对实体肿瘤与正常组织边界的有效识别,并在一定程度上能够判别肿瘤的侵袭与转移状态[6-8]。本文系统总结了肿瘤边界成像分子探针的化学结构、组分设计以及成像灵敏性、特异性的调控策略,详细阐述了基于分子探针的肿瘤结构与功能边界成像的最新进展以及分子探针成像技术在揭示肿瘤边界演进机制方面的应用,最后,分析了肿瘤边界成像分子探针的研究趋势,并对未来的研究前景进行了展望。
1 肿瘤边界成像分子探针
1.1 磁学成像分子探针
磁共振成像(Magnetic resonance imaging, MRI)利用原子核在磁场内共振所产生的信号重建图像,是一种非侵入性、无辐射性的诊断方法,广泛用于疾病诊断[9]。MRI 具有较高的软组织分辨率和多方位成像能力,能够提供丰富的诊断信息。MRI 也存在局限性,如对钙化灶的敏感性不足、运动伪影以及对金属的排斥性等。磁学成像分子探针可通过弛豫效应和磁化率效应改变组织的信号强度,提高肿瘤与正常组织的对比度,改善肿瘤边界的成像灵敏度,并揭示肿瘤的演进过程[10]。自1984 年首款磁学成像分子探针-钆喷酸葡胺(Gadolinium diethylenetriamine pentaacetic acid, Gd-DTPA)成功应用于脑肿瘤诊断以来,研究者不断优化磁学成像分子探针的灵敏度、特异性及安全性,以提升MRI 诊断的准确性。这些优化策略包括化学结构调整、靶向分子修饰及特异性响应基团设计等[11-12]。
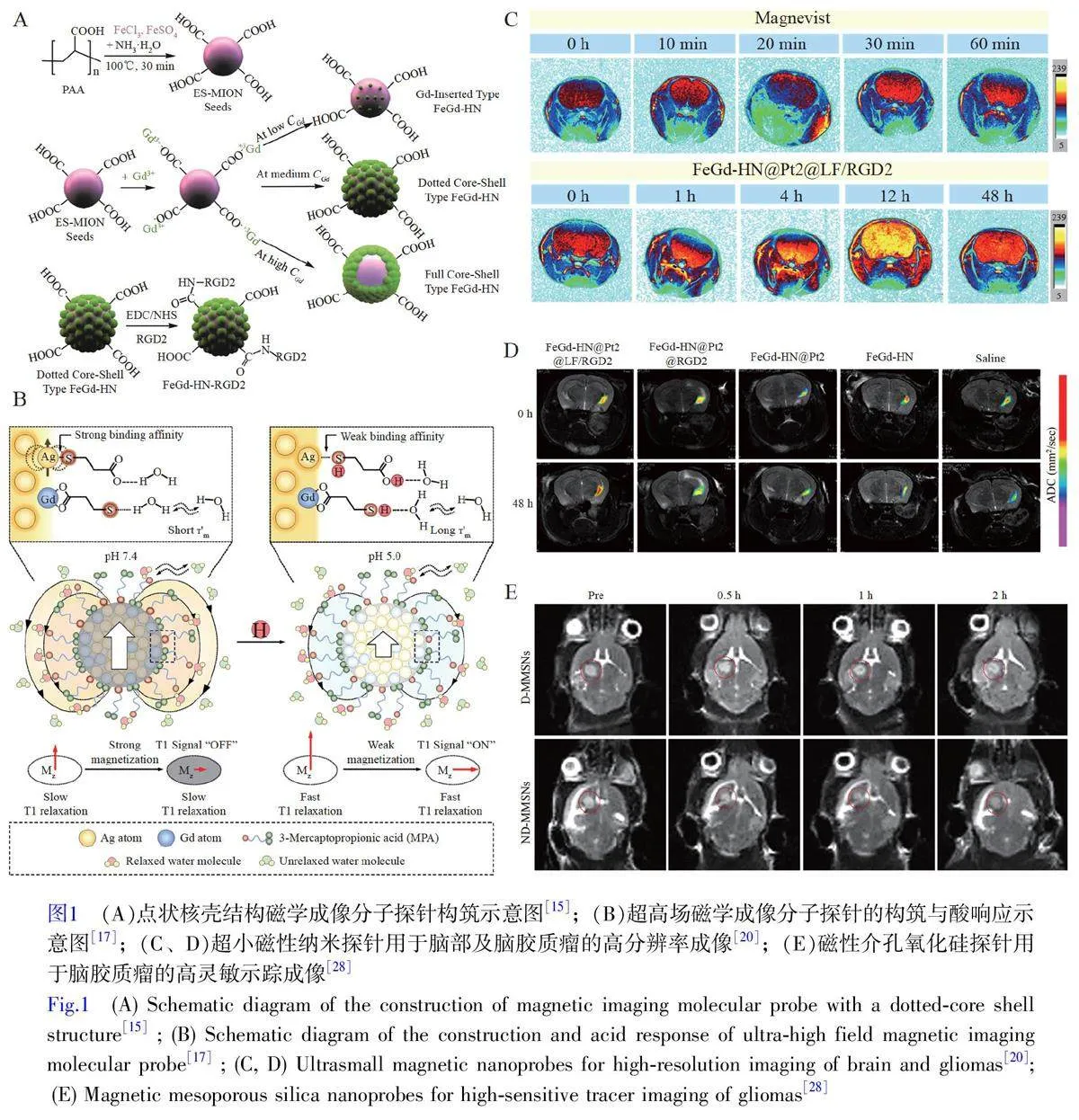
根据Solomon-Bloembergen-Morgan(SBM)方程,调控内层水分子的配位数(q)、配体分子的旋转相关时间(τR)及内层配位水分子的停留时间(τM)可有效提高弛豫率,增强信号强度[13]。例如, Louie 等[14]通过吡喃半乳糖封闭三价钆离子与水分子的配位,该构象可被肿瘤过表达的β-半乳糖苷酶酶切,释放配位位点,进而增加q,提高肿瘤边界的MRI 信号。本研究组设计了纵向弛豫率(r1)达70 L/(mmol·s)的点状核壳结构探针,其凹凸结构有效提高了比表面积,从而大幅增加q (图1A)[15]。为了延长τR, Zhang 等[16]利用聚丙烯酸聚合物链限制Gd-DTPA 的旋转,使其在1.5 T 磁场下的r1 是Gd-DTPA 的4.6 倍。为了调节τM, Liang 等[17]开发了一种3-巯基丙酸配体修饰的Ag-Gd 纳米探针,该配体在酸性肿瘤微环境中转化为硫醇,降低了探针的磁化强度,从而在9 T 磁场下r1 增强10 倍以上,可高灵敏地显示出肿瘤弱酸性微环境功能边界(图1B)。交换饱和转移(Chemical exchange saturation transfer, CEST)是一种基于磁化传递和化学交换理论的MRI 技术,通过检测与水分子发生化学交换的质子,间接测量目标分子水平。Liu 等[18]开发了基于右旋糖酐羧基质子和前列腺特异性膜抗原(Prostate-specific membrane antigen, PSMA)配体的可生物降解CEST 分子探针,能够根据水分子变化检测微摩尔水平的右旋糖酐,从而间接反馈前列腺癌中PMSA 的表达水平。
MRI分子探针的特异性和安全性是实现肿瘤边界结构和功能成像的关键因素。针对肿瘤乏氧区域的硝基还原酶(Nitroreductase, NTR)过度表达,本研究组设计了可被NTR 还原的硝基咪唑修饰超顺磁性氧化铁探针,其在肿瘤区域积累并发生酸响应性聚集,通过切换T1/T2 成像模式,实现了肿瘤边界乏氧水平的量化成像[19]。此外,本研究组通过引入叶酸、RGD 肽和神经肽Y1(Neuropeptide, NPY)配体等靶向分子及癌细胞仿生修饰,提高了金属基MRI 探针的靶向性和安全性,实现了肿瘤边界成像(图1C 和1D)[20-24]。另外,非金属分子探针是降低金属基探针毒性的替代策略。Lin 等[25]以共轭聚合物聚吡咯制备T2 型MRI 分子探针,通过增强单极子与水分子的相互作用提高成像效果。本研究组通过乙二醇壳聚糖-聚吡咯和硝基自由基4-羧基-TEMPO 的酰胺化连接,开发出一种全有机MRI 分子探针,其MRI 增强效果可持续17 h[26]。此外,在肿瘤免疫微环境监测方面, Long 等[27]利用超顺磁性氧化铁探针追踪抗原呈递细胞,Wu 等[28]使用磁性介孔氧化硅纳米探针示踪中性粒细胞对脑胶质瘤的清除,这些研究不仅加深了研究者对免疫过程的理解,也为优化肿瘤治疗方案提供了重要的影像学支持(图1E)。
1.2 光学成像分子探针
相较于传统的MRI 和CT 成像,光学成像技术具有实时、无辐射和高灵敏等优势。荧光探针在光学成像中已广泛应用,从纳米级超分辨荧光成像到临床肿瘤边界导航均取得显著进展[29-31]。荧光探针成像原理主要包括分子内电荷转移(Intramolecular charge transfer, ICT)、光诱导电子转移(Photoinduced electrontransfer, PET)和荧光共振能量转移(Fluorescence resonance energy transfer, FRET)等机制[32]。荧光成像的局限性主要是对肿瘤功能边界成像缺乏特异性和灵敏性,并且在深层组织中的成像能力有限。为解决这些问题,研究者通过多种化学设计策略,如筛选靶标结合位点、调控荧光发射波长等,显著提高了光学探针在肿瘤边界成像中的特异性、灵敏性和穿透深度[33-35]。
荧光探针通常由靶标结合位点、荧光团和连接二者的连接体组成[36]。根据化学结构,荧光探针可分为小分子荧光探针和纳米结构荧光探针。针对肿瘤成像,常见的设计策略(图2A)包括:(1)结合型荧光探针 通过化学键将适合的荧光基团与配体共价偶联,利用肿瘤细胞特异性表达的受体实现靶向成像[37];(2)响应型荧光探针 设计能响应肿瘤微环境中特异性变化(如低pH 值、乏氧、活性氧和蛋白酶等)的化学结构,通过调控荧光团的发射强度或波长变化,在肿瘤区域恢复荧光信号[34];(3)生物正交化学荧光探针 通过在肿瘤部位目标生物分子上引入双正交官能团,实现肿瘤边界的荧光成像[38]。
肿瘤边界的特异性成像主要依赖于荧光探针对肿瘤和正常组织之间显著的荧光信号差异。因此,探针必须具备高效的靶向性和响应灵敏性[32]。针对这一需求,本研究组设计了一系列荧光探针用于肿瘤边界成像。例如,基于肿瘤细胞高表达的二肽基肽酶Ⅳ(Dipeptidyl peptidase Ⅳ, DPPⅣ),设计了抑制剂作为靶标结合位点的亲和型探针,实现了癌细胞的特异性成像(图2B)[39]。结合硝基还原酶(Nitroreductase,NTR)响应的小分子探针与金属有机框架材料,构建了NTR 响应的纳米荧光探针,解决了小分子探针代谢快的问题,实现了肿瘤功能边界的响应性成像(图2C)[40]。Zamay 等[41]开发的适配体荧光探针用于脑肿瘤边界可视化(图2D), Shen 等[42]开发的双锁荧光探针用于区分肿瘤细胞和正常细胞,均展示了光学探针在肿瘤边界精确成像中的应用潜力。此外,本研究组利用NPY 作为靶向分子,合成了近红外二区多肽荧光探针和上转换纳米复合荧光探针,实现了脑部肿瘤边界的深层组织成像(图2E)[43]。田捷研究组使用FDA 批准的吲哚菁绿有效区分正常组织与肿瘤边界,并在23 例肝癌患者中进行近红外二区荧光引导的手术切除,进一步验证了荧光成像在临床中具有较大的应用前景[44-45]。
1.3 声学成像分子探针
声学成像是一种通过超声波获取体内组织结构及其病理生理状态的医学影像技术,即利用正常组织与病变组织之间的声阻抗差异,当超声波通过二者界面时发生反射和折射,超声换能器接收到这些回声信号,并转换成电信号,经过计算机处理生成病变组织图像[46-47]。超声成像具有无创、无辐射和实时动态等优势,广泛应用于临床对肿瘤边界识别与成像诊断[48-49]。然而,超声成像的分辨率通常限于毫米级,导致其对肿瘤边界成像的对比度不足。为了解决此问题,研究者开发了声学成像探针,这些探针通常含有或能够产生气体,利用气泡对超声波的强散射作用,增强组织的后散射回声,从而改善超声图像的清晰度和分辨率[50-52]。
迄今为止,临床批准使用的超声成像探针的发展主要经历了两代。第一代探针以空气为内核,外壳由半乳糖和白蛋白等组成,典型代表为Echovist,其平均粒径约3 μm。尽管这类探针能在一定程度上增强超声成像对比度,但稳定性差,在血液中仅能维持约5 min。第二代探针以氟化碳惰性气体为内核,外层包裹磷脂分子,形成保护层以防气体泄漏,代表性产品包括SonoVue 和Sonazoid,平均粒径约2.6 μm,在血液中的循环时间延长至15 min 以上,成像稳定性大幅提高[53]。然而,由于现有临床超声成像探针粒径大,仅能进入肿瘤血管,无法有效渗透到肿瘤微环境(肿瘤血管内皮细胞间隙约为300~700 nm),因此,在增强肿瘤边界成像有效性方面仍有待提高。
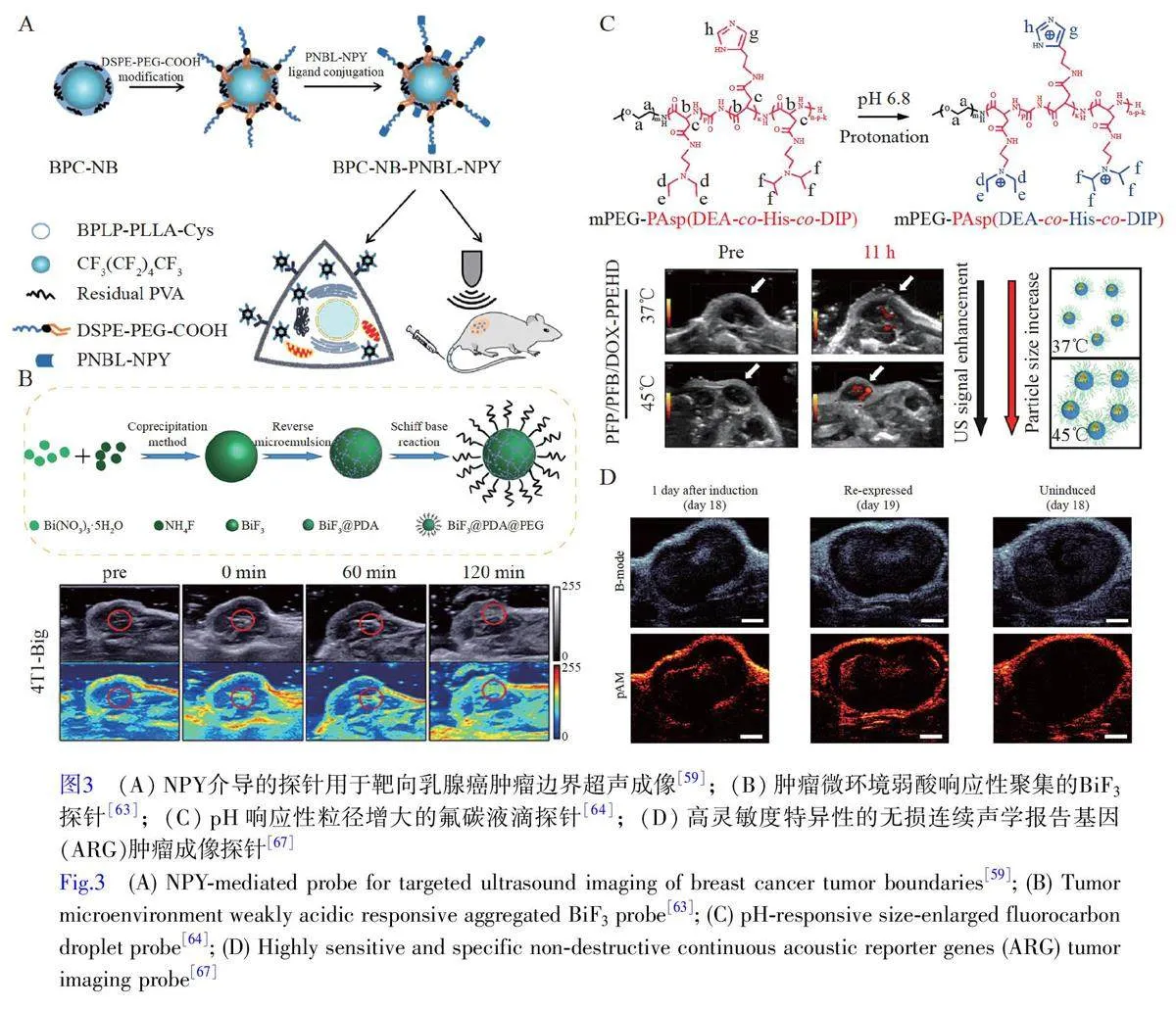
针对当前临床超声成像探针在肿瘤边界精准成像面临的挑战,国内外研究团队围绕纳米级粒径设计、肿瘤靶向分子修饰及微环境响应增强成像等方面开展研究,并取得了一系列突破性进展[54-57]。例如,本研究组比较了纳米级与微米级探针对活体乳腺癌肿瘤边界的超声成像效果,设计了乳腺癌边界精准识别探针以及声学治疗可视化探针[58-61]。通过乳化法将液态十四氟己烷(C6F14)封装在可生物降解的柠檬酸聚合物中,偶联NPY 配体,实现了对过表达Y1 受体乳腺癌的特异性靶向超声成像(图3A)[59]。Liang 等[62]设计了一种细胞膜包裹的全氟己烷纳米液滴,其细胞膜上融合了生长因子受体1 和CD93 配体,实现了对高表达CD93 的乳腺癌新生血管的靶向超声成像。Meng 等[63]设计了一种疏水性BiF3 分子探针(图3B),并在其表面修饰含亚胺键(C=N)的亲水聚合物聚乙二醇。C=N 在肿瘤弱酸性微环境(pH 6.5)中断裂,引起探针亲疏水性转变,形成较大声阻抗的“结石”样聚集体,实现了超声成像信号的大幅增强,为解析肿瘤演进机制提供了可靠的声学影像信息。
尽管纳米级超声成像探针能够穿过血管内皮进入肿瘤组织,但随着液滴尺寸减小,表面张力增大,汽化阈值随之升高,限制了其超声成像增强效果。为此, Zhang 等[64]研发了一种根据肿瘤微环境pH 值变化调节粒径的超声探针(图3C)。通过多步开环和氨解反应,合成了pH 响应的单甲氧基聚乙二醇-聚L-天冬氨酸的二嵌段共聚物,并封装氟碳化合物。在pH 6.8 的肿瘤环境中,探针粒径由178 nm 调节至437 nm,降低了汽化阈值。通过超声激发氟碳化合物相变,显著提升了肿瘤边界的超声成像清晰度。声学报告基因(Acoustic reporter genes, ARGs)作为新型超声探针,通过在细胞中表达特定基因产生可被超声波检测到的气泡信号,为在基因层面揭示疾病演进机制提供了可能[65-66]。Hurt 等[67]开发了一种高灵敏ARG 探针(图3D),其非线性对比度增强了38 倍。利用该探针成功追踪了乳腺癌小鼠模型中肿瘤基因表达和生长的动态变化,可无创可视化肿瘤边界和基因表达的演变过程。
1.4 核素成像分子探针
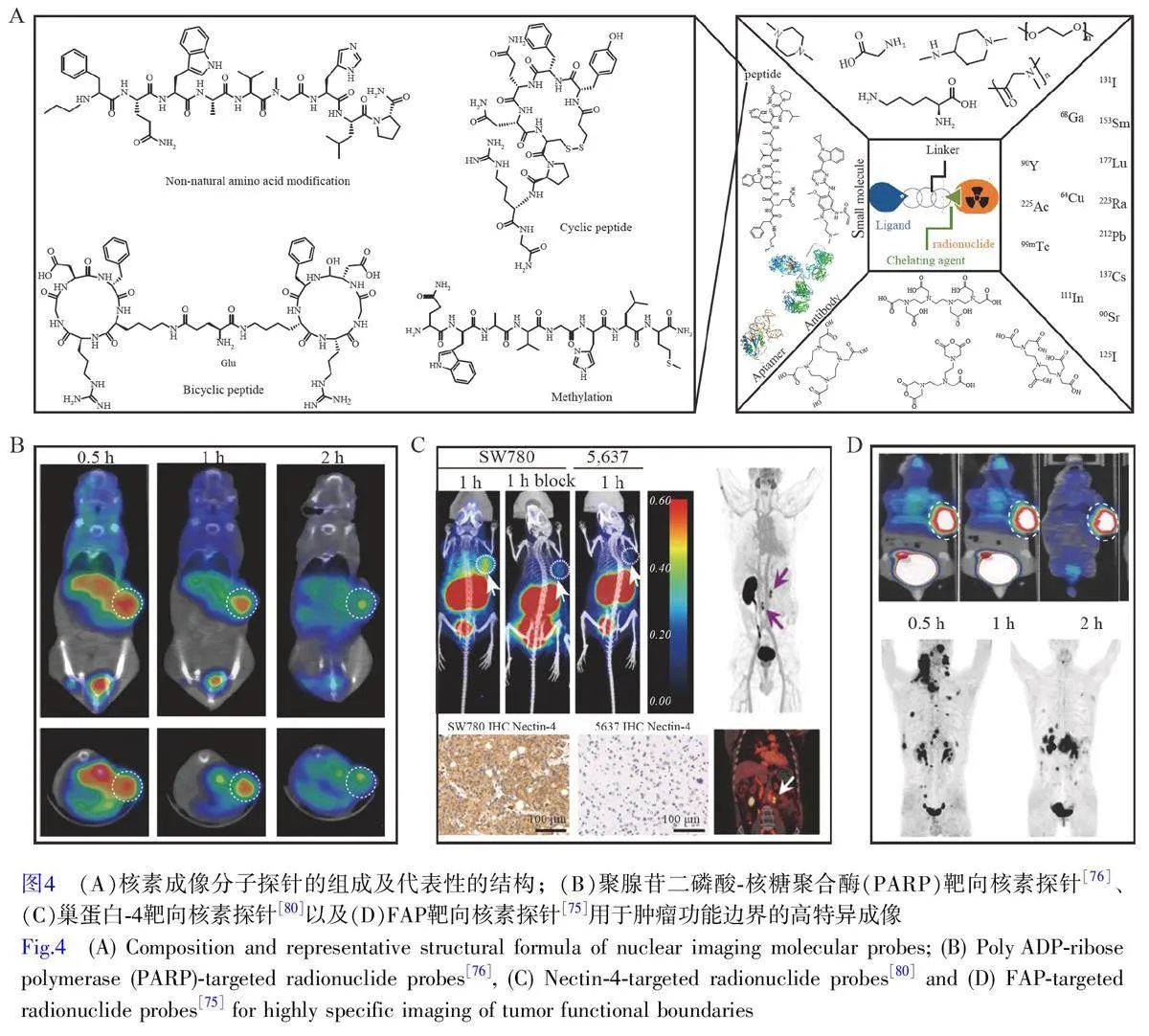
核素成像分子探针(图4A)是核医学中用于疾病诊断和治疗的关键工具,尤其在肿瘤诊疗领域发挥了关键作用。其技术优势[68-71]主要包括:(1)高灵敏度和特异性,通过靶向生物标记物(如胃泌素释放肽受体等)实现肿瘤特异性成像;(2)无创检测,避免了对患者身体的侵入;(3)定量分析,可以提供肿瘤大小、代谢活性及治疗效果的量化数据;(4)全身成像,能够一次性评估全身病变,尤其对转移性肿瘤的诊断至关重要。然而,核素成像分子探针也面临一些挑战[68,72-74]:(1)空间分辨率不足,难以检测微小的病变;(2)非特异性摄取,某些核素探针可能在非靶组织积累,增加背景噪声;(3)放射安全性,使用时需严格防护;(4)稳定性与生物分布,探针的稳定性和体内分布直接影响成像效果与治疗效果。
为了提高核素探针的成像性能,研究者对探针的螯合剂、连接子和靶分子进行了优化和调控。在稳定性方面,通过改进连接子和螯合剂的结构来提高探针的稳定性并减少放射性核素的早期释放[68]。Du 等[75]通过合成新型成纤维细胞激活蛋白(FAP)抑制剂和优化连接子的结构,研究其体内分布和肿瘤靶向性能(图4D)。该研究组还设计了68Ga标记的DNA修复酶PARP分子探针(68Ga-DOTA-Olaparib),在肿瘤模型中显示了高稳定性和快速PARP 成像的优点(图4B)[76]。在靶向配体修饰方面,研究者通过化学修饰提高靶向配体(如抗体、核酸适配体和多肽等)的亲和力和特异性,减少非特异性结合[73-74,77-79]。如Duan 等[80]基于双环肽支架开发的68Ga-N188 探针,在人体研究中实现了对高表达巢蛋白-4(Nectin-4)的转移性尿路上皮癌的特异性成像(图4C)。采用动态全身PET/CT 检测68Ga-N188 的药代动力学,分析12 例患者病变Nectin-4 免疫组化表达,发现68Ga-N188 的摄取与Nectin-4 的表达水平相关。这有助于优化患者对靶向药物(如恩福单抗维多汀)治疗的选择,并为新的预后成像生物标志物的发现提供支持。
核素成像探针已被广泛应用于揭示肿瘤边界的分子变化,包括肿瘤侵袭前沿的细胞类型和组织结构变化。例如,针对HER2 过表达的肿瘤(如乳腺癌),通过HER2 靶向探针进行成像和治疗,提供关于肿瘤生物学行为的重要信息[81]。随着肿瘤免疫治疗的发展, PD-1/PD-L1 靶向探针的研究为监测免疫治疗提供了新的工具[82]。此外,核素成像探针有助于揭示肿瘤微环境的变化、血管生成及肿瘤细胞的侵袭机制,为肿瘤的早期诊断和精准治疗提供了有力支持。
1.5 多模态成像分子探针
与单一模态成像相比,多模态成像技术整合了不同成像方式的优势,可提供高空间分辨率的解剖信息以及分子水平和时间分辨尺度上的高灵敏度生物学信息,能够深入解析肿瘤边界结构和功能变化,揭示肿瘤演进、侵袭及转移的过程及其分子机制[83-84]。多模态成像技术揭示了肿瘤边界演进的多个方面,包括肿瘤微环境变化、组织异质性、肿瘤与周围正常细胞的相互作用以及治疗过程中信号分子变化等[85]。因此,设计和构筑多模态成像分子探针,以全面解析肿瘤边界的分子、细胞及组织结构与功能的变化,具有重要意义。
近年来,多模态成像分子探针在揭示肿瘤边界的分子、细胞和组织特征方面取得了显著进展[86-87]。通过非侵入性技术对活体内特定分子或生化过程进行可视化定量分析,能够在分子水平上揭示肿瘤的生物学特征,提供肿瘤代谢、血流动态、氧合作用及分子标志物表达等关键信息,对于精准界定肿瘤边界至关重要。本研究组发现Fe3O4 的轨道能级交叠现象,通过调控探针与分子间的选择性能级耦合,实现了纳摩尔级灵敏度的表面增强拉曼光谱(SERS)检测,并结合MRI 技术,精确检测乳腺癌的分子分型,为肿瘤病灶边界的诊断提供了新的技术平台[88]。
高特异性靶向激活型分子探针的设计能显著提高对肿瘤病灶边界的精准识别。Hao 等[89]以聚乙二醇作为骨架,通过点击化学反应将叠氮基低pH 插入肽、尿液报告肽和双环辛烯结合,同时利用金属螯合剂修饰放射性同位素64Cu 构建了一种基质金属蛋白酶9(MMP 9)的高特异性PET/CT 分子探针,实现了对弥散性结直肠癌肿瘤微环境中代谢分子的精准成像。Das 等[90]研发的糖共轭大环内含有互锁不对称方形染料的双功能探针,可以增强探针的耐久性和近红外荧光效率。超顺磁性的超小氧化铁表面包被多巴胺偶联三苯基膦拴系的环己烷,能够实现远程交变磁场触发对肿瘤病灶边界细胞的线粒体靶向近红外荧光/MR 双模态成像,深入揭示病灶边界肿瘤细胞的生物学行为(图5A)。
当肿瘤细胞聚集并嵌入复杂的组织环境中,解析其与周围正常细胞的相互作用对于全面掌握肿瘤的生长特性和侵袭模式至关重要。Zhou 等[91]将硝基咪唑衍生物作为乏氧触发器修饰于超小氧化铁纳米粒子表面,以构建乏氧分子探针。在乏氧环境中,该探针在电子供体和硝基还原酶的作用下,通过生物还原反应触发大尺寸组装体的形成,从而提升T2 MR 成像信号。同时,利用乏氧微环境的疏水作用增强染料分子荧光,实现放大荧光和MR 双模成像,描绘肿瘤组织乏氧区域的三维信息。本研究组通过湿化学方法合成了具有窄带隙的CuFeSe2 纳米晶体,并与乳酸氧化酶和脑胶质瘤细胞膜蛋白脂质体融合,构建了具有同源靶向和免疫逃逸能力的近红外荧光/光声(PA)双模态成像探针。利用PA 成像监测分子探针在脑胶质瘤区域的积累,最终通过近红外荧光/PA 双模态成像清晰地识别脑胶质瘤的边界,为肿瘤病灶边界的演进机制的研究奠定了基础(图5B)[92]。
多模态成像分子探针能够提供多维度的生物学信息。通过逐步扩展视角,从微观的分子表达和细胞特征转向宏观的肿瘤组织边界,全面解析肿瘤发生的分子基础、异质性演化以及肿瘤微环境的特征,进而揭示肿瘤各演进阶段的生物学表征和恶性本质。这种多层次的分析有助于提高肿瘤诊断的准确性,指导治疗及评估疗效。随着生物医学工程技术的不断发展,预计未来将有更多的多模态成像分子探针问世并应用于临床,进一步推动医学诊断和治疗的发展。
2 肿瘤边界成像分子探针的研究趋势
近十年来,肿瘤边界成像分子探针领域的研究紧密围绕肿瘤边界演进机制、肿瘤结构与功能边界成像及多模成像等基础科学与临床医学的重大需求展开。该领域主要聚焦于3 个研究方向:(1)开发能够反映肿瘤边界形貌、边界定位以及分割的磁学及声学成像分子探针;(2)探索用于追踪肿瘤边界演进、微环境代谢与乏氧状态、肿瘤侵袭及转移等功能信息的光学与核素成像分子探针;(3)研究能同时反映肿瘤结构与功能边界信息的多模态成像分子探针(图6)。这些研究涵盖了铁基成像分子探针、近红外荧光分子探针、多功能分子探针等关键技术,以及磁共振成像、光学成像、声学成像、正电子发射成像、多模分子影像等先进成像模态。研究者通过化学结构官能团调控、靶向配体分子修饰、肿瘤微环境化学反应弱酸性/高氧化还原态/特异性酶响应设计等策略,提高分子探针对肿瘤结构与功能边界成像的灵敏性、特异性及安全性。
目前,实体肿瘤边界演进的深层次分子机制仍未完全明晰。现有的成像探针在跨尺度边界确定方面的时空分辨率存在局限性,并且成像模态单一,难以满足临床对肿瘤结构与功能边界精准成像信息的全面需求。因此,未来的研究需进一步精细调控与优化分子探针的化学结构、官能团及响应基团,提升其在分子、细胞与组织活体层面的跨尺度识别能力。在此基础上,通过多模态融合精准成像技术,获得肿瘤边界发生、发展、侵袭及转移的四维时空演进生物医学信息,实现肿瘤结构与功能边界信息的全面融合,这不仅有助于深入揭示肿瘤边界演进的分子机制,更为临床肿瘤的精准诊断、个性化治疗决策、疗效监测以及预后评估提供坚实的理论基础与实践指导。
3 总结与展望
目前,研究者对边界生物医学,特别是肿瘤边界生物医学领域的关注日益增加,其中有许多重大的科学和技术问题尚待进一步探索,例如细胞边界的动态性和复杂性,肿瘤病灶组织与正常组织器官边界的特异性,以及现有生物医学成像探针与技术的局限性,这些都制约了对生物体边界的深度理解和探索。本文总结了边界生物医学与肿瘤边界生物医学的基本概念、研究意义与面临的挑战;分析了肿瘤边界结构/功能成像探针与技术对于揭示肿瘤演进、侵袭及转移机制的科学意义,以及其对肿瘤诊断、治疗决策、疗效监测及预后评估中的临床价值。本文系统梳理了肿瘤边界结构与功能成像分子探针的研究进展。这些分子探针涵盖了磁学、光学、声学、核素及多模态成像分子探针,研究者通过化学结构官能团修饰、靶向配体分子修饰和肿瘤微环境化学反应响应设计等手段,调控分子探针的灵敏性、特异性与安全性,进而实现对肿瘤边界结构与功能的成像,揭示肿瘤边界演进的机制。
由于肿瘤边界的多尺度和多维度的复杂性,单一学科的技术手段或方法难以准确地量化描绘其四维时空的演进过程。因此,迫切需要寻找源自多个生物体之间能够表达肿瘤边界复杂性的主导控制因素、介尺度结构和功能参数,以揭示肿瘤边界演进中的关键分子机制。综上,针对当前肿瘤边界生物医学发展面临的挑战,科学界迫切需要打破学科的边界与认知的边界,凝聚化学、生命科学、医学、材料科学、物理和信息科学等领域的研究人员共同开展没有学科界限的肿瘤边界生物医学研究。从跨学科角度揭示肿瘤边界形成及演进过程相关的新机制,突破高灵敏、高特异分子探针合成与增强肿瘤边界识别技术,并结合基于人工智能的多模图像信息融合分析技术,发展用于边界研究的跨尺度、高灵敏、超分辨的未来成像技术与方法,构建多学科交叉融合的肿瘤边界生物医学研究的新范式和新领域。

