缺氧微环境下补阳还五汤通过抑制BNIP3-PI3K/Akt通路抑制类风湿关节炎滑膜成纤维细胞的线粒体自噬



摘要:目的 在低氧微环境下,以BNIP3-PI3K/Akt信号通路为核心,研究补阳还五汤参与FLS-RA线粒体自噬的调控机制。方法 将成纤维样滑膜细胞(FLS)体外培养,分为正常对照组(FLS-RA正常培养)、模型对照组(IL-1β诱导)、补阳还五汤含药血清低、中、高干预组(IL-1β 诱导+浓度分别为5%、10%、20%含药血清),除正常对照组外,其余组细胞按照10% O2浓度低氧处理。AnnexinV-APC/7-AAD双染测定细胞凋亡和T-AOC试剂盒检测细胞总抗氧化能力。探针分子测定细胞ROS,ATP试剂盒测定细胞ATP水平、线粒体膜电位(Δψm)、细胞Ca2+平衡稳态的变化。Western blotting法检测BNIP3、PI3K、AKT蛋白表达水平,RT-qPCR法检测BNIP3、PI3K、AKT及自噬相关因子LC3、Beclin-1、P62 mRNA 的表达。结果 补阳还五汤组能够降低细胞的凋亡百分比(Plt;0.05),且呈浓度依赖性。补阳还五汤组总抗氧化力降低,T-AOC浓度(U/mL)降低,ROS产生增加。观察到自噬小体的形成,ATP 酶水平释放量增加(Plt;0.05);线粒体膜电位、Ca2+水平均呈下降趋势。补阳还五汤组BNIP3 蛋白表达升高,PI3K、AKT表达降低;与模型组相比,补阳还五汤组BNIP3、P62、mRNA表达升高(Plt;0.05);PI3K、AKT、LC3、Beclin-1、mRNA表达降低,Beclin-1的表达差异无统计学意义(Pgt;0.05);LC3的表达仅在中药小剂量组差异无统计学意义(Pgt;0.05)。结论 在低氧环境下,补阳还五汤可能通过抑制BNIP3介导的PI3K/AKT通路,从而抑制了自噬因子的表达。
关键词:低氧;补阳还五汤;类风湿关节炎;滑膜成纤维细胞;BNIP3-PI3K/Akt;线粒体自噬
类风湿关节炎(RA)是一种病因不明且致残率较高的自身免疫性疑难疾病,以关节滑膜组织内反复发作的慢性炎症为主要病理特征[1]。成纤维样滑膜细胞(FLS)是RA病程中的主要效应细胞之一,其自噬/凋亡的平衡失调在关节破坏和慢性持续性炎症中起关键性作用[2]。
RA受累关节存在缺氧微环境[3]。RA关节滑膜组织增生不仅加剧关节腔低氧并释放大量炎性因子,加重氧化应激状态,氧化应激状态又促使炎性因子如α肿瘤坏死因子(TNF-α)、介素-1(IL-1)、IL-6、IL-12 和IL-15 释放增多,加剧软骨破坏,形成恶性循环,造成RA疾病进程加快[4]。自噬是一种重要的机体适应性反应,在机体应对应激环境时行使重要的促存活作用。而线粒体作为低氧反应最为敏感的细胞器,其自噬调节机制备受关注。BNIP3 是一种线粒体自噬的诱导因子,受低氧调控。类风湿关节炎成纤维样滑膜细胞可能通过激活PI3K与Akt组成的PI3K/Akt通路引起细胞的自噬[5],然而,缺氧微环境对滑膜成纤维细胞线粒体自噬的影响与机制,尚未有更深入的报道,探索其调控机制,有助于寻找到干预RA骨破坏的作用靶点。
类风湿关节炎属中医“尪痹”范畴,“气虚血瘀、络脉痹阻”为RA主要病机。补阳还五汤具有具有益气活血、通经活络的作用,是《医林改错》中所载的经典方剂,在临床中广泛应用。笔者前期多次用此方加减治疗RA气虚血瘀证型的患者,效果明显。这与由清代叶天士提出的“初为气结在经,久则血伤入络”病机概念相符合。
本研究以低氧微环境下的氧化应激引起的线粒体自噬为出发点,基于BNIP3介导的PI3K/Akt信号通路作为切入点,从细胞层面,研究补阳还五汤对RA滑膜成纤维细胞的调控机制,为中医传统经方的研究提供思路。
1 材料和方法
1.1 实验动物
SPF 级雌性Wistar 大鼠48 只、体质量200~250 g。通过河南省中医院伦理委员会审查并批准(伦理批号SL-HNSZYY-2020-35)。所有动物均饲养于温度22±2 ℃、相对湿度(50±10)%环境,每天光照时间12 h,自由进食及饮水,适应性饲养7 d。
1.2 实验材料
1.2.1 仪器 超净工作台(SW-CJ-1FD);CO2 恒温培养箱(SANYO);低速离心机(Eppendorf);流式细胞仪(BECKMAN);自动生化分析仪(深圳雷杜生命科技);透射电子显微镜(hitachi);PCR仪(东胜创新生物科技有限公司);水平电泳仪(北京君意东方电泳设备公司);水平摇床(江苏海门其林贝尔仪器制造公司);激光共聚焦显微镜(OLYMPUS);酶标仪(Thermo);电转仪(北京六一仪器厂);垂直电泳槽(北京六一仪器厂)。
1.2.2 试剂 细胞凋亡检测试剂盒(Elabscience);DMEM、 青霉素-链霉素混合液rypsin-EDTA(0.25%)(Procell);胎牛血清(Excell Bio);总抗氧化能力试剂盒、ATP含量试剂盒(南京建成生物工程所);活性氧(ROS)检测试剂盒、线粒体膜电位荧光探针JC-1检测试剂盒、Fluo-3 AM、RIPA 裂解液、磷酸酶抑制剂(碧云天);电镜固定液(Servicebio);蛋白marker(10 000~250 000,海利克思);PVDF 膜(0.45 μm, Millipore);兔单抗BNIP3、兔单抗PI3K、兔单抗AKT(Abclonal);HRP 标记羊抗兔二抗(武汉博士德生物工程有限公司);HiScriptIIQ RT SuperMix for qPCR(+gDNA wiper)、HiScript IIQ Select RT SuperMix for qPCR( +gDNA wiper)(VAZYME)。
1.3 实验药品
补阳还五汤加减(《医林改错》):黄芪30 g,川芎6 g,当归6 g,赤芍6 g,地龙3 g,桃仁3 g,红花3 g。IL-1β溶液配成终浓度为100 μg/L。
1.4 补阳还五汤含药血清的制备
将大鼠随机分为空白对照组和补阳还五汤治疗组,20只/组,对照组给予蒸馏水灌服,治疗组用量依据动物等效剂量比值计算,补阳还五汤组给药剂量为5.13 g/kg,每次灌胃1 mL,2次/d,连续灌胃1周。然后用1%戊巴比妥钠按照30 mg/kg 标准麻醉,无菌条件下由腹主动脉取血,静置1 h后3000 r/min,离心15 min取上清,将同组血清混合,56 ℃水浴灭活30 min,0.22 μm滤器过滤除菌,分装置于-80℃保存备用。
1.5 细胞培养、低氧处理及细胞分组
本实验所用人类风湿关节炎成纤维样滑膜细胞(FLS-RA)购于广州吉妮欧生物科技有限公司。为保证细胞有良好状态,本实验选用细胞第4代到第8代。
取处于对数生长期,生长状态良好的细胞,按每孔5×105均匀接种到6孔板中,37 ℃、5%CO2饱和湿度条件培养过夜;除正常组细胞外,其他组细胞均放入三气培养箱10%O2低氧处理24 h,待细胞完全贴壁后进行加药处理。
正常细胞对照组、模型组:加入10 ng/mL的IL-1β诱导1 mL。五阳还五汤低、中、高剂量组:在模型组基础上分别加入5%、10%、20%补阳还五汤含药血清1 mL。24 h后收集细胞进行后续实验。
1.6 双染测定细胞凋亡
细胞复苏和传代采用常规流程,细胞处理如前所述。AnnexinV-APC/7-AAD细胞凋亡检测试剂盒进行检测,流式细胞仪检测细胞阳性染色数目。
1.7 细胞总抗氧化能力检测
按总抗氧化能力试剂盒(T-AOC)说明书测定总抗氧化能力,标本混匀,防止10 min,波长520 nm,1 cm光径,双蒸水调零,测定各管吸光度值。总抗氧能力(=测定管吸光度值(ODU)-对照管吸光度值(ODC)/0.01/30×反应体系稀释倍数/待测样品蛋白浓度。
1.8 ROS检测
各组细胞用胰酶消化并收集,PBS润洗细胞2 次,弃上清;使用含染料DCFH-DA的细胞ROS 检测试剂盒进行检测;流式细胞仪上机检测。
1.9 透射电镜观察线粒体自噬小体
将细胞置于60 mm 培养皿中培养,分组24 h 后分别转至相应氧浓度培养箱中孵育,孵育24 h 后胰酶消化,PBS 漂洗,离心收集细胞沉淀固定等。采用透射电子显微镜观察细胞及线粒体超微结构。
1.10 细胞ATP水平的检测
将FLS细胞胰酶消化,低速离心,重悬后,按照实验要求接种于6孔板中,待细胞长至60%时进行实验,在不透光的96孔板中进行ATP检测,然后加入待测样本和标准品进行反应。用化学发光仪luminometer测定相对发光单位RLU值。根据标准品浓度和RLU值做标准曲线,再根据标准曲线得到样本ATP值。
1.11 检测线粒体膜电位(Δψm)的变化
按照比例稀释JC-1,即每50 μL JC-1(×200)加入8 mL超纯水的。充分溶解并混匀后再加入2 mL JC-1染色缓冲液(×5),再次混匀后即为JC-1 染色工作液。随后按照说明书依次染色、洗涤、上机检测。
1.12 检测细胞 Ca2+平衡稳态的变化
将Ca2+释放触发剂由100 μmol/L ATP,140 mmol/LNacl,50 mmol/LKcl,1 mmol/LMgcl2等组成,实时的荧光变化通过激光共聚焦显微镜的488 nm和515 nm的波长检测得到,代表细胞内Ca2+的释放、吸收幅度。
1.13 细胞自噬水平的检测
Western blotting 法检测Bnip3、PI3K、AKT蛋白表达水平。基本流程为:样本制备、上样、切胶、转膜、封闭、孵育一抗、孵育二抗、曝光。一抗GAPDH、BNIP3、AKT、PI3K,稀释比例均为1∶1000; HRP 标记二抗-1∶10 000稀释。
1.14 RT-qPCR 法检测细胞PI3K、AKT及自噬相关因子LC3-Ⅱ、Beclin-1、P62的mRNA 相对表达量
低氧浓度下的成纤维样滑膜细胞根据相关分组干预后,按照 Trizol 试剂说明书,用一步法提取组织总RNA,按照反转录试剂盒的要求配置逆转录反应体系并进行逆转录,得到cDNA后配置realtime PCR反应混合液,依相应条件扩增,根据参考文献合成引物(北京擎科生物科技有限公司,表1),进行 RT-qPCR 实验。
1.15 统计学分析
各组数据以均数±标准差表示,组间比较采用单因素方差分析,结合PostHoc Multiple Comparison 的LSD检验,所有数据均采用SPSS17.0 以及R 语言软件分析,以Plt;0.05 为差异有统计学意义。
2 结果
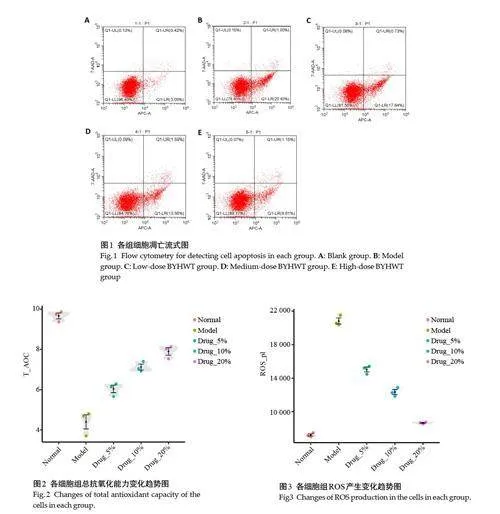
2.1 各组FLS细胞凋亡情况
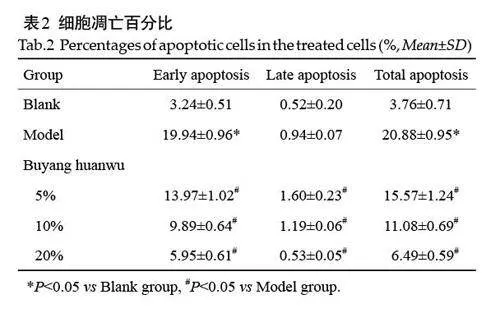
与空白对照组相比,加入10 ng/ml IL-1β诱导剂后FLS 细胞凋亡率增加(Plt;0.05);与诱导组比较,不同浓度的补阳还五汤含药血清均能够降低HFLS-RA细胞的凋亡百分比(Plt;0.05),且呈浓度依赖性(表2,图1)。
2.2 各组FLS细胞总抗氧化能力表达
模型组和正常细胞对照组比较,ROS 浓度明显上升(Plt;0.05)。给药期间补阳还五汤大、中、小剂量组总抗氧化力较对照组比较有所降低,T-AOC 浓度(U/mL)降低,ROS 产生增加(Plt;0.05)。与模型组对比,给药小剂量组在总抗氧化力方面二者差异无统计学意义(Pgt;0.05),给药中、高剂量组在总抗氧化力以及ROS 的产生与模型组比较,差异有统计学意义(Plt;0.05,图2、3)。
2.3 透射电子显微镜观察自噬小体的发生以及线粒体自噬变化
透射电子显微镜结果提示,与正常细胞对照组相比,模型诱导组有较多自噬发生,可以观察到更多的自噬小体和自噬溶酶体(图4)。
ATP 酶水平释放量均处于增加状态,给药组与模型组对比,差异有统计学意义(Plt;0.05);线粒体膜电位水平呈下降趋势,各给药剂量组与模型组对比差异有统计学意义(Plt;0.05);细胞Ca2+平衡稳态方面,胞内钙离子浓度整体呈下降趋势,但给药小剂量组与模型组比较,差异无统计学意义(Pgt;0.05,表3)。
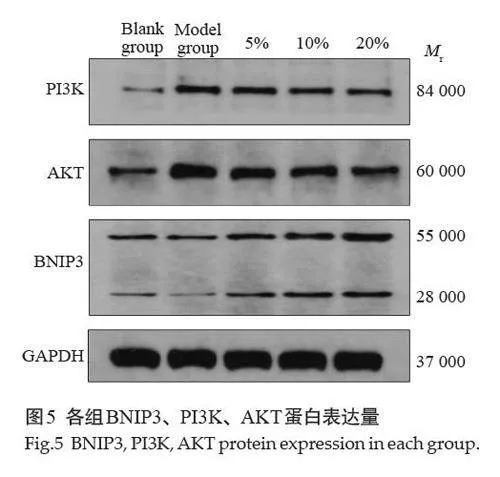
2.4 Western blotting 法检测BNIP3、PI3K、AKT蛋白表达水平
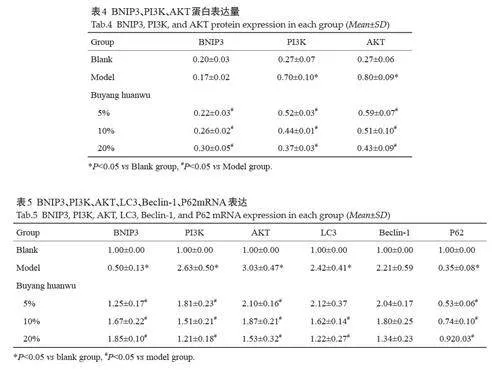
与模型组相比,补阳还五汤组 BNIP3 蛋白表达均升高(Plt;0.05),但与空白对照组相比,差异无统计学意义(Pgt;0.05)。与模型组相比,补阳还五汤组PI3K、AKT蛋白表达均呈降低趋势,且差异具有统计学意义(Plt;0.05,表4)。
2.5 q-PCR 检测补阳还五汤对BNIP3、PI3K、AKT、以及自噬相关因子LC3、Beclin-1、P62 mRNA表达的影响
与模型组相比,补阳还五汤组BNIP3、P62、mRNA表达均升高(Plt;0.05);补阳还五汤组PI3K、AKT、LC3、Beclin-1、mRNA表达均降低,但是Beclin-1 的表达在补阳还五汤低、中、高剂量组中差异均无统计学意义(Pgt;0.05);LC3 的表达仅在中药小剂量组时差异无统计学意义(Pgt;0.05,表5,图5)。
3 讨论
类风湿关节炎的发生与遗传、免疫系统紊乱、感染、环境刺激等多种因素有关,发病机制尚未完全阐明[6]。目前尚无特异性治疗方式,如何更好地预防和控制疾病的发展是亟待解决的难题。线粒体自噬与关节炎症之间的研究日益增多,但在缺氧微环境下,二者之间究竟如何影响尚在探究中。本研究结果发现,益气养血中药补阳还五汤能降低氧化应激状态,增强总体抗氧化能力,降低ROS的产生,延缓了线粒体自噬现象的发生。可能是通过抑制BNIP3介导的PI3K/AKT通路,从而抑制了自噬因子的表达。
RA受累关节存在缺氧微环境[7]。正常生理状态下,机体氧化-抗氧化作用在一定范围内达到动态平衡,当遭受低氧刺激时,氧化系统失衡,细胞线粒体电子传递链中作为电子最终受体的氧分子供应不足,导致产生大量的ROS蓄积过多,从而对细胞中大分子和细胞器造成损伤,最终导致细胞功能紊乱或死亡[8]。目前,活性氧的含量评估是氧化应激状态的重要衡量指标[9]。本研究中,在低氧影响下,模型诱导组、诱导+给药组(补阳还五汤大、中、小剂量)的总抗氧化力相对正常组,均呈降低状态,T-AOC浓度降低,ROS 产生增加,而通过细胞凋亡率的测定,发现补阳还五汤组能够降低HFLSRA细胞的凋亡百分比(Plt;0.05),且呈浓度依赖性。说明益气养血方补阳还五汤的干预能够对抗ROS蓄积引起的细胞损伤或死亡。
90%的ROS产生于线粒体。其损伤主要存在于3个方面:氧化损伤,钙稳态失调以及ATP合成[ 10]。ROS蓄积可损伤细胞内的大分子物质,线粒体呼吸链的损伤会导致ATP合成的破坏。由于钙离子的转运是耗能的过程,所以缺乏ATP供应会导致胞内钙离子浓度增加,使得钙离子稳态失调[11]。三者共同作用会诱导线粒体通透性(mPTP)改变,产生膜电位降低,造成线粒体结构的改变,诸如肿胀、甚至外膜破裂[12],同时线粒体向胞质内释放细胞色素c,然后激活凋亡诱导因子,最终导致细胞凋亡[13]。因此,本研究从以上3个方面观察了线粒体自噬的变化,不仅在透射电镜下能观察到自噬小体的形成,同时检测到ATP酶水平释放量发生变化,线粒体膜电位水平和胞内钙离子浓度呈下降趋势。
线粒体自噬在细胞凋亡过程中起调节作用[14]。LC3 是位于自噬体膜上的标记蛋白[15]。BNIP3 定位于线粒体,是低氧诱导激活线粒体自噬发生中的重要信号分子[16]。研究发现BNIP3不仅能诱导线粒体膜电位的降低[17],在线粒体自噬中也发挥着重要的作用[18]。低氧条件下可通过其LIR结构域与LC3蛋白发生相互作用,从而诱导线粒体自噬;同时,BNIP3磷酸化可增强其与LC3 蛋白的相互作用,进一步促进线粒体自噬[19]。因此,我们推测BNIP3在自噬的发生过程中,起介导作用。
有报道显示,当低氧诱导BNIP3高表达时,BNIP3和BNIP3L能与Beclin-1竞争性地与Bcl-2或Bcl-XL相结合[20],因此,Beclin-1 会从线粒体上的Bcl-2/Beclin-1或Bcl-XL/Beclin-1 复合体释放出来,游离的Beclin-1与Vps34、Ambra1等多种蛋白共同形成III型磷脂酰肌醇-3-激酶(PI3K)复合体,进而激活PI3K/Akt通路[21]。
PI3K/Akt信号通路广泛存在于滑膜组织,对RA的滑膜细胞增殖有重要的作用[22]。基于以上理论,通过进一步对自噬相关因子的分析,发现补阳还五汤抑制了自噬因子(LC3、Beclin-1)的表达,而促使p62表达水平升高(溶酶体降解过程中,与底物结合的p62 被蛋白水解酶降解。因此,p62水平升高通常被认为是自噬活性受到抑制的标志[23]),也减缓了线粒体自噬现象的发生,而PI3K、AKT的表达也同时降低,综上所述,可能是通过抑制BNIP3介导的PI3K/AKT通路,从而抑制了自噬因子的表达。
RA在中医称为痹病、尪痹,病因病机概括为正虚邪实[24],患者多病程绵长,久治不愈,气虚血瘀型在临床较为常见[25],而补阳还五汤因疗效确切,被广泛应用。补阳还五汤由黄芪、川芎、红花、当归尾、赤芍、桃仁、地龙组成,是由清代名医王清任创制的经典名方,首见于《医林改错》一书中,具有益气活血、祛瘀通络的功效。方中重用生黄芪,大补脾胃之元气,令气旺血行,瘀去络通,为君药;当归尾长于活血,且有化瘀而不伤血之妙,是为臣药;川芎、赤芍、桃仁、红花助当归尾活血祛瘀,地龙通经活络,均为佐药。本方的配伍特点是大量补气药与少量活血药相配,使气旺则血行,活血而不伤正,共奏补气活血通络之功。纵观全方布局,采用大量补气药与少量活血化瘀药配伍,使阳气旺盛,血液运行恢复如常,瘀血去除,经络通畅,活血而不伤正。
近年来,对补阳还五汤的基础及临床研究取得较多进展。Meta 分析显示其具有较好的临床疗效和安全性[26-28]。而我们的研究表明,补阳还五汤中西药组患者临床症状HAQ和VAS评分、血清IL-4和CRP指标较西药组改善更为明显(Plt;0.05)[29],实验研究表明关节病理检测给药治疗后补阳还五汤组小鼠血管翳明显减少,炎性细胞浸润明显减轻,骨结构与模型组相比相对完整[30]。
综上所述,益气养血方补阳还五汤在RA的应用中,无论临床疗效,还是生物学基础方面均有肯定的评价,我们旨在通过更多的科学研究,在丰富痹症的现代内涵的同时,能真正让中医药发挥特色优势。尤其是在慢行免疫疾病如类风湿关节炎的临床治疗中,中西医结合疗法值得进一步的探索。
参考文献:
[1] Buchanan WW, Kean CA, Kean WF, et al. Rheumatoid arthritis[J].
Inflammopharmacology, 2024, 32(1): 3-11.
[2] Hu YD, Liu J, Jiang H, et al. Regulation of autophagy by circular
RNAs in rheumatoid arthritis: potential targets of action[J]. Int J
Rheum Dis, 2023, 26(5): 831-40.
[3] Cai SH, Sun Y, Wang Y, et al. Exploring the effect of LncRNA
DANCR to regulate the Keap1-Nrf2/ARE pathway on oxidative
stress in rheumatoid arthritis[J]. Immun Inflamm Dis, 2024, 12(1):
e1163.
[4] 丁仙红, 朱红国. 类风湿关节炎患者血清炎症因子和氧化应激指标
治疗前后水平的变化[J]. 中国现代医生, 2020, 58(22): 135-8.
[5] Liu FF, Wang Y, Huang D, et al. LncRNA HOTAIR regulates the
PI3K/AKT pathway via the miR-126-3p/PIK3R2 axis to participate
in synovial angiogenesis in rheumatoid arthritis[J]. Immun Inflamm
Dis, 2023, 11(10): e1064.
[6] Dervisevic A, Fajkic A, Jahic E, et al. Systemic immuneinflammation
index in evaluation of inflammation in rheumatoid
arthritis patients[J]. Medeni Med J, 2024, 39(3): 183-91.
[7] Tang Z, Meng SY, Yang XX, et al. Neutrophil-mimetic, ROS
responsive, and oxygen generating nanovesicles for targeted
interventions of refractory rheumatoid arthritis[J]. Small, 2024, 20
(20): e2307379.
[8] Balogh E, Veale DJ, McGarry T, et al. Oxidative stress impairs
energy metabolism in primary cells and synovial tissue of patients
with rheumatoid arthritis[J]. Arthritis Res Ther, 2018, 20(1): 95.
[9] Mukhopadhyay K, De S, Kundu S, et al. Evaluation of levels of
oxidative stress as a potential biomarker in patients with rheumatoid
arthritis[J]. J Family Med Prim Care, 2021, 10(5): 1981-6.
[10]张铌雪, 苏晓慧, 田雅格, 等. 自噬在类风湿关节炎中的作用及中药
干预研究进展[J]. 中国实验方剂学杂志, 2021,27(6):169-75.
[11]廉 坤, 李 鑫, 宁 博, 等.线粒体自噬研究的文献计量学可视化分析
[J]. 中西医结合心脑血管病杂志, 2024, 22(3): 425-32.
[12]刘 煜, 岳 婷, 杨东宇, 等. 自噬在类风湿关节炎发病机制中的研究
进展[J]. 中国全科医学, 2023, 26(29): 3710-4.
[13]Cid-Castro C, Hernández-Espinosa DR, Morán J. ROS as regulators
of mitochondrial dynamics in neurons[J]. Cell Mol Neurobiol,
2018, 38(5): 995-1007.
[14]Kato M, Ospelt C, Gay RE, et al. Dual role of autophagy in stressinduced
cell death in rheumatoid arthritis synovial fibroblasts[J].
Arthritis Rheumatol, 2014, 66(1): 40-8.
[15]Ramzan R, Dolga AM, Michels S, et al. Cytochrome c oxidase
inhibition by ATP decreases mitochondrial ROS production[J].
Cells, 2022, 11(6): 992.
[16]Deng R, Wang Y, Bu YH, et al. Geniposide augments apoptosis in
fibroblast-like synoviocytes by restoring hypoxia-enhanced JNKBNIP3-
mediated autophagy[J]. Inflamm Res, 2023, 72(8): 1745-60.
[17]Ney PA. Mitochondrial autophagy: origins, significance, and role of
BNIP3 and NIX[J]. Biochim Biophys Acta, 2015, 1853(10 Pt B):
2775-83.
[18]Fan DD, Tan PY, Jin L, et al. Bioinformatic identification and
validation of autophagy-related genes in rheumatoid arthritis[J].
Clin Rheumatol, 2023, 42(3): 741-50.
[19]Deng R, Wang Y, Bu YH, et al. BNIP3 mediates the different
adaptive responses of fibroblast-like synovial cells to hypoxia in
patients with osteoarthritis and rheumatoid arthritis[J]. Mol Med,
2022, 28(1): 64.
[20]Li H, Wu QY, Teng XH, et al. The pathogenesis and regulatory role
of HIF-1 in rheumatoid arthritis[J]. Cent Eur J Immunol, 2023, 48
(4): 338-45.
[21]Li S, Chen JW, Xie X, et al. Autophagy inhibitor regulates apoptosis
and proliferation of synovial fibroblasts through the inhibition of
PI3K/AKT pathway in collagen-induced arthritis rat model[J]. Am
J Transl Res, 2017, 9(5): 2065-76.
[22]程伟刚, 李浩林, 杨娟娟, 等.中医药调控PI3K/Akt信号通路治疗类
风湿关节炎的研究进展[J]. 中药新药与临床药理, 2024, 35(5):
756-64.
[23]Chen YM, Chang CY, Chen HH, et al. Association between
autophagy and inflammation in patients with rheumatoid arthritis
receiving biologic therapy[J]. Arthritis Res Ther, 2018, 20(1): 268.
[24]陈宏道, 丁一帆, 谢师旅, 等. 中医药治疗类风湿关节炎临床研究进
展[J]. 江西中医药, 2023, 54(4): 73-6.
[25]曾 苹, 侯 雷, 宁乔怡, 等. 马武开教授从气虚血瘀论治类风湿关节
炎临床经验[J]. 风湿病与关节炎, 2018, 7(4): 51-3.
[26]蒋 总, 姚晓玲, 唐 芳, 等. 系统评价补阳还五汤对强直性脊柱炎临
床疗效的Meta分析[J]. 贵州中医药大学学报, 2020, 42(2): 68-73.
[27]郑卓铭, 李 坚. 补阳还五汤治疗骨科相关疾病的研究进展[J]. 中医
临床研究, 2023, 15(24): 96-102.
[28]谢有鑫,王晓霞, 李森贤.补阳还五汤加减治疗类风湿性关节炎临床
研究[J].新中医, 2022, 54(23): 39-42.
[29]展俊平, 孟庆良, 孟婉婷,等. 补阳还五汤配合西药治疗类风湿关节炎
气滞血瘀证临床观察[J]. 山西中医, 2018, 34(8): 29-30.
[30]展俊平, 孟庆良, 孟婉婷, 等. 补阳还五汤对类风湿关节炎小鼠
MPO, NE mRNA表达及TNF-α, IL-1β, IL-6, IL-17的影响[J]. 中国
实验方剂学杂志, 2018, 24(24): 158-63.
(编辑:吴锦雅)