清达颗粒通过调控miR-124/STAT3信号轴减轻自发性高血压大鼠脑损伤



摘要:目的 探讨清达颗粒(QDG)对自发性高血压大鼠(SHR)脑损伤的保护作用及其对miR-124/STAT3 信号轴的影响。方法6只5周龄WKY大鼠为WKY组,12只5周龄SHR大鼠分为SHR组、SHR+QDG组,6只/组。SHR+QDG组大鼠每天给予QDG灌胃,灌胃剂量为0.9 g/(kg·d),连续灌胃12周,其余组大鼠每天给予等体积生理盐水灌胃。利用鼠尾无创血压仪监测血压,HE染色观察脑皮质区病理,TUNEL 染色检测皮质区凋亡,Q-PCR 检测miR-124、STAT3 mRNA 的表达,免疫组化和Westernblotting检测NeuN、STAT3、Bcl-2、Bax、cleaved caspase-3的表达;利用氧糖剥夺/复氧(OGD/R)构建神经元HT22细胞损伤模型,分为Control组、QDG组、OGD/R组、OGD/R+QDG组。利用CCK-8法检测细胞活力,Hoechst 33342染色检测细胞凋亡,Q-PCR检测miR-124、STAT3、Bcl-2、Bax mRNA的表达,Western blotting检测STAT3、Bcl-2、Bax、cleaved caspase-3的表达。结果 体内实验中,与WKY组比较,SHR组大鼠的收缩压、舒张压及平均动脉压均升高(Plt;0.05),脑皮质区神经元出现核固缩,数量减少,凋亡率升高(Plt;0.05),NeuN、miR-124、Bcl-2 的表达降低,STAT3、Bax、cleaved caspase-3 的表达升高(Plt;0.05)。与SHR组比较,清达颗粒能降低SHR大鼠的收缩压、舒张压及平均动脉压(Plt;0.05),改善SHR大鼠脑皮质区的病理损伤,降低皮质区的凋亡率(Plt;0.05),升高皮质区的NeuN、miR-124、Bcl-2 的表达(Plt;0.05),降低STAT3、Bax、cleaved caspase-3 的表达(Plt;0.05)。体外实验中,与Control 组比较,OGD/R 组凋亡率升高,miR-124、Bcl-2 表达降低,STAT3、Bax、cleaved caspase-3 表达升高(Plt;0.05);与OGD/R 组比较,清达颗粒能降低OGD/R 诱导的HT22 细胞凋亡,升高miR-124、Bcl-2 表达,降低STAT3、Bax、cleaved caspase-3 表达(Plt;0.05)。结论 清达颗粒可能通过调控miR-124/STAT3 信号轴,抑制神经元的凋亡,从而减轻SHR大鼠的脑损伤。
关键词:清达颗粒;高血压;脑损伤;神经元;miR-124/STAT3 信号轴
重大慢病高血压患病率呈逐年上升的趋势,是死亡的首要危险因素[1,2]。据统计,高血压最终导致超过51%的患者死于脑血管意外[3]。高血压引起的脑损伤发病机制复杂,涉及炎症反应、氧化应激、凋亡、自噬等过程,其中神经元凋亡在高血压脑损伤的发生发展中起着重要作用[4]。及时降低血压、抑制神经细胞凋亡能显著降低高血压引起的脑血管风险。
miRNAs是一类能与靶基因的3'UTR特异性结合,使mRNA 降解或抑制蛋白翻译的小RNA[5,6]。其中miR-124 是一种大量存在于中枢神经系统的特异性miRNA[7]。STAT3是miR-124的靶基因,参与神经元凋亡[8]。研究表明,miR-124在1-甲基-4-苯基-吡啶离子诱导的帕金森病细胞模型中通过靶向STAT3发挥神经保护作用[9]。也有研究表明miR-124 靶向抑制STAT3 缓解脑缺血再灌注损伤模型中的神经元焦亡[10]。可见miR-124/STAT3信号轴参与了脑损伤的发生发展过程。通过调控miR-124/STAT3信号轴是治疗脑损伤的一种有效策略。
陈可冀院士认为高血压肝阳上亢证是治疗高血压和提高防控水平的关键环节,治疗上强调清热平肝,并对其临床经验方清眩降压汤进行精简化裁,创制了由天麻(12 g)、钩藤(10 g)、黄芩(6 g)、莲子心(5 g)组成的清达颗粒(QDG),具有清肝热、泻心火、舒达肝气之功效[11]。多中心RCT临床研究证实清达颗粒的降压疗效显著[12]。基础研究表明,清达颗粒能够显著抑制自发性高血压大鼠(SHR)和血管紧张素Ⅱ诱导的高血压小鼠血压的升高,改善高血压引起的血管重构、心肌肥大及肾脏纤维化等靶器官损害[13-16]。在脑保护方面,清达颗粒能通过调控lncRNA GAS5/miR-137[17]、p38MAPK/Nrf2/HO-1[18]、TLR4/NF-κB/NLRP3[19]等信号通路发挥对缺血再灌注大鼠脑组织的保护作用。然而,其在SHR大鼠中的神经保护作用及其潜在机制尚不清楚。本研究利用SHR大鼠来研究清达颗粒对高血压大鼠的脑保护作用,并从miR-124/STAT3 信号轴进一步阐明其潜在的作用机制,为其在高血压防治中的应用提供理论依据。
1 材料和方法
1.1 实验动物
雄性Wistar-Kyoto(WKY)、SHR大鼠(5周龄,体质量120±20 g)分别为6只、12只,由上海斯莱克实验动物有限责任公司提供。所有大鼠饲养于SPF级的动物饲养室,实验期间动物房的环境温度为20.8~24.3 ℃,12 h照明/12 h黑暗交替,所有动物均自由饮食,2~3 d更换垫料。所有动物实验均严格按照国际伦理准则和美国国立卫生研究院关于实验动物的护理和使用指南进行,并经福建中医药大学动物伦理委员会批准(伦理批号:1905310)。
1.2 实验药物与细胞
清达颗粒委托江阴天江药业有限公司制备成颗粒剂,规格:5 g/袋。HT22细胞(上海泽叶生物科技有限公司)。
1.3 主要试剂
伊红染色液、Ehrlich苏木素染色液(北京索莱宝科技有限公司);即用型免疫组化UltraSensitive TM SP试剂盒、DAB 染色液(迈新生物技术开发有限公司);cleaved caspase-3、Bcl-2、STAT3 抗体(Cell SignalingTechnology);NeuN,Bax 抗体(Abcam);HiScriptⅡ 1stStrand cDNA Synthesis kit(南京诺唯赞生物科技股份有限公司);RNAiso Plus 试剂、SYBR Premix Ex TaqTM试剂盒(大连Takara生物技术有限公司);TUNEL染色试剂盒(上海碧云天生物技术有限公司);Hoechst33342染色液(北京索莱宝科技有限公司);CCK8试剂盒(武汉博士德生物工程有限公司)。
1.4 主要仪器
CODATM无创血压仪(Kent Scientific);倒置荧光显微镜系统(Leica);CO2 恒温培养箱(Thermo FisherScientific);超净工作台(苏州净化设备有限公司);LX-800 酶标仪(Bio-Tek);ABI 7500 Fast PCR 仪(ABI);Mini-PROTEAN Tetra Cell 电泳槽、ChemiDocMP全能型成像系统(Bio-Rad)。
1.5 动物分组及给药
将6只WKY大鼠及12只SHR大鼠采用随机数字表法分为WKY组、SHR组、SHR+QDG组,6只/组。按照《中药药理研究方法学》上的等效体表面积折算,SHR+QDG组大鼠给予QDG灌胃给药,剂量为:0.9 g/(kg·d),1次/d,每只灌胃1.5 mL/次,连续灌胃12周。WKY组、SHR组大鼠每天给予等体积的生理盐水灌胃。
1.6 测量血压
每2 周进行血压测定。血压测定简要步骤:将CODATM 血压测量系统安装好,用固鼠器固定大鼠,于加热板上加热3 min。然后将尾袖套在大鼠尾巴根部,设置好软件后开始测定,每只大鼠测定15 次,记录各只大鼠合格的收缩压、舒张压及平均动脉压,最后取其平均值。
1.7 HE染色检测各组大鼠脑皮质区的病理改变
采用异氟烷进行麻醉,快速取下大脑。利用4%多聚甲醛进行固定,行常规石蜡包埋,再进行切片(厚度为5 μm)。将烘干后的切片用二甲苯脱蜡,经梯度乙醇脱蜡至水,然后行HE染色。苏木素染色2 min,1%乙醇分化30 s,伊红染色1 min。常规风干,封片后在光镜下观察脑组织皮质病理变化。
1.8 TUNEL染色检测各组大鼠脑皮质区的凋亡
取出各组织切片(厚度为5 μm),脱蜡后按顺序孵育Proteinase K、3% H2O2、生物素标记液、标记反应终止液、Streptavidin-HRP 工作液,且每次孵育结束后均用PBS洗涤。各试剂孵育结束后进行DAB显色、苏木素复染、PBS洗涤,晾干后用中性树脂封片并在显微镜下观察,拍照。最后使用Image J软件进行半定量分析。
1.9 免疫组化检测各组大鼠脑皮质区的NeuN、Bcl-2、Bax和cleaved caspase-3的表达
取出各组织切片(厚度为5 μm),回温,PBS洗3遍,5 min/次,后行程序脱蜡复水,抗原修复,封闭、分别用NeuN、Bcl-2、Bax和cleaved caspase-3的一抗(1∶200)孵育过夜。PBS洗涤后,进行二抗(1∶200)孵育,DAB染色,苏木素染核,封片并拍照,最后用Image J软件进行半定量分析。
1.10 细胞培养
用含10% 胎牛血清、1% 青霉素/链霉素双抗的DMEM-高糖培养基培养HT22细胞,将细胞置于37 ℃、5% CO2恒温培养箱中进行传代,待细胞处于对数生长期时用于后续实验。
1.11 体外OGD/R模型的构建
待细胞贴壁达70%后,去掉培养基,更换为无葡萄糖的DMEM培养基;随后将HT22 细胞置于37 ℃、含1%O2、5%CO2、94%N2的缺氧培养箱中培养4 h;4 h后将细胞取出,去掉无葡萄糖的DMEM培养基,换成正常的DMEM-高糖完全培养基,继续在常氧培养箱中培养24 h。在造模期间,对照组细胞在常氧条件下用正常的DMEM-高糖完全培养基进行培养。
1.12 CCK-8法检测细胞活力
将HT22细胞以1.0×105/mL的密度接种到96孔板中,100 μL/孔。24 h 后去掉上清液,分别加入0、6.25、12.5、25、50、100、200 μg/mL QDG干预24 h。干预结束后,加入10 μL/孔的CCK-8溶液,37 ℃培养2 h。培养结束后,室温振荡10 min后,用酶标仪测A570 nm值。
同时,将HT22 细胞分为0、OGD/R、OGD/R+6.25 μg/mL QDG、OGD/R+12.5 μg/mL QDG、OGD/R+25 μg/mL QDG、OGD/R+50 μg/mL QDG、OGD/R+100 μg/mL QDG,造模方式同1.11,造模结束后加入不同浓度的QDG干预24 h,24 h后进行CCK8检测。检测方法同上。
1.13 Hoechst 33342染色检测细胞凋亡
干预结束后,弃培养基,每孔加入1 mL多聚甲醛固定15 min,PBS洗涤后,每孔加入1 μg/mL Hoechst33342染色液500 μL,室温孵育5 min。5 min 后,去掉Hoechst33342染色液,用PBS洗涤后,加入 PBS 2 mL/孔,在荧光显微镜下进行观察,拍照。最后使用Image J软件进行分析。
1.14 Q-PCR 法检测miR-124、STAT3、Bcl-2、Bax 的表达
用RNAiso Plus 试剂提取总RNA。使用Oligo(dT)或专用RT-miR-124 引物(小鼠序列:GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCATT;大鼠序列:GTCGTATCCAGTGCAGGGTCCGAGGTATTCGCACTGGATACGACGGCATT,福州尚亚生物技术有限公司)以及HiScript 1st StrandcDNA Synthesis kit 进行逆转录,用SYBR Premix ExTaqTM试剂盒和和ABI 7500 Fast PCR系统进行PCR扩增,具体操作步骤根据说明书进行。以U6 和GADPH分别作为miR-124 和其他基因的内参。利用2−△△CT计算miR-124、STAT3、Bcl-2、Bax的mRNA表达水平。
1.15 Western blotting 检测STAT3、Bcl-2、Bax、cleavedcaspase-3的表达
用RIPA裂解液提取脑组织及各组细胞中的总蛋白质,用BCA法进行蛋白定量。取50 μg总蛋白进行SDSPAGE电泳,用PVDF膜进行转膜,5%脱脂牛奶进行封闭,分别用STAT3、Bcl-2、Bax、cleaved caspase-3 一抗(1∶1000),4 ℃孵育过夜。TBST洗涤3次,再用相应的二抗(1∶10 000)室温孵育1 h。TBST洗涤3次后,进行化学发光成像,最后用Image Lab 软件进行成像分析。
1.16 统计学分析
采用SPSS25.0软件进行统计分析。所有计量资料均以均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析。以Plt;0.05为差异有统计学意义。
2 结果
2.1 清达颗粒对SHR大鼠血压的影响
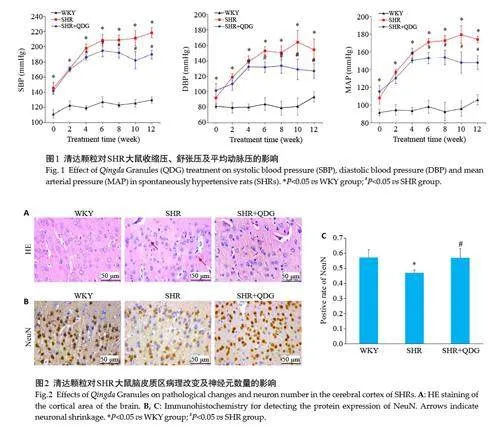
与WKY大鼠比较,SHR大鼠的收缩压、舒张压及平均动脉压升高,且持续到12周(Plt;0.05);清达颗粒干预后,能降低SHR大鼠的收缩压、舒张压及平均动脉压的升高(Plt;0.05,图1)。
2.2 清达颗粒对SHR大鼠脑皮质区病理改变及神经元数量的影响
WKY组脑皮质区中神经元胞浆丰富,胞核居中,核仁清楚;SHR组皮质区神经元出现皱缩、细胞数量减少;与SHR组相比,清达颗粒干预后能改善SHR大鼠脑皮质神经元的病理改变(图2A)。
与WKY 组比较,SHR 组的NeuN 表达降低(Plt;0.05);清达颗粒干预后,能增加SHR 组脑皮质区的NeuN表达(Plt;0.05,图2B)。
2.3 清达颗粒对SHR大鼠脑皮质区凋亡及其相关蛋白表达的影响
与WKY组比较,SHR组的凋亡率升高(Plt;0.05);清达颗粒干预后,降低了SHR 大鼠脑皮质区的凋亡率(Plt;0.05,图3A)。
与WKY组比较,SHR组的Bcl-2 蛋白表达降低,Bax 及cleaved caspase-3 蛋白表达升高(Plt;0.05)。与SHR 组比较,清达颗粒干预后增加了Bcl-2 蛋白表达,减少了Bax 及cleaved caspase-3 蛋白表达(Plt;0.05,图3B)。
2.4 清达颗粒对SHR大鼠脑皮质区miR-124/STAT3信号轴的影响
与WKY组比较,SHR 组miR-124 的mRNA表达下降,STAT3 的mRNA表达升高(Plt;0.05)。与SHR组比较,清达颗粒干预后升高了miR-124的mRNA表达,下调了STAT3的mRNA表达(Plt;0.05,图4A)。
与WKY组比较,SHR组STAT3的蛋白表达显著升高,清达颗粒干预后SHR大鼠脑皮质区STAT3的蛋白表达下降(Plt;0.05,图4B)。
2.5 清达颗粒对OGD/R诱导的HT22细胞活力的影响
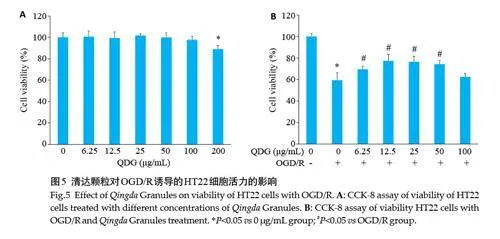
与对照组比较,清达颗粒在6.25、12.5、25、50、100 μg/mL浓度时,对HT22细胞活力没有影响(图5A)。
与对照组比较,OGD/R 组的细胞活力下降(Plt;0.05);与OGD/R 组比较,清达颗粒在6.25、12.5、25、50 μg/mL浓度下,增加OGD/R诱导的HT22 细胞活力(Plt;0.05),且12.5 μg/mL时效果较好,因此采用该剂量进行后续实验(图5B)。
2.6 清达颗粒对OGD/R诱导的HT22 细胞凋亡及其相关蛋白的影响
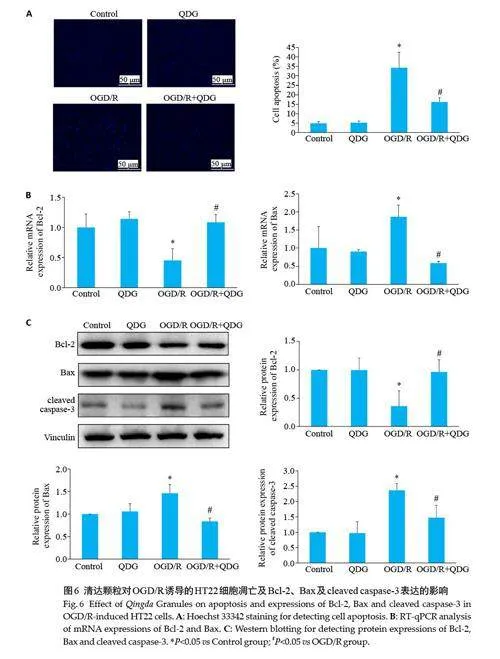
与对照组比较,QDG单独给药组的凋亡率差异无统计学意义(Pgt;0.05),OGD/R 组的凋亡率升高(Plt;0.05);与OGD/R组比较,清达颗粒干预后能降低细胞的凋亡率(Plt;0.05,图6A)。
与对照组比较,QDG单独给药组Bcl-2 和Bax 的mRNA 表达差异无统计学意义(Pgt;0.05),OGD/R 组Bcl-2 的mRNA 表达降低,Bax 的mRNA 表达升高(Plt;0.05);清达颗粒干预后,能升高Bcl-2 的mRNA表达,降低Bax的mRNA表达(Plt;0.05,图6B)。
与对照组比较,QDG 单独给药组Bcl-2、Bax 和cleaved caspase-3 的蛋白表达差异无统计学意义(Pgt;0.05),OGD/R 组Bcl-2 的蛋白表达降低,Bax、cleaved caspase-3 的蛋白表达升高(Plt;0.05);清达颗粒干预后,能显著升高Bcl-2 的蛋白表达,降低Bax、cleaved caspase-3的蛋白表达(Plt;0.05,图6C)。
2.7 清达颗粒对OGD/R诱导的HT22 细胞中miR-124/STAT3信号轴的影响
与对照组比较,QDG单独给药组miR-124、STAT3的mRNA表达差异无统计学意义(Pgt;0.05),OGD/R组miR-124 的mRNA表达下降、STAT3 的mRNA表达升高(Plt;0.05);与OGD/R组比较,清达颗粒干预后能升高miR-124 的mRNA 表达,降低STAT3 的mRNA 表达(Plt;0.05,图7A)。
与对照组比较,QDG单独给药组STAT3的蛋白表达差异无统计学意义(Pgt;0.05),OGD/R组STAT3的蛋白表达升高(Plt;0.05);与OGD/R组比较,清达颗粒干预后能降低STAT3的蛋白表达(Plt;0.05,图7B)。
3 讨论
高血压由多种神经-体液调节机制共同参与,长期血压升高会对心、脑、肾等主要靶器官造成严重损害,其中大脑是高血压引起靶器官损伤的早期目标[20]。研究表明,在40~69岁,收缩压/舒张压升高20 mmHg/10 mmHg,中风死亡风险会增加2 倍以上[21]。但目前针对单一靶点、单一途径,以降压为主的药物无法达到有效彻底治疗高血压以及其所引起的靶器官损伤的目的。而中医“未病先防、既病防变、已变防衰”的防治策略,在高血压的预防、治疗、康复等不同阶段均可发挥作用,其强调整体观、辨证论治理念,更有助于改善高血压临床症状,降低心血管总体风险[22, 23]。
本研究所采用的中药复方清达颗粒是陈可冀院士70 余年的临床经验方清眩降压汤精简化裁而来,由天麻、钩藤、黄芩、莲子心四味药组成,方中以天麻为君药,具有熄风定惊的功效,钩藤为臣,助君药平肝、熄风,佐以黄芩清肝泻火,辅以莲子心清心热、平肝热,全方共奏清肝热、泻心火、舒达肝气之功效,主治高血压肝阳上亢所致的头晕、头痛、烦躁、失眠等[11]。本研究以SHR大鼠作为研究对象,发现清达颗粒能显著降低SHR大鼠的收缩压、舒张压及平均动脉压的升高,这与本研究团队前期的动物研究[13, 24]结果一致。本研究团队既往一项多中心RCT临床研究也表明:清达颗粒治疗高血压患者的临床疗效显著,在治疗4周、及停药4周后,患者的收缩压、舒张压均显著下降,进一步证实了清达颗粒具有良好的降压疗效;同时,该临床实验还发现清达颗粒能改善患者头痛、眩晕等临床症状[12],为清达颗粒可能对高血压所致的脑损伤具有一定的保护作用奠定了前期研究基础。本研究在此基础上,在动物水平上进一步探讨清达颗粒减轻高血压所致脑损伤的药效作用机制。
受高血压影响,SHR大鼠脑组织形态会逐渐发生病理改变,其脑组织的病理性改变主要涉及与学习记忆密切相关的皮质区[25]。而且随着月龄增加,SHR大鼠皮质体积逐步下降,且神经元出现明显凋亡与坏死[26, 27]。本研究前期以MCAO/R大鼠作为研究模型,发现清达颗粒能通过调控lncRNA GAS5/miR-137信号轴减轻神经元的凋亡,以及调控TLR4/NF-κB/NLRP3 信号通路抑制小胶质细胞介导的炎症应答,从而降低MCAO/R大鼠的脑梗死体积,减轻神经功能障碍,对MCAO/R大鼠的脑损伤起一定的保护作用[17, 19]。因此,本研究推测清达颗粒也可能通过调控神经元凋亡的途径减轻SHR大鼠的脑损伤。本研究选取SHR大鼠的脑皮质区进行病理观察,结果发现SHR大鼠的脑皮质区神经元出现了明显的固缩、数量减少等现象,而清达颗粒能显著改善SHR 大鼠脑皮质区的这些病理改变。NeuN表达检测及TUNEL 实验进一步发现清达颗粒能够抑制SHR 大鼠脑皮质区神经元细胞凋亡,增加神经元数量。同时检测凋亡相关的蛋白发现,清达颗粒能显著升高SHR 大鼠脑皮质区及OGD/R 诱导的神经元细胞HT22 中的Bcl-2 表达,降低Bax 和cleaved caspase-3 表达,从而对SHR 大鼠的脑损伤起到一定的保护作用,这与前期基础及设想一致,但清达颗粒的药效作用机制仍需进一步探讨。
MiRNAs通过负调控下游靶基因的表达,介导了细胞的多种生物学功能,其异常表达与脑损伤密切相关[28, 29]。具有脑组织特异性的miR-124,在大脑皮层中高度表达,参与了大脑发育过程。MiR-124也可通过靶向调控神经退行性疾病相关蛋白或通路,参与神经退行性疾病的发生发展,如miR-124通过调控Aβ积累量,抑制Tau 蛋白磷酸化,减少神经炎症反应,在阿尔茨海默病中发挥正向保护作用[30]。在MCAO大鼠的脑组织中,miR-124也呈现显著低表达;将miRNA-124的激动剂注入大鼠脑室,能抑制神经元凋亡,从而显著降低脑梗死体积、脑含水量及神经功能损伤[31]。上述研究表明,miR-124参与调控了脑损伤的发生发展过程。本研究发现,在SHR大鼠的脑皮质组织中miR-124 的表达显著低于WKY大鼠。既往研究表明,在卒中型自发性高血压(SHR-SP)大鼠的脑损伤过程中,miR-124 发挥了重要的保护作用;与WKY大鼠相比,SHR-SP大鼠脑组织中的miR-124 表达显著降低[32]。这与本研究的结果一致。同样,本研究发现在OGD/R诱导下,HT22细胞中的miR-124表达显著降低。已有研究发现OGD/R能显著降低PC12细胞中miR-124表达,从而诱导细胞氧化损伤及凋亡[33],这与本研究结果一致。而清达颗粒干预后则能显著升高SHR大鼠脑皮质区miR-124表达及OGD/R诱导下HT22细胞中miR-124表达,这表明增加 miR-124 的表达可能是清达颗粒对 SHR大鼠发挥脑保护作用的机制之一。
STAT3是重要的信号转导和转录激活因子,参与了细胞的凋亡、自噬、极化等多种生物学过程[34-36],且与脑损伤密切相关,如抑制STAT3的表达,可减轻新生儿缺氧缺血性脑损伤[37];侧脑室注射STAT3抑制剂能显著改善蛛网膜下腔出血导致的早期脑损伤,其作用途径与STAT3 介导的神经元焦亡有关[38]。研究证实miR-124是STAT3的上游,其通过直接与 STAT3的3'-UTR结合来抑制STAT3 信号转导[39],如miR-124 通过直接靶向STAT3,减轻神经元的氧化应激、凋亡及线粒体损伤,从而抑制脑卒中大鼠的脑梗死体积及脑水肿,并改善神经功能[8]。因此,本研究进一步检测了STAT3 的表达,发现在SHR大鼠的脑皮质组织中及OGD/R诱导下HT22细胞中的STAT3表达均明显上升。这与上述研究报道一致。但在细胞水平上也有研究表明,OGD/R诱导下脑细胞(如脑微血管内皮细胞、神经元等)中的STAT3的改变主要是发生在蛋白的磷酸化水平[40, 41]。这可能与OGD/R造模干预时间以及条件不一致有关。进一步研究发现清达颗粒干预后则能逆转这一现象,说明清达颗粒可能通过调控miR-124/STAT3信号轴减轻SHR大鼠的脑损伤,但清达颗粒是否直接靶向miR-124/STAT3信号轴,需要进一步研究探讨。
综上所述,清达颗粒能有效减轻SHR大鼠的脑损伤,其作用机制可能是通过调控miR-124/STAT3 信号轴进而抑制神经元凋亡。本研究从表观遗传学层面丰富了清达颗粒治疗高血压脑损伤的作用机制,为其临床抗高血压应用提供更了多实验依据。
参考文献:
[1] Mills KT, Bundy JD, Kelly TN, et al. Global disparities of
hypertension prevalence and control: a systematic analysis of
population-based studies from 90 countries[J]. Circulation, 2016,
134(6): 441-50.
[2] Wang ZW, Chen Z, Zhang LF, et al. Status of hypertension in China:
results from the China hypertension survey, 2012-2015[J].
Circulation, 2018, 137(22): 2344-56.
[3] India State-Level Disease Burden Initiative Collaborators. Nations
within a nation: variations in epidemiological transition across the
states of India, 1990-2016 in the Global Burden of Disease Study
[J]. Lancet, 2017, 390(10111): 2437-60.
[4] Ruan Z, Lu Q, Wang JE, et al. MIF promotes neurodegeneration and
cell death via its nuclease activity following traumatic brain injury
[J]. Cell Mol Life Sci, 2021, 79(1): 39.
[5] Srinivasan S, Treacy R, Herrero T, et al. Discovery and verification
of extracellular miRNA biomarkers for non-invasive prediction of
pre-eclampsia in asymptomatic women[J]. Cell Rep Med, 2020, 1
(2): 100013.
[6] Sotomayor-Flores C, Rivera-Mejías P, Vásquez-Trincado C, et al.
Angiotensin‑(1-9) prevents cardiomyocyte hypertrophy by
controlling mitochondrial dynamics via miR-129-3p/PKIA pathway
[J]. Cell Death Differ, 2020, 27(9): 2586-604.
[7] Mishima T, Mizuguchi Y, Kawahigashi Y, et al. RT-PCR-based
analysis of microRNA (miR-1 and-124) expression in mouse CNS
[J]. Brain Res, 2007, 1131(1): 37-43.
[8] Geng JQ, Feng JP, Ke FZ, et al. MicroRNA-124 negatively regulates
STAT3 to alleviate hypoxic-ischemic brain damage by inhibiting
oxidative stress[J]. Aging, 2024, 16(3): 2828-47.
[9] Angelopoulou E, Paudel YN, Piperi C. MiR-124 and Parkinson's
disease: a biomarker with therapeutic potential[J]. Pharmacol Res,
2019, 150: 104515.
[10]Sun H, Li JJ, Feng ZR, et al. MicroRNA-124 regulates cell
pyroptosis during cerebral ischemia-reperfusion injury by regulating
STAT3[J]. Exp Ther Med, 2020, 20(6): 227.
[11]陈晓萍, 程 瑛, 刘慧馨, 等. 基于代谢组学研究清达颗粒减轻高血压
所致心脏损伤的生物学机制[J]. 中国中医基础医学杂志, 2023, 29
(1): 79-85, 182.
[12]Qu H, Shen AL, Yang K, et al. Efficacy and safety of Qingda
Granule versus valsartan capsule in Chinese grade 1 hypertensive
patients with low-moderate risk: a randomized, double-blind, double
dummy, non-inferiority, multi-center trial[J]. Pharmacol Res, 2024,
200: 107052.
[13]Wu XY, Shen AL, Bao LY, et al. Qingda granules attenuate
hypertensive cardiac remodeling and inflammation in spontaneously
hypertensive rats[J]. Biomed Pharmacother, 2020, 129: 110367.
[14]Wu MZ, Zhang SY, Zhang WQ, et al. Qingda granule ameliorates
vascular remodeling and phenotypic transformation of adventitial
fibroblasts via suppressing the TGF‑β1/Smad2/3 pathway[J]. J
Ethnopharmacol, 2023, 313: 116535.
[15]Chen XP, Long LZ, Cheng Y, et al. Qingda granule attenuates
cardiac fibrosis via suppression of the TGF‑β1/Smad2/3 signaling
pathway in vitro and in vivo[J]. Biomed Pharmacother, 2021, 137:
111318.
[16]Chen DX, Long LZ, Lin S, et al. Qingda granule alleviate
angiotensin ⅱ -induced hypertensive renal injury by suppressing
oxidative stress and inflammation through NOX1 and NF‑κB
pathways[J]. Biomed Pharmacother, 2022, 153: 113407.
[17]Zhang L, Cai QY, Lin S, et al. Qingda granule exerts neuroprotective
effects against ischemia/reperfusion-induced cerebral injury via
lncRNA GAS5/miR-137 signaling pathway[J]. Int J Med Sci, 2021,
18(7): 1687-98.
[18]叶任之, 张 铃, 蔡巧燕, 等. 基于p38MAPK/Nrf2/HO-1通路探讨清
达颗粒对脂多糖诱导活化的小胶质细胞抗氧化作用研究[J]. 中西
医结合心脑血管病杂志, 2020, 18(11): 1700-6.
[19]Cai QY, Zhao CY, Xu YY, et al. Qingda granule alleviates cerebral
ischemia/reperfusion injury by inhibiting TLR4/NF‑κB/NLRP3
signaling in microglia[J]. J Ethnopharmacol, 2024, 324: 117712.
[20]Kelly DM, Rothwell PM. Blood pressure and the brain: the
neurology of hypertension[J]. Pract Neurol, 2020, 20(2): 100-8.
[21]Lewington S, Clarke R, Qizilbash N, et al. Age-specific relevance of
usual blood pressure to vascular mortality: a meta-analysis of
individual data for one million adults in 61 prospective studies[J].
Lancet, 2002, 360(9349): 1903-13.
[22]Li J. Traditional Chinese medicine in treating hypertension[J]. Circ
Cardiovasc Qual Outcomes, 2022, 15(3): e008723.
[23]Wang MX, Wu CJ, Cao PH, et al. Meta-analysis for clinical efficacy
of traditional Chinese medicine in treating resistant hypertension
[J]. Chin J Chin Mater Med, 2021, 46(3): 685-93.
[24]Cheng Y, Shen AL, Wu XY, et al. Qingda granule attenuates
angiotensin II-induced cardiac hypertrophy and apoptosis and
modulates the PI3K/AKT pathway[J]. Biomedecine Pharmacother,
2021, 133: 111022.
[25]Tajima A, Hans FJ, Livingstone D, et al. Smaller local brain volumes
and cerebral atrophy in spontaneously hypertensive rats[J].
Hypertension, 1993, 21(1): 105-11.
[26]Pires PW, Dams Ramos CM, Matin N, et al. The effects of
hypertension on the cerebral circulation[J]. Am J Physiol Heart Circ
Physiol, 2013, 304(12): H1598-614.
[27]Hsieh MH, Cui ZY, Yang AL, et al. Cerebral cortex apoptosis in
early aged hypertension: effects of epigallocatechin-3-gallate[J].
Front Aging Neurosci, 2021, 13: 705304.
[28]Yang LJ, Cui H, Cao T. Negative regulation of miRNA-9 on
oligodendrocyte lineage gene 1 during hypoxic-ischemic brain
damage[J]. Neural Regen Res, 2014, 9(5): 513-8.
[29]Vinciguerra A, Formisano L, Cerullo P, et al. MicroRNA-103-1
selectively downregulates brain NCX1 and its inhibition by antimiRNA
ameliorates stroke damage and neurological deficits[J].
Mol Ther, 2014, 22(10): 1829-38.
[30]耿佳庆, 方成志, 张丙宏. MicroRNA-124在神经系统中的研究进展
[J]. 武汉大学学报(医学版), 2024, 45(11): 1403-9.
[31]职 瑾, 段 斌, 王 静, 等. MiR-124与MAPK/ERK通路对调节脑梗
死大鼠神经细胞凋亡的影响[J]. 现代生物医学进展, 2021, 21(12):
2235-40.
[32]Matsuoka H, Tamura A, Kinehara M, et al. Levels of tight junction
protein CLDND1 are regulated by microRNA-124 in the cerebellum
of stroke-prone spontaneously hypertensive rats[J]. Biochem
Biophys Res Commun, 2018, 498(4): 817-23.
[33]Shu K, Zhang YL. Protodioscin protects PC12 cells against oxygen
and glucose deprivation-induced injury through miR-124/AKT/Nrf2
pathway[J]. Cell Stress Chaperones, 2019, 24(6): 1091-9.
[34]Fathi N, Rashidi G, Khodadadi A, et al. STAT3 and apoptosis
challenges in cancer[J]. Int J Biol Macromol, 2018, 117: 993-1001.
[35]You LK, Wang ZG, Li HS, et al. The role of STAT3 in autophagy[J].
Autophagy, 2015, 11(5): 729-39.
[36]Xia TT, Zhang M, Lei W, et al. Advances in the role of STAT3 in
macrophage polarization[J]. Front Immunol, 2023, 14: 1160719.
[37]Hristova M, Rocha-Ferreira E, Fontana X, et al. Inhibition of Signal
Transducer and Activator of Transcription 3 (STAT3) reduces
neonatal hypoxic-ischaemic brain damage[J]. J Neurochem, 2016,
136(5): 981-94.
[38]Tang SJ, Lai NS, Xu L. Neuronal pyroptosis mediated by STAT3 in
early brain injury after subarachnoid hemorrhage[J]. Brain Res,
2024, 1822: 148666.
[39]Wei J, Wang F, Kong LY, et al. MiR-124 inhibits STAT3 signaling to
enhance T cell-mediated immune clearance of glioma[J]. Cancer
Res, 2013, 73(13): 3913-26.
[40]龚翠兰, 马 强, 杨仁义, 等. 基于JAK2/STAT3通路探讨活血荣络方
对OGD/R后BMEC的干预作用及机制[J]. 湖南中医药大学学报,
2024, 44(3): 350-6.
[41]弋海群, 谢 娟, 张象霞, 等. 蛇葡萄素通过调节JAK2/STAT3信号通
路减轻OGD/R诱导的神经元损伤[J]. 国际检验医学杂志, 2024, 45
(1): 89-94.
(编辑:郎 朗)