恙虫病致颅内感染1例报告


【关键词】" 病原捕获宏基因组学检测;恙虫病颅内感染;误诊漏诊
中图分类号" R513.2" "文献标识码" A" " 文章编号" 1671-0223(2025)02--04
恙虫病(tsutsugamushi disease)又名丛林斑疹伤寒,是由恙虫病立克次体引起的急性传染病。感染后的临床表现多样,包括发热、肝脾肿大、淋巴结肿大、焦痂或皮肤溃疡等,可累及全身多个脏器,若治疗不及时,可导致多脏器出现功能衰竭,甚至死亡。当前,全世界超过10亿人口有被恙虫病立克次体感染的风险,每年新增病例可达到100万例。这一严峻的公共卫生问题主要集中在亚洲及太平洋西岸的“恙虫病三角”地带[1]。我国是恙虫病的主要流行地区之一,主要发生在东南沿海各省及西南地区。恙虫病患者的临床症状多样,这使得疾病的诊断非常容易被忽视或误判。即便接受了治疗,患者的病死率仍然达到1.4%[2]。相比之下,未接受治疗的患者病死率可上升至6.0%[3],若并发中枢神经系统感染,病死率更是高达14.0%[4]。恙虫病的中枢神经系统感染并发症不仅增加了患者的治疗难度,也显著提高了病死率。因此,对于恙虫病的早期诊断和及时治疗显得尤为重要。有研究调查显示,在韩国,恙虫病感染的患者中合并有中枢神经系统感染的约占10.0%[5],而在恙虫病高发地区,这一比例可高达25.0%[6]。甘肃地区鲜有报道,容易造成漏诊误诊,且传统的培养方法难以得到有价值结果。因此,早期识别恙虫病并发中枢神经系统感染的症状,如发热、头痛、呕吐等,并迅速采取有效的治疗措施,对于改善患者的预后具有至关重要的作用。本文报告1例表现为头痛、寒战、高热被诊断为病毒性脑炎、肺部感染的患者,经病原捕获宏基因组学检测(IDseqTMUItra)检出恙虫病东方体而确诊,为诊治该类疾病提供参考。
1" 病历资料
女性,66岁,汉族,主因“头痛、寒战、发热5天”于 2022年6月12日入院。2022年6月7日22时无明显诱因出现头痛,呈针刺样阵发性发作,以头顶部为主,尚可忍受。有寒战、发热、全身酸痛,体温最高达39℃。伴恶心、呕吐,呕吐次数不详,呕吐物为所进食物。来医院就诊后,行腰椎穿刺术,提示颅内压高于正常,查脑脊液常规示白细胞计数、单核细胞百分比升高。脑脊液生化示白蛋白、氯升高。诊断:肺部感染、病毒性脑炎、结核性脑炎。予以抗感染、抗病毒、脱水治疗4天,患者头痛减轻,但仍有寒战、高热,体温最高达40℃,并出现咳嗽、咳白色黏痰。遂来医院就诊,急诊以“肺部感染、脑膜炎”收住入院。
1.1" 查体
体温40℃,脉搏105次/分,呼吸22次/分,血压150/83mmHg。意识呈嗜睡。颈抵抗,下颌距胸前壁3横指。两肺呼吸音粗,双下肺可闻及散在湿性啰音。心律齐,心脏各瓣膜听诊区未闻及明显病理性杂音。右臀部可见直径约1.0cm皮肤溃疡,深及皮下组织。见图1。
1.2" 辅助检查" 胸部CT平扫示两肺小叶间隔增厚,考虑间质性肺水肿。两肺多发片状密度增高影,考虑感染。两侧胸腔少量积液,见图2。头颅CT平扫未见异常改变,见图3。血常规示中性粒细胞百分比86.3%。降钙素原2.12ng/ml。动脉血气示:吸入气中的氧浓度分数(FiO2)60%,脑脊液氧分压(PO2)47mmHg,二氧化碳分压(PCO2) 29.3mmHg,氧合指数为78.32mmHg。腰椎穿刺见脑脊液无色清亮、无凝块,压力180mmH2O。脑脊液常规:白细胞计数10×106/L,蛋白定性阳性;脑脊液生化:糖2.83mmol/L、氯120.6mmol/L、蛋白950.0mg/L。同时脑脊液送病原捕获宏基因组学检测。
2" 结果
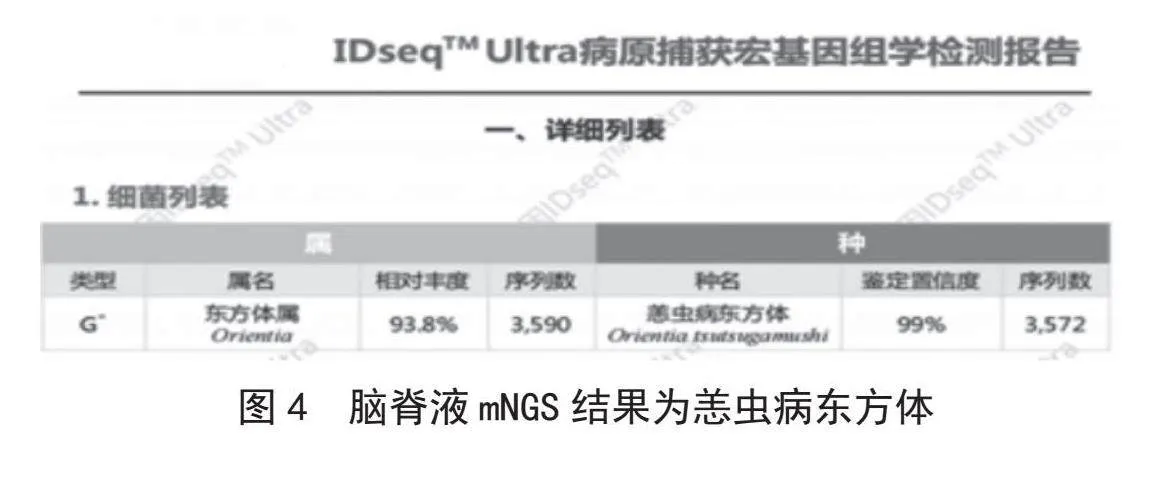
入院时查降钙素原明显升高,结合胸部CT检查,考虑存在细菌感染,予以注射用美罗培南(1g,1/8h)经验性抗感染治疗,并辅以人工气道、机械辅助呼吸、镇静镇痛、扩张支气管、化痰、纠正低蛋白血症、胃肠内营养支持等综合治疗。45h后病原捕获宏基因组学检测结果回报示恙虫病东方体,见图4。即给予盐酸多西环素肠溶胶囊(0.1g,1/12h)抗感染治疗。给药24h后体温峰值逐渐下降,72h体温降至正常。但患者肺功能恢复缓慢,一度曾出现多脏器功能不全、意识障碍加重至浅昏迷。经积极治疗,于第13天脱呼吸机,改为高频湿化给氧,意识由浅昏迷转为嗜睡。第14天停美罗培南抗感染治疗,第19天拔除气管套管。共住院23天,出院时患者意识清,精神、饮食、睡眠可,二便正常。动脉血气示FiO221%,PO266.5mmHg,乳酸(Lac)2.2mmol/L,氧合指数为316.43mmHg。
3" 讨论
恙虫病是由恙虫病立克次体引起的急性自然疫源性传染病,是啮齿类动物为主要传染源,恙螨幼虫寄生在这些啮齿动物的体表,通过叮咬人类将病原体传播[7]。恙虫病的分布范围广泛,多发生于亚洲太平洋地区,其中以东南亚为主要流行区。在我国,主要分布于北纬40度以南的东南、西南地区以及沿海岛屿[8]。该病具有显著的季节性特征,在我国南方省份及城市,恙虫病的高峰期主要集中在6-8月,多与降雨集中引发地面恙螨的广泛扩散有关。北方地区该病的高发期主要集中在9-12月、以10月为流行高峰,这与当地鼠类种群密度的上升有关[9]。在1985年之前,恙虫病在我国仅限于长江以南地区。随后,疫区逐渐蔓延至长江以北。近年来,恙虫病在我国众多省份和地区的发病率呈现上升趋势。在2006-2016年的十年间,恙虫病的发病县(区)数量激增了3.15倍,而病例数更是增长了15.41倍[10]。
恙虫病立克次体在死亡后所释放的毒素,是引发全身性毒血症和多器官病变的关键因素,其基本病理改变涉及全身性微血管炎症、血管周围炎症以及网状内皮细胞的增生,最终导致多器官损伤[11]。患者常以急性发热为首发症状,伴有剧烈头痛、背部疼痛、大量出汗和频繁呕吐等不适。在恙螨幼虫的咬伤区域,患者可能会表现出特有的焦痂或溃疡,伴随皮疹、淋巴结肿胀以及肝脾肿大等症状。焦痂和溃疡是恙虫病的典型临床体征。当恙螨侵袭人体后,起初会在皮肤上形成粉红色的丘疹,随后这些丘疹发展为水疱。当这些水疱破裂后,皮肤组织坏死,最终形成黑褐色的焦痂。随着焦痂的脱落,相应部位会形成溃疡[12]。腋窝、腹股沟、会阴等潮湿区域是患者出现焦痂或溃疡的主要部位。然而,也有少数病例发生部位较为隐蔽,甚至可能不出现典型的焦痂或溃疡[13]。在本次病例中,该患者在右臀部发现了一处皮肤溃疡。
恙虫病实验室诊断的主要手段是血清学检测,其检测对象为血液中的恙虫病东方体(Ot)的抗原或抗体。检测方法包括:①外斐试验(weil-felix test,WFT),患者血清中的Ot抗体与恙虫病立克次体具有共同抗原的变形杆菌OXk株发生凝集反应,为确诊恙虫病立克次体感染提供依据。尽管在检测的敏感性和特异性方面有所欠缺,它依然因其易于操作、经济实惠以及对技术要求不高而受到青睐,成为发展中国家确诊恙虫病的首选方法[14]。②免疫荧光抗体试验,它运用荧光素标记的抗体或抗原与组织或细胞中的相应抗原或抗体特异性结合,以实现定性检测。该技术在Ot的早期诊断以及流行病学研究中具有重要应用价值[15]。③免疫酶染色法,其与免疫荧光技术具有相似之处,但其独特之处在于使用酶染料代替了荧光染料,可以通过普通的光学显微镜进行观察,因此常应用于基层实验室。④酶联免疫吸附试验(ELISA),此方法的原理为利用高度特异性的免疫反应与高度敏感性的酶促反应的结合,对血清中Ot的IgG和IgM抗体进行检测。该检测方法灵敏度高、操作简便且经济实惠[16]。⑤补体结合试验,该试验阳性率较高,特异性较强,且持续阳性结果时间较长,可达5年左右。因不同Ot株的抗原性可有明显差异,建议使用当地多见菌株作为抗原或使用多价抗原进行检测。⑥斑点酶免疫测定技术,是用各种血清型的Ot或部分蛋白质为抗原,吸附至硝酸纤维膜上,进行斑点酶免疫测定,可检测血清中特异性的IgG和IgM抗体。该方法具有高敏感性和强特异性,能够有效区分Ot的不同血清型[17]
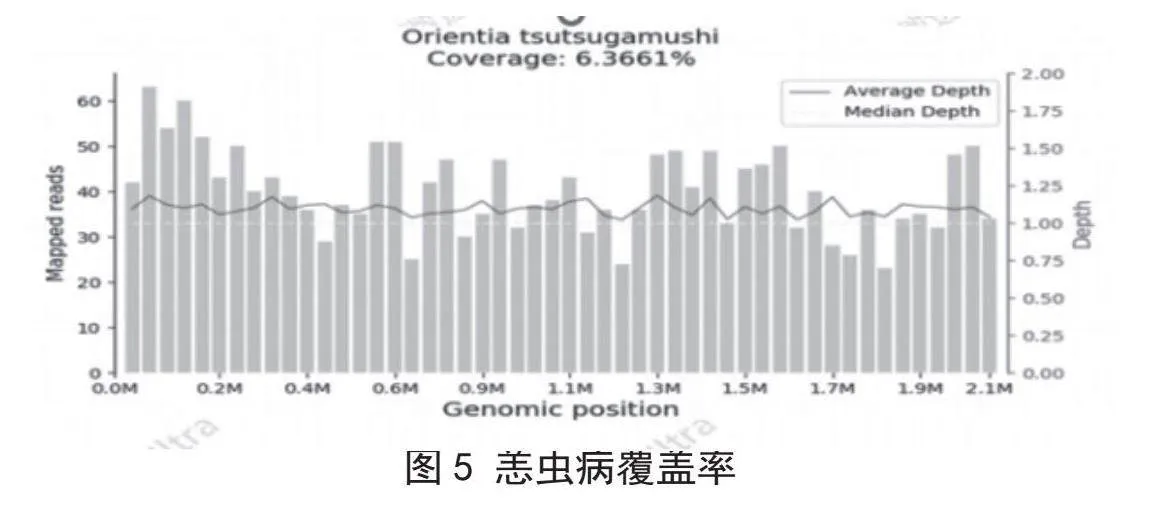
病原捕获宏基因组测序技术(mNGS)是一种不依赖于临床培养的可广泛检测样本中微生物组的高通量测序方法[18],该技术适用于诊断不明原因的发热、复杂且危重的病例以及免疫缺陷患者的感染[19]。在缺乏特征性临床表现的患者中,要找出治病的病原体十分困难,而mNGS技术是一种不依赖于人工培养的微生物基因分析技术,通过从患者标本中分离所有微生物的总DNA,可以全面地覆盖各种病原体,能够检测包括细菌、真菌、病毒等多种病原体。该方法在疑难复杂感染、混合性感染以及新发病原体感染的确诊中发挥重要作用[20]。近年来,已经有研究报道了利用mNGS技术诊断由罕见病原体引起的感染,包括钩端螺旋体脑炎、福氏纳格里阿米巴感染引起的脑膜炎、沙眼衣原体血源性感染以及西尼罗河病毒引起的呼吸道感染等[21-22]。立克次体是一类专性寄生于细胞内的原核细胞性微生物,传统病原微生物培养方法难以获取。由其感染引起的临床症状缺乏典型性,而mNGS在病原学诊断方面具有很高的应用价值。侯婕、纪洪艳、Kondo等[23-25]报道了立克次体引起相关疾病,最后均由mNGS确诊。在上述案例中,经过多西环素治疗后患者病情均有明显改善。结合治疗效果亦证实了致病菌为立克次体,表明mNGS诊断立克次体感染的敏感性较高。除了在检测特定病原体方面具有优势外,mNGS相较于以往病原微生物培养方法能够在短时间内提供病原学结果,可尽早对重症感染患者的治疗给出指导性意见。大量数据表明,mNGS对于重症感染中病原学的诊断阳性率高于培养,其丰度变化可评估治疗效果和疾病进展[26]。在探究人畜共患性疾病时,mNGS技术能够揭示病原体在动物宿主与人类宿主之间的差异性,这对于跨物种传播的传染性疾病具有非常重要的作用,如恙虫病,见图5。近年来,mNGS已被众多共识和指南推荐用于感染性疾病的检测。但mNGS技术也有其局限性,如检测费用高,微生物污染,基因组数据库不全,采样要求高,微生物污染,而且不同检测平台间测序过程和结果存在较大差异。此病例脑脊液mNGS检测中各项质控流程均为合格,见图6。因此,mNGS 目前不被视为常规的病原学检测手段。对于轻度感染、可通过常规培养方法确诊的感染性疾病,以及人源性细胞和背景菌较多的样本,通常不建议采用mNGS检测[27]。
综上,恙虫病发病范围扩大,发病率逐年上升,甘肃地区少见,因其临床表现不典型,常规实验室检查不易获得病原学结果,容易造成误诊或漏诊。本病例初始被误诊为病毒性脑炎,传统病原学培养阴性的情况下是根据mNGS 结果明确诊断,指导治疗方向。随着mNGS 被越来越多的临床指南或专家共识推荐,现已成为感染性疾病尤其是少见、罕见,甚至疑难病原体感染诊断的利器,而我们在利用其优点的同时也应该严格掌握检测的适应证,避免滥用,增加患者不必要的经济负担[28]。
4" 参考文献
[1] Prakash JAJ.Scrub typhus: Risks, diagnostic issues, and management challenges[J]. Res Rep Trop Med,2017,8:73-83.
[2] Bonell A,Lubell Y,Newton PN,et al.Estimating the burden of scrub typhus:A systematic review[J].PLoS Negl Trop Dis,2017,11:e0005838.
[3] Taylor AJ,Paris DH,Newton PN.A systematic review of mortality from untreated scrub typhus (Orientia tsutsugamushi)[J]. PLoS Negl Trop Dis,2015, 9:e0003971.
[4] Dittrich S,Rattanavong S,Lee SJ, et al.Orientia, rickettsia, and leptospira pathogens as causes of CNSinfections in Laos:A prospective study[J]. Lancet Glob Health,2015, 3:e104-112.
[5] Kim DM,Chung JH,Yun NR,et al.Scrub typhus meningitis or meningoencephalitis[J].Am J Trop Med Hyg,2013,89:1206-1211.
[6] Abhilash KP,Gunasekaran K,Mitra S,et al.Scrub typhus meningitis:An under-recognized cause of aseptic meningitis in India[J].Neurol India, 2015,63(2):209-214.
[7] 洪镭.恙虫病研究进展[J].江苏预防医学,2016,27(2): 176-178.
[8] 谭雪梅,刘园园,雷旭,等.恙虫病基础和临床诊治研究进展[J].中华实验和临床感染病杂志(电子版), 2017,11(5):437-440.
[9] 王铁强,姚云英,黄喜强,等. 2006-2012年广东省恙虫病流行特征分析[J].中华地方病学杂志,2014(4):429-432.
[10] 李柏成,张剑锋.国内恙虫病在不同人群中发病及诊疗特点的研究进展[J].中华灾害救援医学,2018,6:711-717.
[11] 林苗苗,何时军.恙虫病并发噬血细胞综合征五例分析[J].中华传染病杂志,2015(6):358-360.
[12] 孙鹏超.口服利福平治疗婴幼儿恙虫病分析[J].医学信息,2017,30(17):108-109.
[13] Wilson, M. R.Actionable diagnosis of neuroleptospirosis by next-generation sequencing[J].The New England journal of Medicine,2014,370(25):2408-2417.
[14] Parize, P.Untargeted next-generation sequencing-based first-line diagnosis of infection in immunocompromised adults:A multicentre, blinded, prospective study[J]. Clinical Microbiology and Infection:The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases,2017, 23(8):574-574.
[15] 张自优. 61例恙虫病患者临床及血液学特征分析[D].大理:大理学院,2014.
[16] 刘晓宁,陈振,刘伯玉,等.阜阳市2015 年恙虫病实验诊断及IgG 持续时间探索[J].安徽医科大学学报,2019,54(11):1828-1831.
[17] 赖延东,郑小英,李秀英,等.恙虫病东方体Karp 株56kD表膜蛋白基因的表达及免疫诊断应用研究[J].中国人兽共患病学报,2004,20(10):829-832.
[18] 吕燕宁,陈丽娟,窦相峰,等.北京市远郊区恙虫病血清流行病学调查[J].中国媒介生物学及控制杂志,2016,27(3):50-52.
[19] 江苏省医学会检验学分会,江苏省临床检验中心.宏基因组测序技术检测感染性病原体江苏专家共识(2020 版)[J].临床检验杂志,2020,38(9):641-645.
[20] Wilson M R,Shanbhag N M,Reid M J,et al. Diagnosing Balamuthia mandrillaris encephalitis with metagenomic deep sequencing[J]. Ann Neurol,2015, 78(5):722-730.
[21] Fung M,Zompi S,Seng H,et al. Plasma cell-free DNA next-generation sequencing to diagnose and monitor infections in allogeneic hematopoietic stem cell transplant patients[J]. Open Forum Infect Dis,2018,5(12):ofy301.
[22] 侯婕,李园园,胡成平,等.二代测序协助诊断恙虫病立克次体肺炎一例[J].中华结核和呼吸杂志,2019,42(7):546-548.
[23] 纪洪艳,王国平,郭切,等.应用宏基因组二代测序方法确诊的Q热心内膜炎一例[J].中华内科杂志,2021,60(3):247-248.
[24] Kondo M,Dalai S C,Venkatasubrahmanyam S,et al.Diagnosis and genotyping of coxiella burnetii endocarditis in a patient with prosthetic pulmonary valve replacement using next-generation sequencing of plasma microbial cell-free DNA[J]. Open Forum Infect Dis,2019,6(6):ofz242.
[25] Stafford I A,Centeno F H,Almohajer M,et al.Successful detection of unrecognized rickettsia typhi in pregnancy using cell-free next-generation sequencing[J]. Case Rep Obstet Gynecol,2020:6767351.
[26] Grumaz S,Stevens P,Grumaz C,et al.Nextgeneration sequencing diagnostics of bacteremia in septic patients[J]. Genome Med,2016,8(1):73.
[27] 戴媛媛,马筱玲.宏基因组二代测序技术在临床病原学诊断中的应用[J].临床检验杂志,2021,39(1):1-5.
[28] 梁瑶,吴祥林,王晓川,等.宏基因组二代测序辅助诊断Q热立克次体肺炎 1 例[J].中国感染与化疗杂志,2022,22(1):91-94.
[2024-06-07收稿]

