大球盖菇多肽的制备、抗氧化及抗肿瘤活性的研究


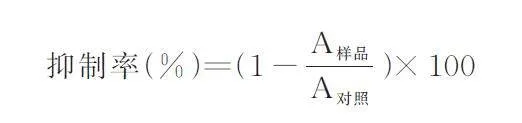
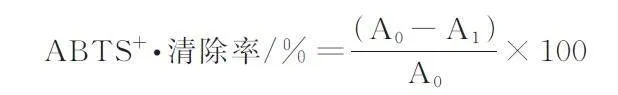

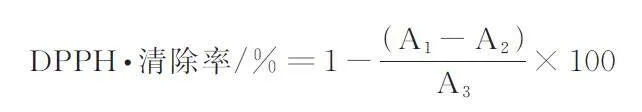
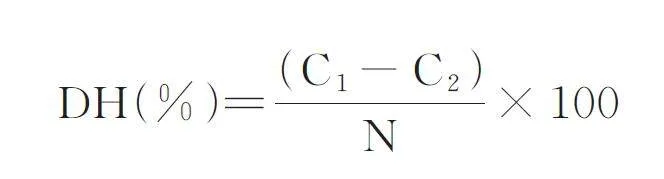
摘要:[目的]大球盖菇作为近年来在我国迅速崛起的食用菌,以其卓越的营养价值和多样的保健功效受到市场的青睐。然而,尽管其产量迅猛增长,深度加工技术的滞后和创新产品开发的不足已成为制约大球盖菇产业发展的关键因素。因此,本研究旨在优化大球盖菇多肽的制备工艺,并评价其体外抗氧化和抗肿瘤活性,为大球盖菇的深度加工和产品创新提供科学依据。[方法]以蛋白水解度为评价指标,在蛋白酶筛选的基础上,通过单因素和正交试验获得大球盖菇多肽的最佳制备工艺,并通过超滤分级纯化获得3 个多肽组分(M1:gt;10 kDa、M2:3~10 kDa、M3:lt;3 kDa);通过DPPH·和ABTS+·清除率的测定评价多肽体外抗氧化活性。通过常见肿瘤细胞增殖抑制率的测定评价多肽抗肿瘤活性。[结果]胰蛋白酶酶解制备大球盖菇多肽的最佳工艺为料液比1∶20 g/mL、酶添加量4000 U/g、酶解时间3 h,在该条件下大球盖菇蛋白的水解度为28. 31%,比优化前提高了3 倍。所制备的大球盖菇多肽对DPPH·和ABTS+·的清除率最高可达69. 2% 和91. 4%,高于以往相关报道。3 个多肽组分对4 种常见的肿瘤细胞(宫颈癌细胞HeLa、肺癌细胞NCI-H460、乳腺癌细胞BT549、肝癌细胞HepG2)的抑制效果不同,但均呈现浓度依赖性。M1 和M3 对肺癌细胞NCI-H460 的抑制效果最好,而M2 主要抑制宫颈癌细胞HeLa;其中,500 μg/mL M3 对肺癌细胞NCI-H460 的抑制率达30. 28%。[结论]胰蛋白酶酶解制备大球盖菇多肽的工艺优化后,所制备的多肽具有良好的抗氧化活性和抗肿瘤活性。
关键词:大球盖菇; 多肽; 酶解; 自由基清除率; 抗肿瘤活性
中图分类号:TS201.2;S646.9 文献标识码:A 文章编号:1671-8151(2025)01-0123-10
大球盖菇(Stropharia rugosoannulata),又名赤松茸,属于担子菌门,层菌纲,伞菌目,球盖菇科,球盖菇属;口感脆嫩,鲜味浓郁,被冠以“素中之荤”的美称[1-3]。目前,大球盖菇是联合国粮农组织向发展中国家推荐栽培的食用菌之一,也是我国近几年新兴的食用菌,其产量在2010-2021 年间从4. 74 万吨增加到28. 75 万吨[4-5]。尽管大球盖菇的产量迅速增长,但其成熟期的集中性和短贮藏期却带来了新的挑战[6-7]。目前,大球盖菇深度加工技术的滞后和创新产品开发的不足,已成为制约产业发展的关键因素。因此,深入研究并发掘大球盖菇的活性成分,对于推动其深度加工、开发新产品、提升其市场价值具有重要意义[8]。
大球盖菇含有丰富的蛋白和氨基酸,是天然活性肽的优质来源[9-10];目前已有鲜味肽、降血压肽、呈味肽、抗氧化肽等活性肽的相关研究,但未见抗肿瘤活性的相关报道[11-14]。研究发现,抗肿瘤肽往往与抗氧化活性相关,可直接或者间接作用于肿瘤细胞,对肿瘤细胞的生长和凋亡发挥调控作用;与传统治疗药物相比,具有分子量小、高活低毒性、靶向性强、易于跨膜吸收等优点,已成为抗肿瘤相关药物研发的新热点[15-16]。
生物活性肽的制备方法有酶解法、化学水解法及微生物法等。其中,酶解法具有条件温和、安全性高、价低廉、易得到特定活性肽等优点,已被广泛应用于食用菌多肽的制备,如双孢蘑菇[17]、杏鲍菇[18]、虎奶菇[19]、香菇[20]、灵芝[21]、草菇等[22]。在酶解过程中,蛋白酶的选择至关重要。不同的蛋白酶能够催化产生具有结构和序列各异的多肽片段,这些多肽在产量和生物活性上也表现出显著的差异。因此,筛选出最适合的蛋白酶种类,并针对性地优化酶解条件,是实现高效、高活性多肽制备的关键步骤[23]。
鉴于此,本研究在蛋白酶筛选的基础上,通过单因素和正交试验优化酶解法制备大球盖菇多肽的工艺,并探究其抗氧化和抗肿瘤活性,一方面丰富食用菌活性多肽的数据库,另一方面可为大球盖菇的深度加工和产品创新提供科学依据。
1 材料与方法
1. 1 主要试剂
大球盖菇,市售;宫颈癌细胞HeLa、肺癌细胞NCI-H460、乳腺癌细胞BT549、肝癌细胞HepG2,旗赛生物科技(武汉)有限公司。
碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶、复合蛋白酶,德国Biofroxx 公司;1,1-二苯基苦基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),北京索莱宝科技有限公司;过硫酸钾,上海麦克林生化科技股份有限公司;抗坏血酸(Vc)、乙醇、氢氧化钠、盐酸、四水合酒石酸钾钠、硫酸、硫酸铜、硫酸钾、硼酸、溴甲酚绿、甲基红、蔗糖 分析纯,国药集团化学试剂有限公司;Fetal Bovine Serum,上海恪敏生物科技有限公司;细胞培养皿、细胞培养瓶,NEST 公司;RPMI-1640 基础培养基、DMEM 高糖基础培养基、BT-549 细胞专用培养基、青霉素-链霉素溶液、胰酶细胞消化液、磷酸盐缓冲液、增强型CCK-8 试剂盒,旗赛生物科技(武汉)有限公司。
1. 2 主要仪器与设备
Beta2-8LD 真空冷冻干燥机,德国Christ 公司;202-00AB 台式电热干燥箱,天津市泰斯特仪器有限公司;HH-4 数显恒温水浴锅,上海力辰邦西仪器科技有限公司;ST 2100 台式pH 计,美国奥豪斯公司;Avanti J-E 超速冷冻离心机,美国Beckman公司;L3-5K、H1-16K 台式离心机 湖南可成仪器设备有限公司;SW-CJ-1FDG 超净工作台,LAYTE 公司;恒温培养摇床,金坛市盛蓝仪器制造有限公司;C22. 2NO. 1010. 1 酶标仪,美国BioTek 公司;BPN-150CH(UV) CO2 恒温培养箱,上海一恒科学仪器有限公司;Xinyi-250N 超声波细胞粉碎仪,武汉爱斯佩科学仪器有限公司;XH-SH220F 石墨消解仪,上海昕沪实验设备有限公司;SKD-100 全自动凯氏定氮仪,上海沛欧仪器有限公司。
1. 3 试验方法
1. 3. 1 大球盖菇多肽制备工艺流程
工艺流程简要概括为:洗净、切块→ 真空冷冻干燥→ 粉碎→ 大球盖菇粉→ 总蛋白提取(超声波辅助碱提酸沉法)→多肽制备(酶解法)→上清液→分级纯化(超滤)→冷冻干燥→多肽粉。
1. 3. 2 大球盖菇多肽的制备
将新鲜大球盖菇洗净后,切块,真空冷冻干燥后,粉碎,得到大球盖菇粉。将菇粉配制成料液比为1∶30 g/mL 悬液,根据周宇等[24]方法提取大球盖菇蛋白溶液,先将菇粉悬液的pH 调至10. 0,35 ℃、40% 功率条件下超声10 min,4000 r/min 离心10 min,取上清。再用盐酸将上清液pH 调节至4. 5,静置30 min,4000 r/min 离心10 min,弃上清,沉淀即为大球盖菇蛋白。向蛋白沉淀加入适量蒸馏水,调节pH 至8. 0,添加5000 U/g 蛋白酶,水解2 h。将水解产物于95 ℃灭酶10 min,冷却至室温,4000 r/min 离心10 min,收集上清液即为大球盖菇多肽液。
1. 3. 3 大球盖菇多肽制备工艺的优化
(1) 蛋白酶的筛选
向大球盖菇蛋白溶液分别加入5000 U/g 的碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、胰蛋白酶、复合蛋白酶,按表1 将温度和pH 调节至各酶的理论最适值,以水解度为评价指标,筛选水解大球盖菇蛋白的最佳蛋白酶。
(2) 单因素试验
参照1. 3. 1 方法及蛋白酶筛选结果,以水解度为评价指标,通过单因素试验考察料液比(1∶20、1∶30、1∶40、1∶50、1∶60 g/mL)、酶添加量(3000、4000、5000、6000、7000 U/g)、酶解时间(1、2、3、4、5 h)对大球盖菇蛋白水解的影响。
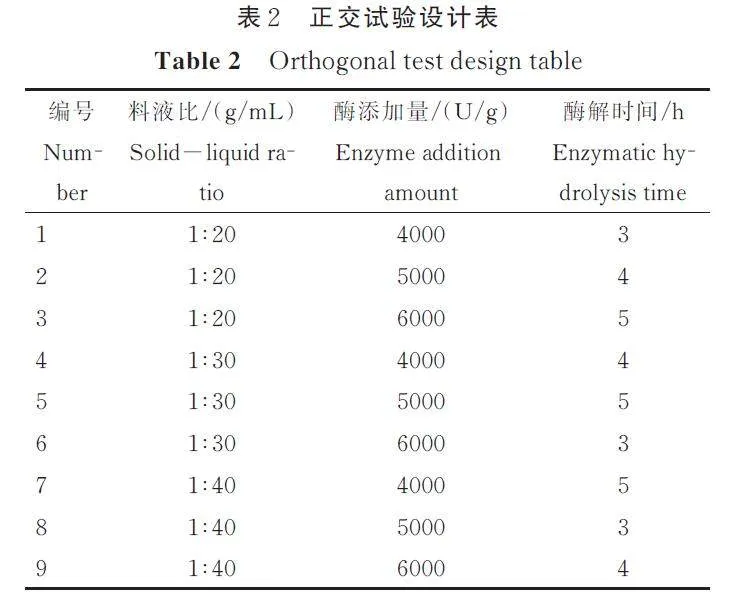
(3) 正交试验
在单因素试验的基础上,确定正交试验的三因素和三水平(表2),以水解度为评价指标,确定大球盖菇多肽的最佳制备工艺。
1. 3. 4 水解度的测定
根据景炳年等[25]和李皖光等[26]方法,采用茚三酮比色法测定水解度。配制一系列浓度梯度的异亮氨酸标准品溶液,制作标准曲线,拟合公式为y=0. 031x-0. 525 2(R2=0. 998 9)。将500 μL 样品、1 mL pH 缓冲液、2 mL 3% 茚三酮乙二醇溶液混合摇匀,95 ℃水浴15 min,冷却,加入5 mL 45%乙醇静置20 min,在568 nm 波长处测定吸光值。通过异亮氨酸回归方程计算异亮氨酸含量,再计算样品中游离氨基酸的含量。根据潘心红等[27]方法,采用凯氏定氮法测定样品的总氮量。水解度计算公式如下:
式中,DH 表示水解度,% ;C1 表示水解后游离氨基酸含量,mg/g;C2 表示水解前游离氨基酸含量,mg/g;N 表示大球盖菇菌粉的总氮量,g/100 g。
1. 3. 5 大球盖菇多肽的分级纯化
将所制备的大球盖菇多肽依次通过截留分子量为10 kDa 和3 kDa 的超滤膜,5000 r/min 离心30 min,收集不同分子量的组分(M1:gt;10 kDa、M2:3~10 kDa、M3:lt;3 kDa),冷冻干燥备用。
1. 3. 6 体外抗氧化活性的测定
(1) DPPH·清除能力的测定
参考庞小一等[28]的方法对不同大球盖菇多肽组分的DPPH·清除能力进行测定。将所制备的大球盖菇多肽和Vc 配成不同质量浓度的样品溶液(0. 5、1. 0、1. 5、2. 0、2. 5、3. 0 mg/mL)。再分别将100 μL 样品溶液与100 μL 0. 1 mg/mL DPPH 溶液混合均匀,37 ℃避光反应30 min,在517 nm 波长处测定吸光度,记录吸光值A1;100 μL 样品溶液与100 μL 无水乙醇混匀,同上方法测定吸光度,记录吸光值A2;100 μL 无水乙醇与100 μL 0. 1 mg/mLDPPH 溶液,同上方法测定吸光度,记录吸光值A3。DPPH·清除率的计算公式如下:
(2) ABTS+·清除能力的测定
参考Latorres 等[29]的方法对不同大球盖菇多肽组分的ABTS+·清除能力进行测定。将所制备的大球盖菇多肽和Vc 配成不同质量浓度的样品溶液(0. 4、0. 8、1. 2、1. 6、2. 0、2. 4 mg/mL)。再分别将40 μL 样品溶液与120 μL ABTS 工作液混合均匀,37 ℃避光反应10 min,在734 nm 波长处测定吸光度,记录吸光值A1。无水乙醇作为空白对照,记录吸光值A0。ABTS+·清除率计算公式如下:
1. 3. 7 抗肿瘤活性的测定
采用CCK-8 法检测所制备的大球盖菇多肽对4 种肿瘤细胞(宫颈癌细胞HeLa、肺癌细胞NCIH460、乳腺癌细胞BT549、肝癌细胞HepG2)的抑制作用。分别向肿瘤细胞培养基中加入大球盖菇多肽液,各组分浓度分别为100、300、500 μg/mL。培养48 h 后,加入10 μL CCK-8 溶液,37 ℃ 培养2. 5 h。在450 nm 波长处测定吸光度,记录吸光值A 样品。以不加多肽液为对照,记录吸光值A 对照。各组分多肽液对肿瘤细胞的抑制率计算如下:
1. 4 统计分析
所有试验重复3 次,取平均值,采用SPSS21. 0 对数据进行极差分析、方差分析、显著性检验,显著性水平为Plt;0. 05,采用Origin 2021 制图。
2 结果与分析
2. 1 大球盖菇多肽制备工艺的优化
2. 1. 1 蛋白酶的筛选结果
向大球盖菇蛋白溶液中分别加入5 种蛋白酶,以水解度为评价指标,比较分析不同蛋白酶的水解效果。如图1 所示,5 种蛋白酶均能水解大球盖菇蛋白。不同蛋白酶水解度为:胰蛋白酶gt; 中性蛋白酶gt; 碱性蛋白酶gt; 木瓜蛋白酶gt; 复合蛋白酶。胰蛋白酶的水解效果最好,达9. 37%,且与其它蛋白酶的水解度差异极显著。研究发现,胰蛋白酶在人体消化道内存在,其酶解产生的多肽及游离氨基酸有利于人体肠道吸收[30]。另外,徐明等[31]制备的鹿茸多肽、周雅情等[32]制备的牛排菇多肽,也发现胰蛋白酶的水解效果最好,说明胰蛋白酶制备多肽具有普遍性,后续试验选择胰蛋白酶进行大球盖菇蛋白的水解。
2. 1. 2 单因素试验的结果
(1) 料液比对水解度的影响
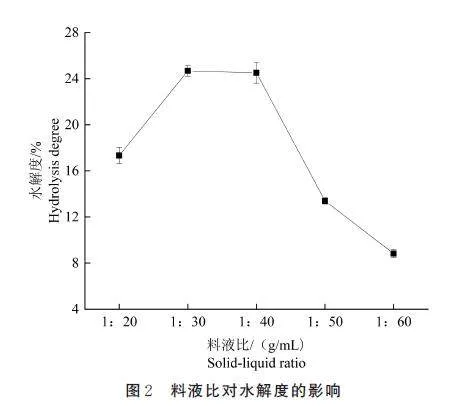
如图2 所示,料液比在1∶20~1∶30 g/mL 时,水解度明显增加,在1∶30~1∶60 g/mL 时,水解度呈下降趋势。研究发现,料液比影响溶液的浓度和粘度,对水解度的影响较大。当料液比过高时,底物浓度过大会影响超声效果,从而影响蛋白的提取;同时,底物因粘稠而不能与蛋白酶充分接触,导致水解反应不完全[33]。当底物浓度过低时,水解效果不明显,且所获得的肽段浓度较低,不利于后续浓缩[32]。因此,选择料液比为1∶20、1∶30、1∶40 g/mL 进行后续的正交试验。
(2) 酶添加量对水解度的影响
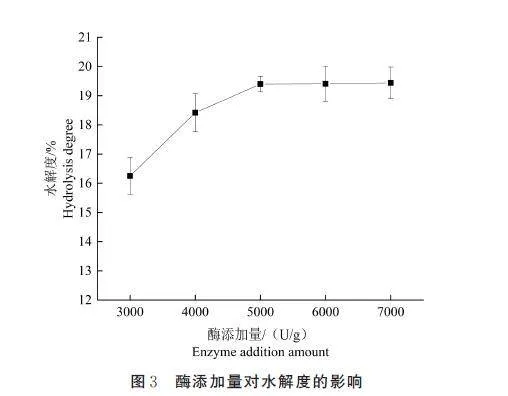
如图3 所示,酶添加量在3000~5000 U/g 范围时,水解度随着酶添加量的增加而增大;当酶添加量为5000 U/g 时,水解度达到最高,为19. 40%;当酶添加量大于5000 U/g 时,增大酶添加量,水解度趋向稳定。这是因为在一定范围内,酶添加量越大,酶与底物接触的概率越大,底物水解就越充分;当酶添加过量时,底物已基本被水解,对水解度影响不大。选择水解度较高的3 个点所对应的酶添加量(4000、5000、6000 U/g)进行后续的正交试验。
(3) 酶解时间对水解度的影响
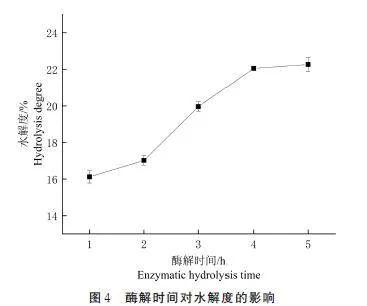
如图4 所示,在1~4 h 时,水解度随着时间的推移明显增加;在4~5 h 时,水解度增加变缓。这是因为在一定的反应时间内,酶与底物接触的时间越长,水解反应越充分;水解4 h 后,底物已基本被水解,水解度的增加变得缓慢。因在酶解时间为3、4、5 h 时,水解度较高,选择这3 个酶解时间进行后续的正交试验。
2. 1. 3 正交试验结果
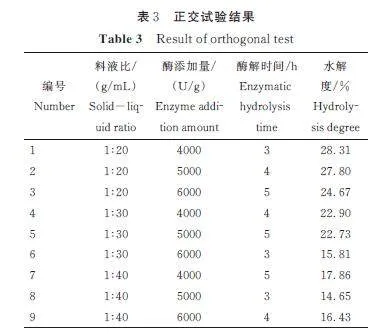
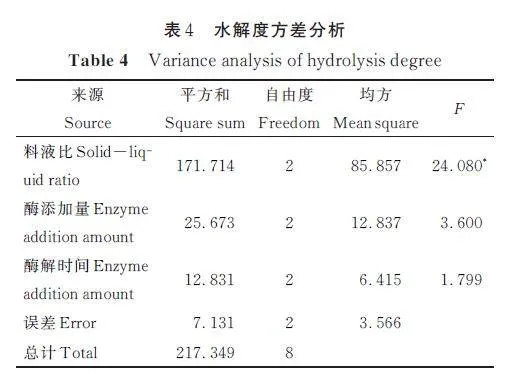
根据单因素试验结果,以水解度为评价指标,对料液比、酶添加量和酶解时间3 个因素进行正交试验。由表3 和表4 可见,大球盖菇多肽制备工艺中对水解率产生影响的各因素顺序为料液比gt;酶添加量gt;酶解时间,料液比为显著影响因素(Plt;0. 05),而酶添加量与酶解时间对水解度的影响不显著。最终确定制备大球盖菇多肽的最佳工艺为料液比1∶20 g/mL、酶添加量4000 U/g、水解3 h,此条件下大球盖菇蛋白的水解度达到28. 31%,比优化前提高了3 倍。
2. 2 体外抗氧化活性检测结果
2. 2. 1 大球盖菇多肽对DPPH·清除能力测定结果
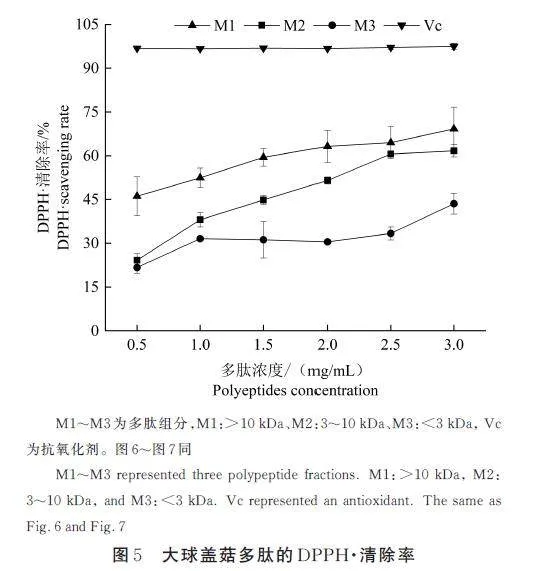
将所制备的大球盖菇多肽经不同大小孔径的超滤膜分级,可获得3 个不同分子量组分:M1(gt;10 kDa)、M2(3~10 kDa)、M3(lt;3 kDa)。Vc 是一种抗氧化剂,检测不同大球盖菇多肽组分的DPPH·清除率,并与同等浓度Vc 进行对比,可更加直观地呈现大球盖菇多肽的DPPH·清除率。如图5 所示,3 个大球盖菇多肽组分的DPPH·清除率随着多肽浓度的增加而增加,呈现剂量依赖关系,说明所提取的大球盖菇多肽具有一定的DPPH·清除能力。其中,M1 的DPPH·清除率远高于M2 和M3,且在3 mg/mL 浓度下与姜旭等[14]所制备的10 mg/mL 赤松茸多肽相当,说明本研究所制备的多肽在低浓度下具有较强的DPPH·清除能力。
2. 2. 2 大球盖菇多肽对ABTS+·清除能力测定结果
如图6 所示,3 个大球盖菇多肽组分对ABTS+·的清除能力呈现相似的规律。当多肽浓度在0. 4~1. 6 mg/mL 时,ABTS+·清除率随着浓度的增加而增加,说明大球盖菇多肽在此范围内具有浓度依赖性的抗氧化能力;当浓度在1. 6~2. 4 mg/mL 时,ABTS+·清除率与同等浓度Vc 的清除能力相当,且趋于稳定,说明大球盖菇多肽在较高浓度下具有与已知抗氧化剂相当的功效,且在1. 6~2. 4 mg/mL 内达到饱和。在以往研究中,以草菇和杏鲍菇为材料所制备的多肽ABTS+·清除率均低于同等浓度Vc[23,34],可见,本研究所制备的大球盖菇多肽均有很强的ABTS+·清除能力。
综上所述,本研究所制备的3 个大球盖菇多肽组分均具有一定的DPPH·和ABTS+·清除能力,说明它们都具有良好的抗氧化活性。
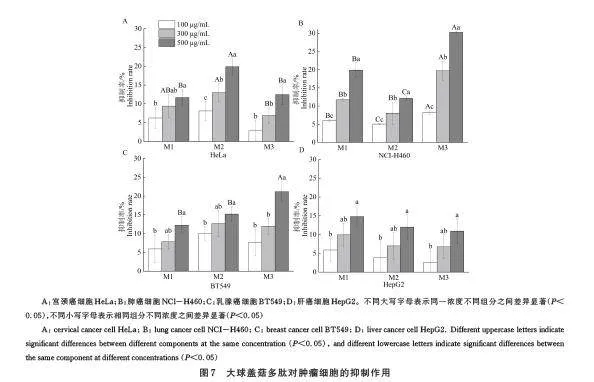
2. 3 抗肿瘤活性的检测结果
在对大球盖菇多肽的抗肿瘤活性检测中,采用CCK-8 法观察不同浓度的多肽对4 种常见肿瘤细胞系(宫颈癌细胞HeLa、肺癌细胞NCI-H460、乳腺癌细胞BT549、肝癌细胞HepG2)的增殖抑制效应。如图7 所示,3 个大球盖菇多肽组分对4 种肿瘤细胞均有一定抑制作用。随着大球盖菇多肽浓度的增加,其对肿瘤细胞的抑制效果也逐步增强,呈现出明显的剂量依赖关系。这一发现与先前文献报道的研究成果一致[35-36],说明大球盖菇多肽在抗肿瘤方面的潜在价值。不同多肽组分抗肿瘤抑制效果具有一定差异,M1 和M3 组分对肺癌细胞NCI-H460 的抑制效果尤为突出,最高抑制率分别达到19. 91% 和30. 28%;而M2 组分则对宫颈癌细胞HeLa 显示出较强的抑制能力,最高抑制率为19. 91%;另外,3 个多肽组分对肝癌细胞HepG2 的抑制活性差异不大,这可能与其结构和作用机制不同有关[37]。
3 讨论
水解度是评价生物活性肽高效制备的关键指标,与肽得率、分子质量和功能活性密不可分[38]。水解度越高意味着蛋白通过水解释放的小分子生物活性肽的可能性就越大,制备的小分子生物活性肽生物活性更强[14]。目前蛋白水解度测定方法有很多,每种方法各有优缺点[26,39-41]。在已报道的赤松茸蛋白水解中,姜旭[14]采用甲醛固定法测得最高水解度为36. 02%,而张昊等[8]采用邻苯二甲醛法测得最高水解度为67. 30%,均高于本研究采用茚三酮比色法所测定结果(28. 31%)。蛋白水解度高低与测定方法有很大关系[8,14],茚三酮比色法虽受限于氨基酸组成,一般测定结果比其它方法低;但差异在可接受范围内,且具有检出限低、测定浓度范围广、不受酶种类和水解条件的限制等优势,是一种能较好反映实际值的测定方法[41]。
在抗氧化活性研究中,本研究所制备的多肽在低浓度下呈现出较强的DPPH·清除能力,最高清除率达69. 2%,高于已报道的其它食用菌多肽,如茶树菇、猴头菇多肽的最高DPPH·清除率分别为44. 8%、53. 01%[35,42]。在对ABTS+·的清除能力上,本研究所制备的3 个多肽组分在1. 6 mg/mL浓度下均可达到85% 以上的清除率,与同等浓度的Vc 相当,远高于同等浓度的赤松茸和松茸多肽,说明本研究所制备的多肽抗氧化性优于以往的相关报道[14,43]。这可能与酶解过程中蛋白酶的选择有关,因为不同的蛋白酶水解产生的多肽在产量和活性上都会有所差异[23]。
食用菌作为食用和开发保健食品、药品的良好原料,目前已有食用菌活性肽抗肿瘤活性的相关研究。于弋涵等[35]发现猴头菇多肽能极显著抑制肝癌细胞HepG2;孙亚男等[36]发现杏鲍菇菌丝多肽对乳腺癌细胞、宫颈癌细胞和胃癌细胞具有较强抑制作用;张胜等[44]发现0. 5 mg/mL 灵芝肽对肝癌细胞HepG2 抑制率为15. 13%,与本研究中500 μg/mL M1 相当。可见,食用菌活性肽有一定的抗肿瘤活性,在抗肿瘤药物研发中有巨大潜力。
4 结论胰蛋白酶酶解制备大球盖菇多肽的最佳工艺为料液比1∶20 g/mL、酶添加量4000 U/g、酶解时间3 h,在此条件下大球盖菇的蛋白水解度为28. 31%,比优化前提高了3 倍;所制备的大球盖菇多肽对DPPH·和ABTS+·的最高清除率可达69. 2% 和91. 4%,说明它们具有较强的抗氧化活性;另外,大球盖菇多肽均有一定的抗肿瘤活性,呈现浓度依赖性;且不同多肽组分对肿瘤细胞的抑制效果不同。后续可对大球盖菇的抗氧化肽和抗肿瘤肽进一步分离纯化,并将其应用于功能性食品及抗肿瘤药物,实现大球盖菇的高效利用和产业的可持续发展。
参考文献
[1]王晓炜,詹巍,陶明煊,等.大球盖菇营养成分、抗氧化活性物质分析[J].食用菌,2007,29(6):62-63.
Wang X W,Zhan W,Tao M X,et al. Analysis of nutritionalcomponents and antioxidant active substances of Pleurotusostreatus[J].Edible Fungi,2007,29(6):62-63.
[2]骆庆,郭涛,孙召新,等.大球盖菇的生物学基础、活性成分及其应用[J].微生物学通报,2023,50(6):2709-2720.
Luo Q,Guo T,Sun Z X,et al. Biological basis and bioactivecomponents of Stropharia rugosoannulata and its application[J].Microbiology China,2023,50(6):2709-2720.
[3]景炳年,常霞,魏磊,等.博爱县赤松茸营养成分、生物活性物质及重金属含量分析与评价[J].食品工业科技,2022,43(4):278-285.
Jing B N,Chang X,Wei L,et al. Analysis and evaluation ofnutrient components,bioactive substances and heavy metalcontent of Stropharia rugosoannulata in Bo’ai County[J].Science and Technology of Food Industry,2022,43(4) :278-285.
[4]汪虹,陈辉,张津京,等.大球盖菇生物活性成分及药理作用研究进展[J].食用菌学报,2018,25(4):115-120.
Wang H,Chen H,Zhang J J,et al. Research progresses onbioactive components in Stropharia rugosoannulata and theirpharmacological effects[J]. Acta Edulis Fungi,2018,25(4):115-120.
[5]刘鑫燕,李占峰,彭帮柱.大球盖菇腐败真菌的分离、鉴定及生长特性研究[J].食品工业科技,2024,45(9):131-139.
Liu X Y,Li Z F,Peng B Z. Isolation,identification and growthcharacteristics of spoilage fungi from Stropharia rugosoannulata[J]. Science and Technology of Food Industry,2024,45(9):131-139.
[6]唐三定,高家月.大球盖菇盐水罐头生产工艺的研制[J].食用菌,2005,27(2):49-50.
Tang S D,Gao J Y. Development of production technology ofbrine canned Pleurotus ostreatus[J]. Edible Fungi,2005,27(2):49-50.
[7]滑帆,邢万里,高义平.大球盖菇采后加工工艺研究进展及发展方向探讨[J].中国食用菌,2024,43(1):1-5.
Hua F,Xing W L,Gao Y P. Research progress anddevelopment direction of postharvest processing technology ofStropharia rugosoannulata[J].Edible Fungi of China,2024,43(1):1-5.
[8]张昊,刘源,刘东青,等.赤松茸蛋白酶解工艺优化及山楂复合饮料的研制[J].饮料工业,2020,23(4):43-49.
Zhang H,Liu Y,Liu D Q,et al. Response surface optimizationof enzymatic hydrolysis of Stropharia rugoso-annulata andpreparation of hawthorn compound beverage[J]. BeverageIndustry,2020,23(4):43-49.
[9]崔晓瑞,王丽,石菲菲,等.超声波辅助碱法提取大球盖菇蛋白质工艺的优化[J]. 食品安全质量检测学报,2020,11(20):7536-7543.
Cui X R,Wang L,Shi F F,et al. Optimization of extractionprocess of Stropharia rugosoannulata protein by ultrasonicassistedalkali[J]. Journal of Food Safety amp; Quality,2020,11(20):7536-7543.
[10]李文,陈万超,马海乐,等.大球盖菇肽基料超声制备及其食药特性分析[J].食用菌学报,2022,29(3):81-94.
Li W,Chen W C,Ma H L,et al. Ultrasonic preparation ofStropharia rugosoannulata peptides and analysis of their tastecharacteristics and pharmacological activities[J]. Acta EdulisFungi,2022,29(3):81-94.
[11]Li W,Chen W C,Ma H L,et al. Structural characterizationand angiotensin-converting enzyme (ACE) inhibitorymechanism of Stropharia rugosoannulata mushroom peptidesprepared by ultrasound[J]. Ultrasonics Sonochemistry,2022,88:106074.
[12]Chen W C,Li W,Wu D,et al. Characterization of novelumami-active peptides from Stropharia rugoso-annulatamushroom and in silico study on action mechanism [J] .Journal of Food Composition and Analysis,2022,110:104530.
[13]Li W,Chen W C,Wu D,et al. Taste peptides derived fromStropharia rugosoannulata fermentation Mycelium andmolecular docking to the taste receptor T1R1/T1R3[J] .Frontiers in Nutrition,2022,9:960218.
[14]姜旭.赤松茸肽的制备及其抗氧化活性和免疫活性的初步研究[D].长春:吉林农业大学,2023.
Jiang X. Preparation of Tricholoma matsutake peptide andpreliminary study on its antioxidant activity and immune activity[D].Changchun:Jilin Agricultural University,2023.
[15]李悦,高欢,金芳,等.多肽类化合物抗肿瘤作用机制的研究进展[J].医学综述,2019,25(17):3486-3490,3496.
Li Y,Gao H,Jin F,et al. Research progress on mechanism ofanti-tumor polypeptides drugs[J] . Medical Recapitulate,2019,25(17):3486-3490,3496.
[16]Erdmann K,Cheung B W Y,Schröder H. The possible rolesof food-derived bioactive peptides in reducing the risk ofcardiovascular disease [J] . The Journal of NutritionalBiochemistry,2008,19(10):643-654.
[17]Wang Z,Cheng Y P,Muhoza B,et al. Discovery of peptideswith saltiness-enhancing effects in enzymatic hydrolyzedAgaricus bisporus protein and evaluation of their salt-reductionproperty[J].Food Research International,2024,177:113917.
[18]俞安淇. 富硒杏鲍菇多肽的制备及其对铅毒性的改善作用[D].南京:南京财经大学,2023.
Yu A Q. Preparation of selenium-enriched polypeptide fromPleurotus eryngii and its improvement on lead toxicity[D].Nanjing:Nanjing University of Finance amp; Economics,2023.
[19]张书会,罗璐,孙雪言,等.虎奶菇菌丝体抗菌肽提取工艺优化及活性研究[J].食品与机械,2022,38(8):158-165.
Zhang S H,Luo L,Sun X Y,et al. Optimization of extractionprocess and activity study of antimicrobial peptides fromPleurotus tuber-regium Mycelium[J]. Food amp; Machinery,2022,38(8):158-165.
[20]Chen D Y,Chen W C,Wu D,et al. Saltiness enhancingpeptides isolated from enzymolysis extract of Lentinula edodesand their taste enhancing action mechanisms[J].LWT,2023,188:115430.
[21]Krobthong S,Choowongkomon K,Suphakun P,et al. Theanti-oxidative effect of Lingzhi protein hydrolysates onlipopolysaccharide-stimulated A549 cells [J] . FoodBioscience,2021,41:101093.
[22]游庆红,陈梅琳,赵增东,等.响应面法优化酶解草菇蛋白制备抗氧化肽工艺[J]. 食品研究与开发,2022,43(4):149-157.
You Q H,Chen M L,Zhao Z D,et al. Optimization byresponse surface methodology of enzymatic hydrolysis ofVolvariella volvace protein to obtain antioxidant peptides[J].Food Research and Development,2022,43(4):149-157.
[23]张岩,吴燕燕,李来好,等.酶法制备海洋活性肽及其功能活性研究进展[J].生物技术通报,2012(3):42-48.
Zhang Y,Wu Y Y,Li L H,et al. Review on researchprogresses in bioactive peptides from marine protein by enzyme[J].Biotechnology Bulletin,2012(3):42-48.
[24]周宇,徐春梅,刘苏琴,等.松茸水解蛋白肽制备及其抗氧化活性的研究[J].食品安全质量检测学报,2022,13(9):2947-2955.
Zhou Y,Xu C M,Liu S Q,et al. Study on preparation andantioxidant activity of Tricholoma matsutake hydrolytic proteinpeptide[J]. Journal of Food Safety amp; Quality,2022,13(9):2947-2955.
[25]景炳年,常霞,魏磊,等.博爱县赤松茸营养成分、生物活性物质及重金属含量分析与评价[J]. 食品工业科技,2022,43(4):278-285.
Jing B N,Chang X,Wei L,et al. Analysis and evaluation ofnutrient components,bioactive substances and heavy metalcontent of Stropharia rugosoannulata in Bo’ai County[J].Science and Technology of Food Industry,2022,43(4):278-285.
[26]李皖光,汪桃花,王新文,等.4 种大米蛋白水解度测定方法比较[J].粮食科技与经济,2017,42(5):35-37.
Li W G,Wang T H,Wang X W,et al. The comparison offour methods in testing degree of hydrolysis[J].Grain Scienceand Technology and Economy,2017,42(5):35-37.
[27]潘心红,陈建国,黄润玲,等.全自动凯氏定氮仪测定蛋白质(以N 计) 不确定度分析与探讨[J]. 分析仪器,2022(1):100-102.
Pan X H,Chen J G,Huang R L,et al. Uncertainty analysis ofprotein content determination with automatic Kjeldahl nitrogenanalyzer[J].Analytical Instrumentation,2022(1):100-102.
[28]庞小一,王静,张慧娟,等.燕麦肽的制备、抗氧化性及其对α-淀粉酶抑制作用的研究[J]. 食品工业科技,2013,34(20):163-168.
Pang X Y,Wang J,Zhang H J,et al. Study on preparation ofoat peptides and its antioxidant activity and inhibition to α-amylase[J].Science and Technology of Food Industry,2013,34(20):163-168.
[29]Latorres J M,Rios D G,Saggiomo G,et al. Functional andantioxidant properties of protein hydrolysates obtained fromwhite shrimp (Litopenaeus vannamei)[J]. Journal of FoodScience and Technology,2018,55(2):721-729.
[30]梁丽琴,催林栋,段江燕.胰蛋白酶水解制备菠菜叶蛋白多肽的工艺研究[J].山西师范大学学报(自然科学版),2016,30(2):72-75.
Liang L Q,Cui L D,Duan J Y. Research on the preparationtchnology for protein polypeptide of spinach leaf with trypsinhydrolysis[J]. Journal of Shanxi Normal University (NaturalScience Edition),2016,30(2):72-75.
[31]徐明,岳喜庆.酶解法制备鹿茸多肽的研究[J].食品工业科技,2012,33(5):205-207.
Xu M,Yue X Q. Study on preparation of velvet antlerspolypeptide by enzymatic hydrolysis [J] . Science andTechnology of Food Industry,2012,33(5):205-207.
[32]周雅情,王莹,王昱沣.牛排菇多肽的酶解工艺优化[J].食品研究与开发,2023,44(14):169-174.
Zhou Y Q,Wang Y,Wang Y F. Optimization of enzymatichydrolysis of fistulln Hepatica polypeptides [J] . FoodResearch and Development,2023,44(14):169-174.
[33]张艳荣,王大为,张雅媛,等. 姬松茸低聚肽的制备及性质[J].高等学校化学学报,2009,30(2):293-296.
Zhang Y R,Wang D W,Zhang Y Y,et al. Preparation,characterization and properties of Agaricus blazei murilloligopeptide[J]. Chemical Journal of Chinese Universities,2009,30(2):293-296.
[34]裴云成,朱丹,崔采莲,等.杏鲍菇柄抗氧化肽的制备及其稳定性初步分析[J]. 食品工业科技,2020,41(4):146-152,160.
Pei Y C,Zhu D,Cui C L,et al. Preparation of antioxidantpeptides from Pleurotus eryngii stalk and its stabilitypreliminary analysis[J]. Science and Technology of FoodIndustry,2020,41(4):146-152,160.
[35]于弋涵,杜伟宁,胡秋辉,等.酶法水解猴头菇多肽的生物活性[J].食品科学,2021,42(21):119-127.
Yu Y H,Du W N,Hu Q H,et al. Bioactivities of peptidesderived from Hericium erinaceus proteins by enzymatichydrolysis[J].Food Science,2021,42(21):119-127.
[36]孙亚男,李文香,胡欣蕾.杏鲍菇菌丝体多肽的免疫活性及抗肿瘤作用[J].现代食品科技,2017,33(5):20-26.
Sun Y N,Li W X,Hu X L. Immunological and antitumoractivities of polypeptides from Pleurotus eryngii Mycelium[J].Modern Food Science and Technology,2017,33(5):20-26.
[37]郭允峰,李晓坤,吴迪,等.抗癌肽抗癌作用机制的研究进展[J].现代肿瘤医学,2022,30(10):1875-1879.
Guo Y F,Li X K,Wu D,et al. Research progress onanticancer mechanism of anticancer peptides[J]. Journal ofModern Oncology,2022,30(10):1875-1879.
[38]胡方园.酶法制备鳙鱼低聚肽及其抗氧化活性研究[D].无锡:江南大学,2012.
Hu F Y. Enzymatic preparation of oligopeptide from bigheadcarp and its antioxidant activity [D] . Wuxi: JiangnanUniversity,2012.
[39]罗艳华,王全杰,陈沛海,等.蛋白水解物水解度测定方法的研究[J].皮革与化工,2017,34(2):26-31.
Luo Y H,Wang Q J,Chen P H,et al. Study on determinationmethod for hydrolyzed de gree of protein hydrolysate[J].Leather and Chemicals,2017,34(2):26-31.
[40]李晓东,牛治霞,张柏林.乳清蛋白水解物水解度3 种测定方法的比较[J].中国乳品工业,2006,34(10):59-62.
Li X D,Niu Z X,Zhang B L. Various methods available forthe determination of hydrolyzed degree of whey protein[J].China Dairy Industry,2006,34(10):59-62.
[41]崔敏,傅婕,迟原龙,等.茚三酮比色法和甲醛滴定法测定水解胶原的比较[J].中国皮革,2011,40(7):1-4.
Cui M,Fu J,Chi Y L,et al. Comparison of ninhydrincolorimetry and formaldehyde titration in determination ofcollagen hydrolysate[J].China Leather,2011,40(7):1-4.
[42]翁梁,郝涤非,李西腾,等.酶法提取茶树菇多肽工艺及体外抗氧化研究[J].食品科技,2020,45(4):182-186.
Weng L,Hao D F,Li X T,et al. Extraction technology ofpolypeptides from Agrocybe aegirit amp; its antioxidant test invitro with enzymatic method [J] . Food Science andTechnology,2020,45(4):182-186.
[43]葛麒,朱春燕,陈湖南,等.松茸蛋白抗氧化肽制备及构效关系研究[J].食品安全质量检测学报,2023,14(9):9-17.
Ge Q,Zhu C Y,Chen H N,et al.Research on preparation andstructure-activity relationship of Tricholoma matsutake proteinantioxidant peptide[J]. Journal of Food Safety amp; Quality,2023,14(9):9-17.
[44]张胜,何慧,蔡先启,等.灵芝肽诱导人肝癌HepG2 细胞凋亡的细胞学观察[J].食品科学,2009,30(9):195-199.
Zhang S,He H,Cai X Q,et al. Morphological observation ofhuman hepatoma HepG2 cells apoptosis induced byGanoderma lucidum peptides[J].Food Science,2009,30(9):195-199.
(编辑:韩志强)
基金项目:江汉大学四新学科专项科研项目(2022SXZX23)

