215 份甜椒资源表型性状遗传多样性分析

摘要:[目的]本文旨在探明山西省蔬菜资源共享服务平台保存的甜椒种质资源的遗传多样性。[方法]利用主成分分析、相关性分析和聚类分析方法,对来自国内外215 份甜椒资源的33 个表型性状(13 个数量性状和20 个质量性状)进行遗传多样性分析。[结果]215 份甜椒资源的遗传多样性丰富,其中数量性状的遗传变异系数范围在12. 22% ~30. 32% ,变异系数最大的是商品果纵径,最小的是心室数,变异范围最大的数量性状是商品果纵径为15. 79% ~110. 57%,变异范围最小的是主茎粗为7. 53%~24. 07%;质量性状的遗传多样性指数范围在5. 177~5. 368,分枝类型的遗传多样性指数最大,花冠色遗传多样性指数最小,各甜椒材料间遗传变异突出。采用主成分分析将33 个表型性状分为8 个主成分,这8 个主成分贡献率为3. 131%~14. 812%,累积贡献率为14. 812%~65. 421%,所有成分均代表了甜椒表型性状的主要信息;在528 对相关性状中有186 对达到显著水平,因此在选择材料时不能只考虑单一性状,应同时考虑相关性状遗传变异;215 份甜椒资源在遗传距离为0. 73 时聚为5 类,每一类材料的表型性状均有其特点。[结论]由结果可知,花柱长度、叶色、叶面特征、青熟果色、果实横切面形状和果形等20 个性状是引起甜椒表型差异的主要因素,所选甜椒资源遗传差异大,变异丰富。本研究可为今后甜椒资源筛选和杂交育种提供理论依据。
关键词:甜椒; 表型性状; 遗传多样性; 主成分分析; 相关性分析; 聚类分析
中图分类号:S641.3 文献标识码:A 文章编号:1671-8151(2025)01-0029-12
甜椒(Capsicum annuum L.)别名青椒、菜椒,属一年生草本植物,起源于南美,作为蔬菜和调味品分布在世界各地[1]。随着自然培育和人工选择,甜椒果肉厚,果实体积增大,微甜无辣味,以其独特的色泽和营养成分成为全球共享的蔬菜作物[2],传入我国后成为重要的蔬菜,可加工、可鲜食,具有重要的经济价值,不仅在我国贵州、云南、甘肃、山西等地广泛种植,在世界其它地方也广泛种植[3],是人类饮食中重要的抗坏血酸和类胡萝卜素以及酚类化合物的最佳来源之一[4]。近年来,由于我国不同地区气候和环境差异大,甜椒种质资源相对有限,导致优质品种滞后,高品高产的优良品种不多,限制了甜椒产业的发展,因此引进和培育出优良甜椒品种是至关重要的。
表型性状是植物重要表现形式,由环境和基因决定,表型性状的研究不仅操作简单、价格低廉,且结果简洁明了,是研究遗传变异最基础、最直接的方法[5]。表型性状的研究在国内外受众多学者的关注,如张国儒等[6]对272 份辣椒的表型性状遗传多样性分析,结果表明,22 个性状的平均变异系数为47. 59%,变异系数越高,遗传越稳定。任丽等[7]对457 份辣椒的47 个基本性状作为形态学标记进行多层次综合分析,结果显示品种间年度表现稳定,相关系数平均88. 0%,个体测量性状稳定于群体目测性状,群体测量性状稳定性最低。Moon 等[8]对2 种辣椒513 个材料的农业形态特征和植物化学成分进行表征,并确定成熟果实的朝向和颜色与植物化学物质之间的关系。Rajametov等[9]以39 份辣椒为材料,在不同温度条件下对其表型性状进行研究,结果表明,不同基因型在低温下的茎粗和主轴长度存在差异,且39 个处理的辣椒材料通过聚类分析聚为7 类。表型性状的研究是通过采用遗传上较为稳定且不易受环境影响的性状,来揭示群体的遗传规律及变异大小,最终为种群的保护提供理论支持[10]。
遗传多样性是生物在不断演变和进化过程中积累和变化的结果,且对生物的生存与演化起着至关重要的作用[11]。植物遗传多样性的研究有形态学[12]、生物化学[13]和分子[14]等方法,前人已在水稻(Oryza sativa L.)[15]、扁豆(Lablab purpureus L.)[16]、番茄(Solanum lycopersicom L.)[17]等作物上都进行了相关研究。当前关于辣椒遗传多样性的研究较多,Guo 等[18]对179 个辣椒野生品种和现有品种的22 个定性性状、13 个数量性状和27 个分子标记进行遗传多样性分析,结果表明现有品种的数量性状多样性高于地方品种,而分子标记遗传多样性低于地方品种。袁娟伟等[19]以275 份辣椒为研究材料,对42 个表型性状进行遗传多样性分析,结果表明275 份辣椒材料展现出丰富的遗传多样性,共17 个表型性状是引起辣椒材料表型不同的主要因素。谭放军等[20]对98 份辣椒的表型性状和叶绿体trnH-psbA 序列进行分析,将所有材料分为3 大类,筛选出了31 份核心材料。在全国范围内,关于辣椒遗传多样性报道较多,但关于甜椒遗传多样性报道较少。
本研究通过对来自国内外的215 份甜椒资源为试验材料,对33 个表型性状进行遗传多样性分析、主成分分析、相关性分析和聚类分析,旨在为今后甜椒特异资源的筛选提供科学方法。
1 材料和方法
1. 1 试验材料
供试的215 份甜椒为山西省蔬菜资源共享服务平台保存的甜椒纯合资源,其中117 份来自国外,98 份来自国内(附表1)。2023 年3 月1 日在山西省晋中市榆次区东阳镇山西农业大学试验基地(37. 82° N,112. 87° E)温室播种育苗,穴盘规格72穴,每穴1 粒。当幼苗长至六叶一心时(2023 年5 月初)定植于塑料大棚中,定植前施足底肥,每份资源每小区定植10 株,株行距为40 cm×60 cm,随机区组排列,设3 次重复。采用地膜覆盖和膜下滴灌的栽培模式,肥水、病虫害防治等田间管理基本一致。
1. 2 试验方法
表型性状调查方法参照《辣椒材料资源描述规范和数据标准》进行[21]。各小区材料随机选取5株调查观测,各个性状的记载标准参照(表1、表2)进行,其中首花节位、主茎粗、主茎长度、叶片长度、叶片宽度、叶柄长度、株高、株幅、商品果纵径、商品果横径、果梗长度、果肉厚和心室数共13 个性状采用实际测量数值。
1. 3 统计分析
应用SPSS 26. 0 软件分析数量性状的变异系数、平均值、标准差、最大值和最小值,完成质量性状频率分布分析、多样性分析、主成分分析、相关性分析和聚类分析;应用Origin 2021 软件绘制相关性分析及聚类分析热图。
2 结果与分析
2. 1 数量性状多样性分析
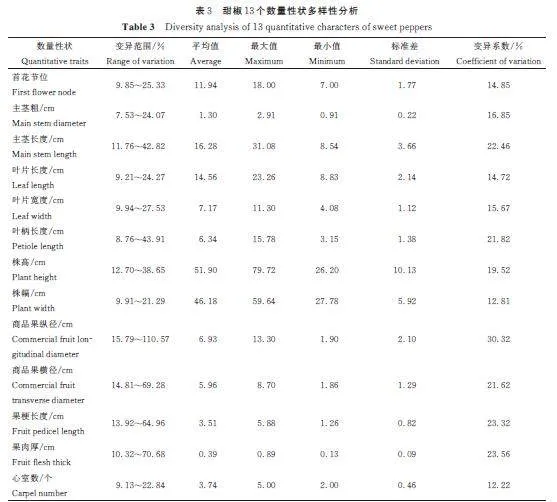
由表3 可见,215 份甜椒数量性状的变异范围最大的是商品果纵径,15. 79%~110. 57%,变异范围最小的是主茎粗,7. 59%~24. 07%。变异系数范围在12. 22%~30. 32% 之间,商品果纵径变异系数最大,30. 32%,心室数的变异系数最小,12. 22%。商品果横径、果肉厚、果梗长度、主茎长和叶柄长度的变异范围和变异系数均较高,说明在筛选甜椒材料时可以着重考虑。
2. 2 质量性状多样性分析
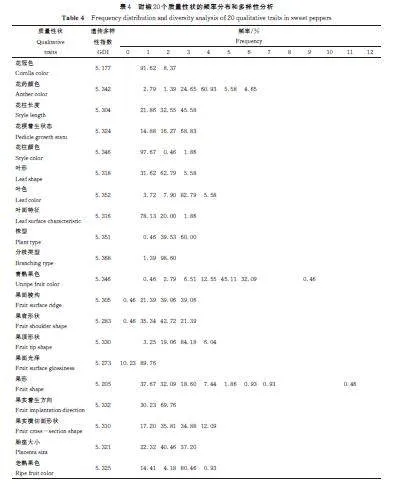
由表4 可见,215 份甜椒20 个质量性状的遗传多样性指数范围在5. 177~5. 368,其中分枝类型遗传多样性指数最高,为5. 368,叶片颜色多样性指数次之,为5. 352,花柱颜色及青熟果色遗传多样性指数相同,为5. 346,遗传多样性指数偏小的是果面光泽和果形,为5. 273 和5. 205;遗传多样性指数最小是花冠色,为5. 177。由性状频率分布可知,花冠颜色以白色为主,花药的颜色以浅蓝色为主,花柱长度以长于雄蕊为主,花梗着生状态以直立为主,花柱颜色以白色为主,叶片的形状以长卵形为主,叶片的颜色以绿色为主,叶面特征以平滑为主,株型以直立为主,分枝类型以无限分枝为主,果面光泽以有光泽为主,青熟果色以绿色为主,果实表面棱沟以深为主,果实着生方向以向下为主,果实的果肩形状以凸为主,果实的果顶形状以凹为主,果实的形状以方灯笼形为主,果实的横切面形状以近三角形为主,胎座大小以中为主,老熟果实以鲜红色为主。上述结果表明20 个质量性状具有丰富的遗传多样性。
2. 3 主成分分析
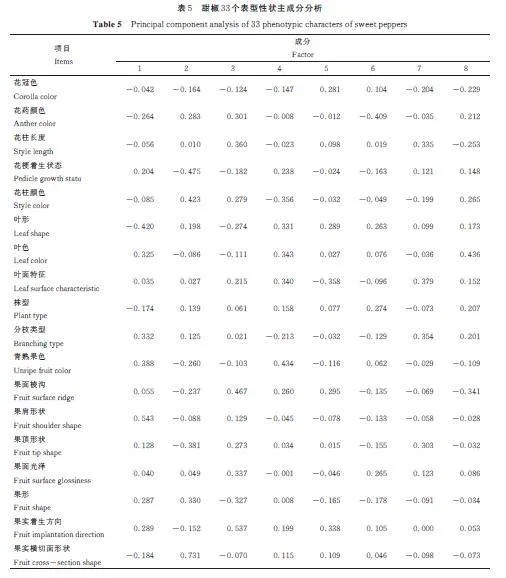
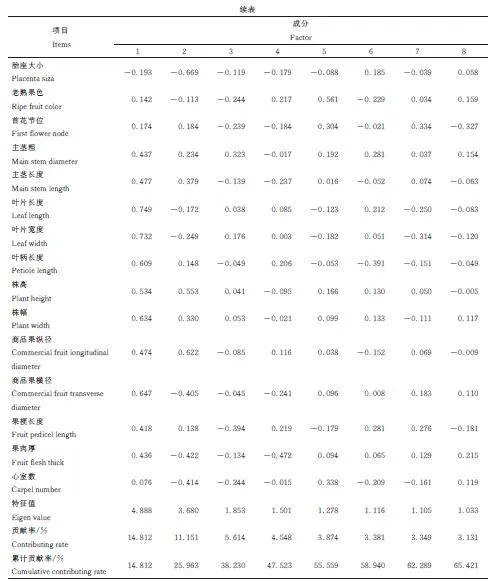
由表5 可见,8 个主成分贡献率为3. 131%~14. 812%,累计贡献率为14. 812%~65. 421%。第1 主成分的特征值为4. 888,贡献率为14. 812%,叶片长度、叶片宽度和商品果纵径为主要性状。第2 主成分特征值为3. 680,贡献率为11. 151%,果形、株高、商品果纵径为主要性状。第3 主成分特征值为1. 853,贡献率为5. 614%,花柱长度、果面棱沟、果实横切面形状为主要性状。第4 主成分特征值为1. 501,贡献率为4. 548%,叶色、叶面特征和青熟果色为主要性状。第5 主成分特征值为1. 278,贡献率分别为3. 874%,果实横切面形状、老熟果色和心室数为主要性状。第6 主成分特征值为1. 116,贡献率为3. 381%,果梗长度、主茎粗和株型为主要性状。第7 主成分特征值为1. 105,贡献率为3. 349%,花柱长度、叶面特征和分枝类型为主要特征。第8 主成分特征值为1. 033,贡献率分别为3. 131%,果肉厚、叶色和花柱颜色为主要特征。所有成分均代表了甜椒表型性状的主要信息量,其中花柱长度、叶色、叶面特征和果实横切面形状等20 个性状是引起甜椒表型差异的主要因素。
2. 4 相关性分析
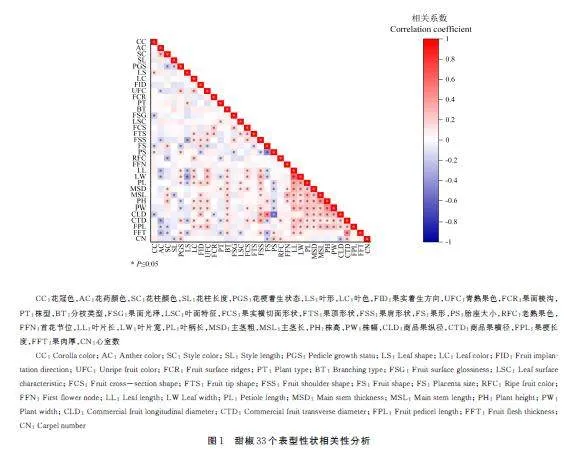
由图1 可见,528 对性状中,有186 对性状显著相关。花梗着生状态与叶片形状、叶片长度、叶片宽度和果面特征等性状有显著的正相关性,与株高和株型有显著的负相关性,有12 个性状与花梗着生状态显著相关。青熟果色与花梗着生状态、叶片长度、叶片宽度、叶色、株高和株幅等性状有显著的正相关性,而与花药和果实形状有显著的负相关性,共有13 个性状与青熟果色显著相关。果肉厚度与花梗着生状态、叶片长度、叶片宽度和分枝类型等性状有显著的正相关性,与花药颜色和叶片形状等有显著的负相关性,共13 个性状与果肉厚度显著相关。株高与首花节位、叶片颜色、叶片长度和叶片宽度等多个性状有显著的正相关性,与花梗着生状态和胎座大小有显著的负相关性,共17 个性状与株高度显著相关。果肩形状与叶片颜色、叶片长度和叶片宽度等性状有显著的正相关性,而与花药颜色和叶片形状有显著的负相关性,共17 个性状与果肩形状显著相关。叶片长度与花梗着生状态、叶色和株幅等性状有显著的正相关性,与花药颜色和叶片形状有显著的负相关性,共19 个性状与叶片长度显著相关。商品果横径与花梗着生状态、叶片颜色、叶片长度和叶片宽度等性状有显著的正相关性,与花药颜色和株型有显著的负相关性,共22 个性状与商品果横径显著相关。上述结果表明,植株的叶片特征、果实性状和形态特征之间存在一定的相关性。
2. 5 聚类分析
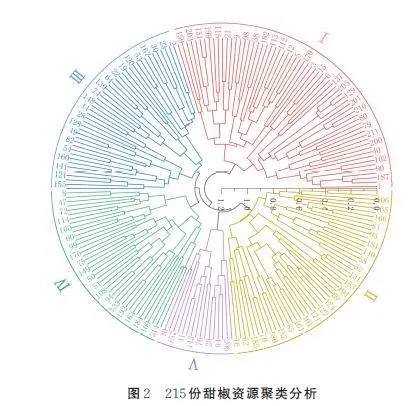
基于33 个表型性状对215 份甜椒资源进行聚类分析(图2),215 份甜椒资源在遗传距离0. 73 时聚为5 大类(Ⅰ,Ⅱ,Ⅲ,Ⅳ,Ⅴ)。第Ⅰ类共有64 份资源,其主要特征包括:白色花冠、黄色或蓝色花药、白色花柱、卵圆形或长卵圆形叶形、绿色或深绿色叶片、半直立或直立株型、向下着生的果实、浅绿色、绿色或深绿色的青熟果、果面有光泽、钝圆或凹顶的果顶,以及鲜红色的老熟果。果实形状多样,包括方灯笼形、长灯笼形、短锥形和长锥形。这一类群可以根据育种时对果形的要求,有针对性地筛选甜椒材料。第Ⅱ类共有51 份资源,其主要特征包括:白色花冠、黄色或浅蓝色花药、白色花柱、长卵圆形叶片、绿色叶片、直立株型、向上生长的果实、绿色或深绿色的青熟果、果面有光泽、凹顶的果顶、扁灯笼形或方灯笼形的果形,以及橙红色或鲜红色的成熟果实。该类群在商品果纵横径、果形、株高、株幅等性状上表现较为突出,通过适当的改良和优化,可以在未来的育种工作中培育出优质高产的甜椒。Ⅲ类共有44 份资源,其主要特征包括:白色或浅绿色的花冠,黄色或浅蓝色的花药,白色的花柱,长卵圆形的叶子,绿色的叶片,半直立或直立的株型,向上生长的果实,绿色或深绿色的青熟果,有光泽或无光泽的果面,凹顶的果顶,扁灯笼形或方灯笼形的果形,以及鲜红色的成熟果实。这一类群的植株株高较高,代表性的甜椒有16 号资源和62 号资源,主要来源于原始种,属于未改良的品种。第Ⅳ类共有40 份资源,其主要特征包括白色花冠、黄色或浅蓝色花药、白色花柱、卵圆形或长卵圆形叶片、绿色叶片、直立株型、果实向下或向上生长、浅绿色、绿色或深绿色的青熟果、果面光滑、有凹顶、果形为扁灯笼形或方灯笼形,以及鲜红色的成熟果实。这一类群的商品果实纵径和横径平均较大,果实偏大,适合作为当前市场上主要推广的品种。第Ⅴ类以白色花冠、黄色或浅蓝色花药、白色花柱、卵圆形或长卵圆形叶形、绿色叶片、半直立或直立株型、向下或向上着生的果实、深绿色青熟果、果面有光泽、凹顶的果顶、扁灯笼形或方灯笼形果形,以及橙红色的老熟果为特征,共有16 份资源。这一类群的甜椒虽然因成熟果实的颜色而具有观赏价值,但产量较低。
3 讨论
表型性状鉴定是对甜椒最基础和最直观的评价方法。在多样性分析中,裴红霞等[22]在研究中提到,当变异系数低于10% 时,表示变异程度较弱,若变异系数介于10% 至100% 之间,则表示变异程度为中等,若变异系数超过100%,则表示变异程度较强。本研究对215 份甜椒材料的13 个数量性状进行遗传多样性分析,其变异系数为12. 22%~30. 32%,属于中等变异。李宁等[23]研究表明,商品果横径、果形指数与果实相关性状间存在丰富变异。本研究分析发现,果实指标(商品果纵径、商品果横径、果肉厚和果梗长度)在数量性状中变异系数较高,变异突出,与前人研究结果一致。在本研究中,商品果纵径(30. 32%)、商品果横径(21. 62%)、果梗长度(23. 32%)和果肉厚(23. 56%) 的变异系数均大于首花节位(14. 85%)、叶宽(15. 67%)和株幅(12. 81%)的变异系数,表明在选择甜椒材料时果实形态指标应着重考虑,在Kim 等[24]研究中也提出相似的结论。徐睿等[25]在研究中对22 个表型性状进行遗传多样性分析表明,质量性状中最丰富的表型是果实形状。本研究中质量性状遗传多样性指数偏小的是果形(5. 205),遗传指数表现型弱,与前人研究结果不同,可能是因为果形指数的不同。
主成分分析是将几种主要的表型性状转化为较少的主成分,这种分析方法简单且比较综合、全面,能够较为直观地显示出甜椒各性状的重要程度[26]。本研究从33 个表型性状中选取8 个主成分,贡献率为(14. 812%),累计贡献率为(65. 421%),果形、商品果纵径、老熟果色、果实横切面形状、果梗长度等果实指标占据主要优势。这8 个主成分基本能够说明原始指标的大部分信息,可作为甜椒表型性状的综合指标。在相关性分析中,王丹丹等[27]研究表明,单果质量与商品果纵径、商品果横径和果形呈显著正相关。彭泽等[28]研究表明,果实纵径和果梗长度呈显著正相关,叶宽与茎粗、叶柄长度以及青熟果色呈显著正相关,果面棱沟与果实横径和果肉厚呈极显著正相关。本研究中,商品果横径与商品果纵径和青熟果色呈显著正相关,果肉厚与果形呈显著正相关,叶片宽度与主茎粗、叶柄长度和青熟果色呈显著正相关,与前人研究结果一致,但果面棱沟与果肉厚呈显著负相关,与商品果横径无相关性,与彭泽研究结果有差异,可能是研究材料的不同。相关性说明,每个性状指标在某种程度上都反应了甜椒生育期的一些信息,大部分性状间都存在着一定的相关性。
Bijalwan 等[29]以辣椒13 个基因型为研究对象,通过6 个产量性状了解其遗传多样性,采用非分层聚类法将基因型分为5 个不同的聚类。本研究在遗传距离0. 73 时将215 份甜椒材料划分为5类。从聚类结果来看,尽管根据不同性状将215 份甜椒资源分为5 个主要类群,但每类的性状之间都有交叉且交叉的性状较多。这表明,不同引种来源的甜椒在遗传上高度相似,且80% 的表型性状在各类群中均有交叉出现,这与表型性状调查结果一致。此外不同地理位置的甜椒也可以归为一类,这说明地理环境的差异并不是造成甜椒表型差异的因素。目前,随着设施农业的发展和市场的扩大,甜椒的种植已不再局限于传统的露地栽培,而是转向使用大棚和温室等现代化设施,种苗的供应也不再受地理位置的限制。因此,种植地点已不再是材料分类的主要依据,不同材料之间的遗传差异和亲缘关系仍然是选择育种的关键。基于表型性状对育种材料进行科学的聚类分析显得尤为重要,这有助于更有效地利用甜椒资源,推动育种工作的进展。
4 结论
通过变异系数、遗传多样性指数、主成分、相关性和聚类对215 份甜椒资源表型性状进行遗传多样性分析,由结果可知,所选甜椒材料遗传差异大,变异丰富。由于甜椒的表型性状容易受到土壤、环境和气候等因素的影响,因此后续可通过多年种植以及形态与分子标记结合的方法进行分析。综上所述,215 份甜椒资源的育种选择潜力大,可为选育优良甜椒提供科学依据。
附加材料:附表1见中国知网增强出版内容。
参考文献
[1]Gupta R,Kapoor B,Gulati M,et al. Sweet pepper and itsprinciple constituent capsiate: functional properties and healthbenefits[J]. Critical Reviews in Food Science and Nutrition,2022,62(26):7370-7394.
[2]Du H S,Yang J J,Chen B,et al. Target sequencing revealsgenetic diversity,population structure,core-SNP markers,andfruit shape-associated loci in pepper varieties[J]. BMC PlantBiology,2019,19(1):578.
[3]孔子雯,田如霞,苗如意,等. 60 份螺丝椒种质资源农艺性状的遗传多样性分析[J]. 中国农业科技导报,2024,26(3):40-47.
Kong Z W,Tian R X,Miao R Y,et al. Analysis of agronomictraits and genetic diversity of 60 screw pepper germplasmresources[J]. Journal of Agricultural Science and Technology,2024,26(3):40-47.
[4]Hallmann E,Rembiałkowska E. Characterisation of antioxidantcompounds in sweet bell pepper (Capsicum annuum L.) underorganic and conventional growing systems[J]. Journal of theScience of Food and Agriculture,2012,92(12):2409-2415.
[5]饶庆琳,姜敏,刘选轶,等. 贵州296 份花生种质资源遗传多样性及综合评价[J]. 植物遗传资源学报,2024,25(3):373-385.
Rao Q L,Jiang M,Liu X Y,et al. Genetic diversity andcomprehensive evaluation of 296 peanuts germplasm resourcesin Guizhou[J]. Journal of Plant Genetic Resources,2024,25(3):373-385.
[6]张国儒,唐亚萍,杨涛,等. 272 份辣椒资源的农艺性状分析[J]. 新疆农业科学,2021,58(12):2300-2311.
Zhang G R,Tang Y P,Yang T,et al. Agronomic characteranalysis of 272 Capsicum resources[J]. Xinjiang AgriculturalSciences,2021,58(12):2300-2311.
[7]任丽,张余,邓姗,等. 基于形态标记的新育成辣椒品种特性分析[J]. 植物遗传资源学报,2023,24(6):1676-1689.
Ren L,Zhang Y,Deng S,et al. Characterization of newCapsicum spp. varieties based on morphological markers[J].Journal of Plant Genetic Resources,2023,24(6):1676-1689.
[8]Moon S,Ro N,Kim J,et al. Characterization of diverse pepper(Capsicum spp.) germplasms based on agro-morphological traitsand phytochemical contents[J]. Agronomy,2023,13(10):2665.
[9]Rajametov S N,Lee K,Jeong H B,et al. The effect of night lowtemperature on agronomical traits of thirty-nine pepperaccessions (Capsicum annuum L.) [J]. Agronomy,2021,11(10):1986.
[10]孟珊,徐婷婷,朱小品,等. 江苏大豆地方种质资源表型多样性分析[J]. 植物遗传资源学报,2023,24(2):419-436.
Meng S,Xu T T,Zhu X P,et al. Diversity analysis of soybeanlandraces collected from Jiangsu Province using phenotypictraits[J]. Journal of Plant Genetic Resources,2023,24(2):419-436.
[11]袁欣捷,周坤华,吴茵,等. 辣椒核心种质遗传多样性及群体结构分析[J]. 分子植物育种,2019,17(9):3090-3104.
Yuan X J,Zhou K H,Wu Y,et al. Genetic diversity andpopulation structure analysis of pepper core collections[J].Molecular Plant Breeding,2019,17(9):3090-3104.
[12]Sran T S,Jindal S K. Genetic diversity analysis of chilligenotypes based on qualitative morphological traits [J].Agricultural Research Journal,2021,58(4):603-610.
[13]隋益虎,李敏,胡能兵,等. 32 份辣椒种质遗传多样性的同工酶分析[J]. 西北植物学报,2014,34(5):908-914.
Sui Y H,Li M,Hu N B,et al. Genetic Diversity among 32germplasms of the genus Capsicum by isozyme analysis[J].Acta Botanica Boreali-Occidentalia Sinica,2014,34 (5) :908-914.
[14]Farsangi F J,Thorat A S, Devarumath R M. Assessment ofthe utility of TRAP and EST-SSRs markers for geneticdiversity analysis of sugarcane genotypes[J]. Cytology andGenetics,2018,52(6):467-477.
[15]邓伟,吕莹,董阳均,等. 云南水稻种质资源的遗传多样性分析[J]. 植物遗传资源学报,2023,24(3):624-635.
Deng W,Lü Y,Dong Y J,et al. The genetic diversity analysisof rice germplasm resources in Yunnan Province of China[J].Journal of Plant Genetic Resources,2023,24(3):624-635.
[16]Joshi M,Verma S K,Singh J P. Genetic variability,pathcoefficient and genetic diversity analysis in lentil (Lensculinaris medikus) genotypes[J]. Invertis Journal of Science amp;Technology,2019,12(1):1-7.
[17]宋丽娜,王晓敏,刘文娟,等. 基于SNP 标记的504 份番茄种质资源遗传多样性分析[J]. 核农学报,2022,36(12):2366-2387.
Song L N,Wang X M,Liu W J,et al. Genetic diversityanalysis of 504 tomato germplasm resources based on SNPmarkers[J]. Journal of Nuclear Agricultural Sciences,2022,36(12):2366-2387.
[18]Guo G J,Pan B G,Yi X X,et al. Genetic diversity betweenlocal landraces and current breeding lines of pepper in China[J]. Scientific Reports,2023,13(1):4058.
[19]袁娟伟,贾利,唐菁,等. 275 份辣椒种质资源表型性状的遗传多样性分析[J]. 安徽农业大学学报,2024,51(2):244-255.
Yuan J W,Jia L,Tang J,et al. Genetic diversity analysis ofphenotypic characters in 275 pepper germplasm resources[J].Journal of Anhui Agricultural University,2024,51 (2) :244-255.
[20]谭放军,汤冰倩,吴永红,等. 基于主要农艺性状和trnH-psbA序列的辣椒聚类分析[J]. 中国农学通报,2019,35(27):72-78.
Tan F J,Tang B Q,Wu Y H,et al. Cluster analysis of pepperbased on main agronomic traits and trnH-psbA sequences[J].Chinese Agricultural Science Bulletin,2019,35(27):72-78.
[21]李锡香,张宝玺. 辣椒种质资源描述规范和数据标准[M]. 北京:中国农业出版社,2006:1-98.
Li X X,Zhang B X. Descriptive specification and data standardof pepper germplasm resources[M]. Beijing:China AgriculturePress,2006:1-98.
[22]裴红霞,王学梅,高晶霞,等. 宁夏自育辣椒品种(系)表型遗传多样性分析[J]. 东北农业大学学报,2018,49(10):26-33.
Pei H X,Wang X M,Gao J X,et al. Phenotypic geneticdiversity analysis on pepper cultivars (strains) in Ningxia[J].Journal of Northeast Agricultural University,2018,49(10):26-33.
[23]李宁,王飞,姚明华,等. 国内外辣椒种质资源表型性状多样性及相关性分析[J]. 辣椒杂志,2015,13(1):8-13.
Li N,Wang F,Yao M H,et al. Genetic diversity andcorrelation analysis of phenotype traits in Capsicum spp.germplasms from China and abroad[J]. Journal of ChinaCapsicum,2015,13(1):8-13.
[24]Kim E H,Lee S Y,Baek D Y,et al. A comparison of thenutrient composition and statistical profile in red pepper fruits(Capsicums annuum L.) based on genetic and environmentalfactors[J]. Applied Biological Chemistry,2019,62(1):48.
[25]徐睿,张雅楠,林子翔,等. 观赏辣椒种质资源农艺性状遗传多样性关联分析[J]. 浙江农业学报,2018,30(11):1886-1892.
Xu R,Zhang Y N,Lin Z X,et al. Analysis in agronomiccharacters of ornamental pepper germplasm resources[J]. ActaAgriculturae Zhejiangensis,2018,30(11):1886-1892.
[26]裴红霞,高晶霞,王学梅. 220 份辣椒种质形态学性状的遗传多样性分析[J]. 分子植物育种,2022,20(4):1331-1347.
Pei H X,Gao J X,Wang X M. Genetic diversity analysis ofmorphological traits in 220 pepper germplasm accessions[J].Molecular Plant Breeding,2022,20(4):1331-1347.
[27]王丹丹,师建华,李燕,等. 基于主成分与聚类分析的辣椒主要农艺性状评价[J]. 中国瓜菜,2021,34(2):47-53.
Wang D D,Shi J H,Li Y,et al. Evaluation of main agronomictraits of pepper based on principal component and clusteranalysis[J]. China Cucurbits and Vegetables,2021,34(2):47-53.
[28]彭泽,胡明文,白立伟,等. 不同辣椒品种的农艺性状与品质指标综合评价[J]. 北方园艺,2023(1):1-10.
Peng Z,Hu M W,Bai L W,et al. Comprehensive evaluation ofagronomic characters and quality indexes of different peppervarieties[J]. Northern Horticulture,2023(1):1-10.
[29]Bijalwan P,Singh M,Madhavi N. Assessment of geneticdivergence in chilli (Capsicum annuum L.) genotypes[J].International Journal of Current Microbiology and AppliedSciences,2018,7(3):1585-1590.
(编辑:吕俊俐)
基金项目:山西省重点研发计划项目(202102140601014;202202140601006);山西省科技创新人才团队专项(20230451001018)

