羚牛IFN-γ基因克隆、生物信息学分析与原核表达


摘 要 旨在研究羚牛γ干扰素(IFN-γ)基因结构与功能,为进一步增强羚牛的免疫调节能力提供理论依据。通过RT-PCR方法克隆羚牛IFN-γ基因,并运用多种生物信息学分析工具对其结构与功能进行深入研究。将IFN-γ基因序列连入原核表达载体,并转化大肠杆菌诱导表达。结果显示,羚牛IFN-γ cDNA序列全长501 bp,编码166个氨基酸。蛋白高级结构预测结果显示,二级结构以α螺旋为主,存在13个磷酸化修饰位点,并含有1个信号肽、1个低度复杂区、1个跨膜结构域及1个IFN-γ结构域,其中IFN-γ结构域位于胞外区。序列比对分析发现其与绵羊、山羊、家牛、水牛、人、黑猩猩、小鼠、鸡的核苷酸序列同源性分别为" 99.0%、98.8%、97.2%、96.2%、75.8%、75.4%、64.1%、54.1%,氨基酸序列同源性分别为99.4%、99.4%、" 95.8%、95.8%、62.7%、62.7%、43.9%、33.5%。系统进化树分析结果显示,羚牛与山羊、绵羊的亲缘关系最近。经SDS-PAGE和Western-blot检测发现,重组IFN-γ蛋白以可溶性形式大量表达,分子质量约为34 ku。通过密码子优化及不同浓度IPTG诱导表达等原核表达优化策略发现,密码子优化能促进重组蛋白的高效表达,且最佳诱导浓度为0.9 mmol·L-1。
关键词 羚牛;IFN-γ;基因克隆;生物信息学分析;原核表达;IPTG诱导
羚牛又称扭角羚,因其体形粗壮如牛,叫声似羚羊,故名羚牛。据估计,全球现存羚牛数量约为7 000~12 000头,是国家Ⅰ级重点保护动物,被《世界自然保护联盟濒危物种红色名录》列为易危级(UV)物种[1]。近年来随着人类活动范围的增加,羚牛适宜生境面积不断缩减[2]。在抵御病虫害方面,已在羚牛中发现16个寄生虫物种[3],对羚牛的生存造成了极大的威胁。较其他反刍动物而言,羚牛对禽分枝杆菌亚种副结核也具有更高的易感性[4]。这些因素导致了羚牛免疫调节能力下降,给羚牛的保护带来了挑战。
干扰素(interferon,IFN)是天然免疫反应中的关键细胞因子。正常情况下,IFN基因处于抑制状态。在特异性或非特异性诱生剂刺激下,激活一些与IFN基因活性相关的蛋白,从而解除IFN基因的抑制状态,启动IFN的转录和翻译。其本身不具有杀灭细菌病毒的能力,但能通过旁分泌信号级联反应诱导临近未感染细胞表达抗病毒蛋白,间接干扰病毒的复制[5]。按其受体类型和功能特性可分为Ⅰ型、Ⅱ型和Ⅲ型干扰素。Ⅰ型干扰素在抗病毒、抗增殖反应以及调节细胞存活与凋亡等方面发挥着至关重要的作用,Ⅲ型干扰素具有抗病毒反应及黏膜免疫的功能[6],Ⅱ型干扰素(也称为γ干扰素)则主要在免疫调节上发挥作用。γ干扰素与临近未被感染细胞的γ干扰素受体结合,通过JAK-STAT信号级联反应调控抗病毒蛋白的表达,阻止病毒基因的转录和翻译从而发挥抗病毒的作用[7];它可以刺激树突状细胞的杀伤活性,促进NO等细胞毒性产物的释放,进而杀伤细胞内微生物[8];它还能促进抗原呈递细胞表面MHC类分子表达,从而增强细胞免疫应答[9];此外,γ干扰素还具有直接抑制肿瘤细胞增殖的效应[10]。在体外,γ干扰素制剂也逐渐成为动物疾病诊断与治疗的一种有效手段[11]。然而迄今为止关于羚牛的研究多集中在其活动节律、种群结构与生境利用等行为生态学方面[12-14],关于分子遗传学的研究也多聚焦于线粒体基因组、肠道微生物等方面[15-16],关于羚牛IFN-γ的基因信息及其重组蛋白制备研究尚属空白。
本研究通过对羚牛IFN-γ进行基因克隆、生物信息学分析及原核表达,进一步研究羚牛γ干扰素的结构与功能,为后期生产羚牛γ干扰素免疫佐剂、增强羚牛免疫力及疾病治疗奠定基础。
1 材料与方法
1.1 材料及试剂
羚牛组织样来自秦岭大熊猫研究中心(陕西珍稀野生动物救助基地)。RNA抽提试剂Trizol购自Invitrogen公司;PrimeScript RT Reagent Kit with DNA Eraser反转录试剂盒、PrimeSTARMax酶、DNA胶回收试剂盒、pMD19-T、DNA A-Tailing 试剂盒均购自TaKaRa公司;pET-32a(+)载体、IPTG、细菌蛋白裂解液、考马斯亮蓝染色液、兔抗6×His多克隆抗体、HRP 标记的山羊抗兔IgG (HRP-IgG)均购自生工生物工程(上海)股份有限公司;超敏化学发光显色试剂盒购自Uelandy公司;12% Western blotting快速制胶试剂盒购自Bio-Rad公司。
1.2 方法
1.2.1 引物设计 参考GenBank中羚牛近缘绵羊IFN-γ(NM_001009803.1)基因序列,在基因编码区两侧高度保守的区域设计一对特异性引物,引物序列为IFN-γ-F:5′-ACTCCGGCCTAACTCTCTCC-3′;IFN-γ-R:5′-GCAGGCAGGA- GGACCATTA-3′。引物由生工生物工程(上海)股份有限公司合成。
1.2.2 RNA提取和IFN-γ基因克隆 采用Trizol试剂提取羚牛肝脏组织总RNA,并反转录合成cDNA。以cDNA为模板进行PCR扩增,PCR扩增体系25 μL:上下游引物各1 μL,PrimeSTAR Max酶12.5 μL,模板1 μL,补加灭菌水至25 μL。PCR反应条件:98 ℃预变性15 s;" 98 ℃变性10 s;56 ℃退火5 s;72 ℃延伸6 s,共33个循环;72 ℃延伸5 min。PCR扩增结束后取扩增产物进行琼脂糖凝胶电泳,确定目的片段的大小。采用DNA胶回收试剂盒回收特异性扩增的片段。
按照TakaRa DNA A-Tailing Kit说明书在PCR产物的3′末端添加“A”尾,并与pMD19-T载体连接。将连接产物转化DH5α感受态细胞" 37" ℃培养过夜,然后挑单克隆送擎科生物技术有限公司测序。
1.2.3 生物信息学分析 从GenBank中获取山羊、绵羊、水牛、家牛、人、黑猩猩、小鼠、鸡等物种IFN-γ基因的开放阅读框序列及氨基酸序列,利用DNA Star-Meg Align软件对扩增得到的羚牛及其他物种进行核苷酸及氨基酸同源性分析。利用MEGA 7.0软件以邻接法(Neighbor-Joining,NJ)构建IFN-γ基因在上述9个物种中的系统进化树,Bootstrap重复值设置为1 000。利用在线软件NetPhos 3.1 Server(https://services.healthtech.dtu.dk/services/NetPhos-3.1/)对羚牛IFN-γ的氨基酸序列进行磷酸化位点预测分析。使用Protean软件以Hopp-Woods算法分析IFN-γ蛋白亲水性、Karplus-Schulz算法分析蛋白柔韧性、Emini算法分析蛋白表面可及性以及Jameson-Wolf算法分析蛋白抗原指数,并结合蛋白二级结构预测IFN-γ的B细胞抗原表位。用在线软件MEME (http://meme-suite.org)、SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)、SWISS-MODEL(https://swissmodel.expasy.org/)、SMART(http://smart.embl.de/)和TMHMM Server v.2.0 (https://services.healthtech.dtu.dk/services/TMHMM-" 2.0/) 预测分析羚牛IFN-γ蛋白超二级结构、二级结构、三级结构、保守结构域以及跨膜结构。
1.2.4 羚牛IFN-γ原核表达 分析克隆得到的羚牛IFN-γ基因序列,对该序列进行密码子优化,并将优化前后的序列连接入pET-32a(+)原核表达载体的NcoⅠ和XhoⅠ酶切位点,分别命名为pET32a-IFNG-wt和pET32a-IFNG-op。将上述质粒转化BL21(DE3)感受态细胞,培养过夜后挑取单个菌落至含氨苄青霉素的LB液体培养基中,于37 ℃,200 r·min-1恒温摇床培养过夜。随后按1∶100(菌液∶培养基)的体积比例扩大培养至菌液OD600nm值为0.4~0.6。最后向菌液中加入终浓度为0.3 mmol·L-1、0.6mmol·L-1、0.9 mmol·L-1的IPTG,37 ℃诱导表达4 h。
1.2.5 重组蛋白的提取与鉴定 分别收集诱导前、诱导后4 h的菌液1 mL,8 000 r·min-1离心1 min,收集菌体沉淀。采用细菌蛋白裂解液裂解细菌,然后12 000 r·min-1于4 ℃离心" 5 min,吸取上清,通过BCA法测定蛋白浓度。将上清液按照4∶1体积比加入蛋白上样缓冲液,于100 ℃金属浴热变性10 min后进行12% SDS-PAGE电泳,通过考马斯亮蓝染色,鉴定重组蛋白的表达情况。
1.2.6 重组蛋白的Western blot鉴定 将提取的目的蛋白经SDS-PAGE电泳后转印于PVDF膜上。转印后用1×TBST漂洗2次,每次10 min。加入封闭液,室温封闭2 h。封闭结束后用1×TBST漂洗3次。之后加入1∶4 000倍稀释的6×His兔多克隆抗体,4 ℃孵育过夜。用1×TBST漂洗3次后加入1∶5 000倍稀释的HRP标记的羊抗兔二抗,室温孵育2 h。再用1×TBST漂洗3次,取出PVDF膜,用滤纸沥干水分,按照Super ECL Plus超敏化学发光检测试剂盒说明书加入显色底物显色,ChemiDoc化学发光成像系统进行蛋白成像。
2 结果与分析
2.1 羚牛IFN-γ基因克隆
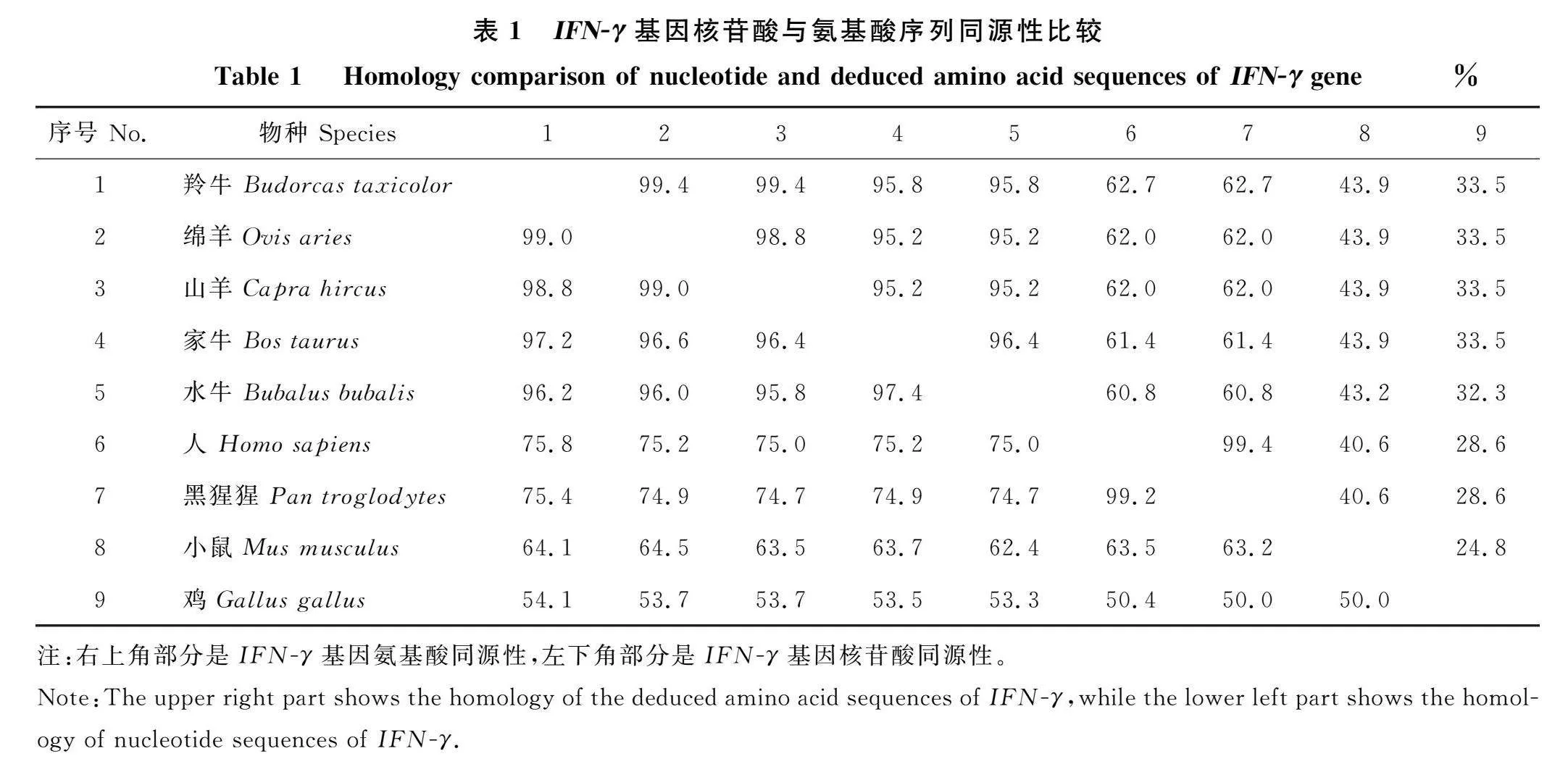
通过RT-PCR方法特异性扩增得到羚牛肝组织IFN-γ mRNA片段。经琼脂糖凝胶电泳检测发现,在500 bp左右出现一条特异性条带(图1)。对扩增产物回收并克隆至T载体,测序结果显示,羚牛IFN-γ扩增片段全长501 bp,编码166个氨基酸。核苷酸序列与GenBank公布的绵羊IFN-γ序列同源性为99.0%,说明成功克隆到羚牛IFN-γ基因。
2.2 生物信息学分析
2.2.1 IFN-γ序列同源性分析 将羚牛IFN-γ核苷酸序列及氨基酸序列与GenBank中其他参考物种进行同源性比对(表1),结果表明羚牛与绵羊(NM_001009803.1)、山羊(NM_001285682.1) 、家牛(NM_174086.1)、水牛(NM_001290905.1)等物种IFN-γ基因的序列同源性较高,核苷酸序列同源性分别为99.0%、98.8%、97.2%、96.2%,氨基酸序列同源性分别为" 99.4%、99.4%、95.8%、95.8%。与绵羊相比,羚牛核苷酸序列存在T9C、T318C、A350G、A399C、C482G突变,其中A350G为错义突变(K117R)。比对结果表明反刍动物间IFN-γ核苷酸及氨基酸序列具有高度的保守性。而羚牛与人(NM_000619.3)、黑猩猩(NM_001193665.1)、小鼠(NM_008337.4)、鸡(NM_205149.2)等物种IFN-γ的核苷酸同源性较低,分别为75.8%、" 75.4%、64.1%、54.1%,氨基酸同源性分别为" 62.7%、62.7%、43.9%、33.5%,说明由于种属间的差异,羚牛与亲缘关系较远的单胃动物的IFN-γ基因序列存在较大差异。
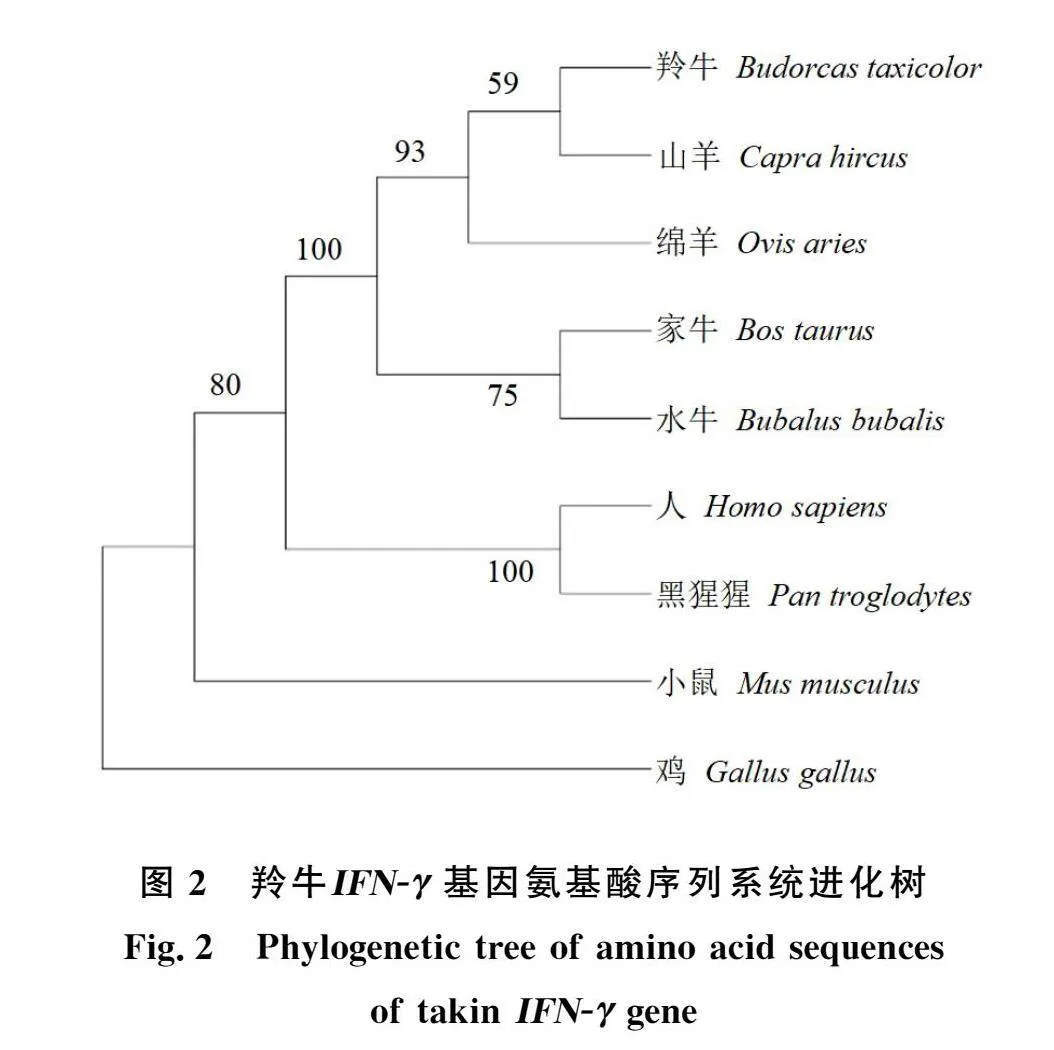
2.2.2 基于IFN-γ氨基酸序列的物种系统进化树构建 IFN-γ氨基酸序列在不同物种间的同源性有所差异,为了更加直观地展现不同物种间IFN-γ的进化关系,利用MEGA 7.0软件构建羚牛与其他物种IFN-γ氨基酸序列的系统进化树,结果如图2。羚牛先与山羊聚为一类,然后再与绵羊、水牛、家牛、人、黑猩猩、小鼠、鸡等聚类。这说明羚牛与山羊、绵羊的亲缘关系最近,其次是偶蹄目中的家牛、水牛,再是人和黑猩猩,然后是啮齿目的小鼠,与鸡的亲缘关系最远,这一结果符合物种进化规律,表明IFN-γ可作为构建物种系统进化树、反映物种间遗传进化关系的候选基因之一。
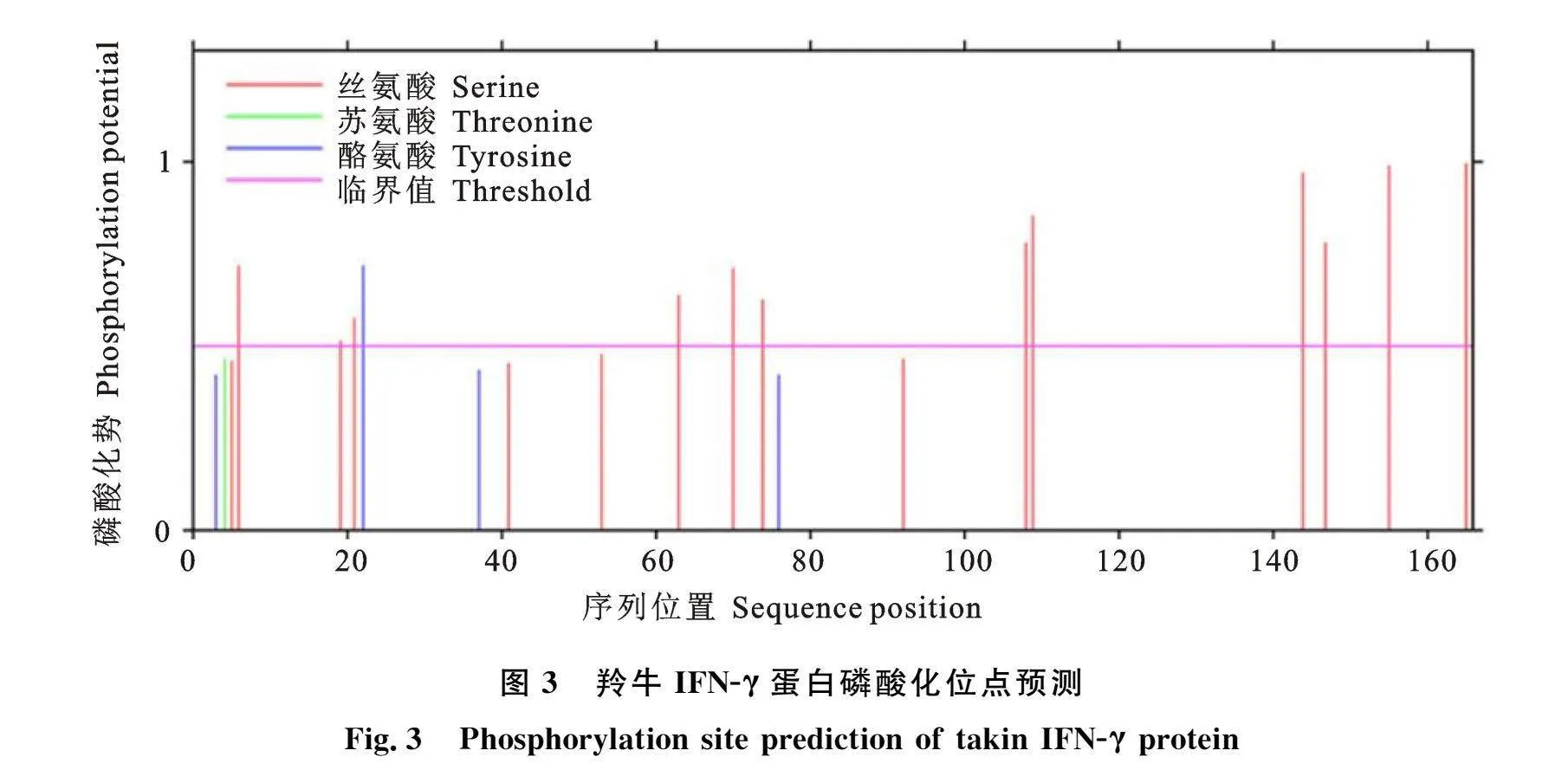
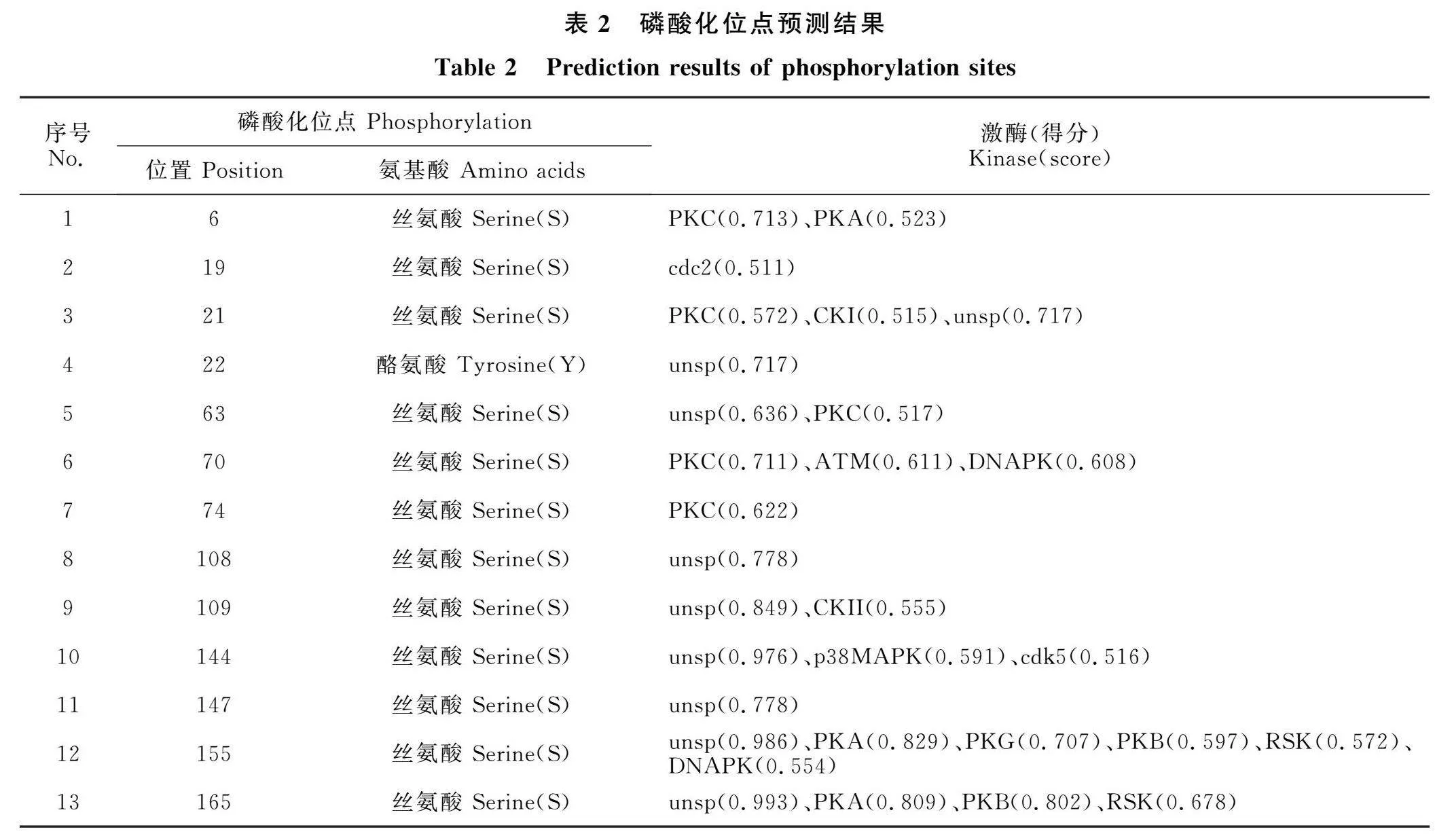
2.2.3 IFN-γ蛋白磷酸化位点分析 磷酸化是真核生物蛋白质翻译后修饰的重要过程,具有调节蛋白质功能的作用。利用NetPhos 3.1 Server对IFN-γ蛋白磷酸化位点的预测结果显示(图3、表2),羚牛IFN-γ蛋白上存在13个潜在的磷酸化修饰位点(评分gt;0.5),包括12个丝氨酸位点和1个酪氨酸位点。这些位点主要受到非特异性激酶(unsp,8 个)、蛋白激酶(PKC,5 个;PKA,3 个;PKB,2 个;PKG,1 个)、细胞周期蛋白依赖性激酶(CDK5,1 个)、酪蛋白激酶(CKⅡ,1 个;CKⅠ,1 个)、p38MAPK(1 个)、CDC2(1 个)、ATM(1 个)、DNAPK(2 个)、RSK(2 个)等蛋白磷酸化激酶修饰。其中DKⅠ、CKⅡ、CDC2、CDK5、DNAPK、p38MAPK、RSK等激酶是细胞周期调控及DNA损伤修复过程中的关键激酶,提示IFN-γ蛋白的磷酸化修饰很有可能与细胞增殖调控有关。
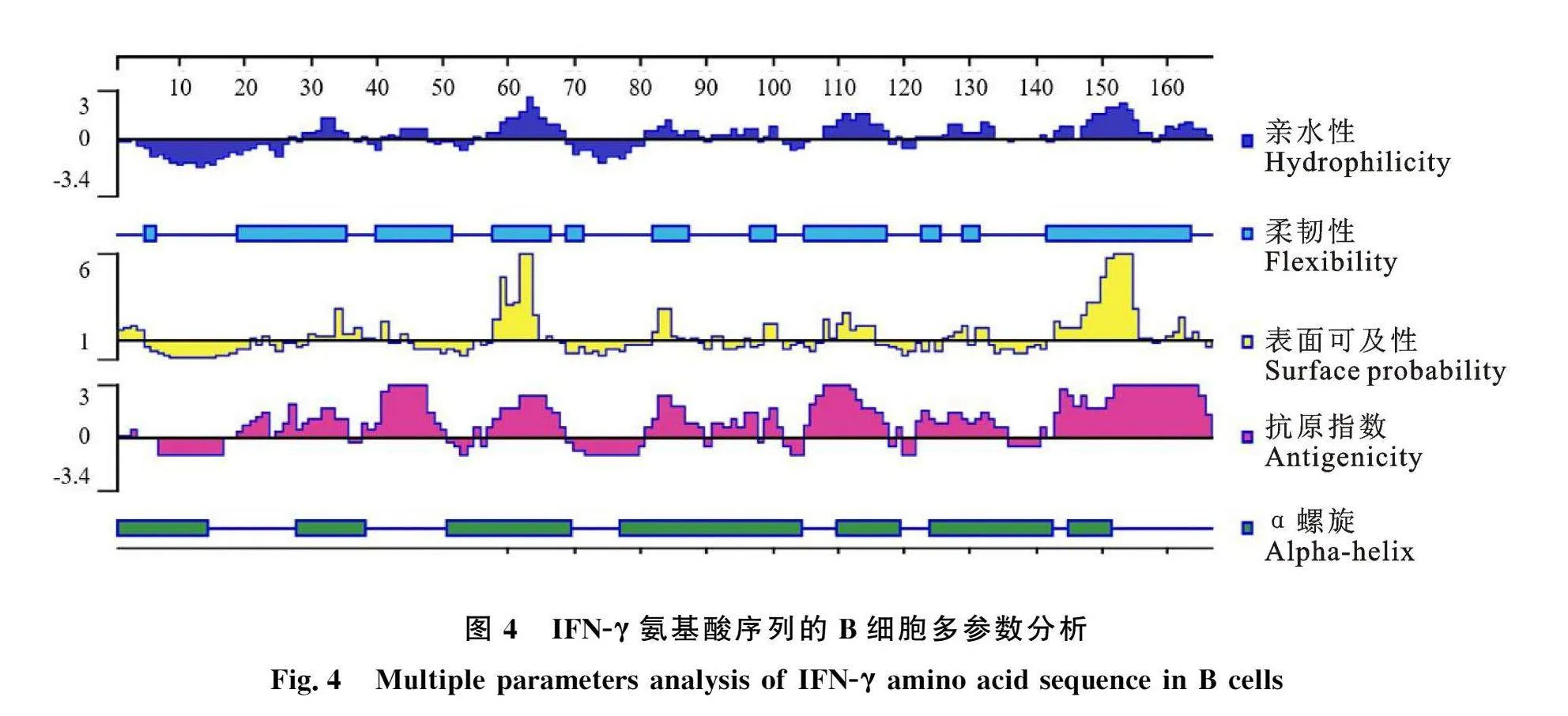
2.2.4 IFN-γ蛋白质B细胞抗原表位预测 利用Protean软件对羚牛IFN-γ蛋白亲水性、柔韧性、表面可及性、抗原指数进行分析,结果显示IFN-γ蛋白存在6个潜在的B细胞抗原表位(图4),分别为62~66、83~86、108~109、144~147、153~157、160~163位氨基酸。
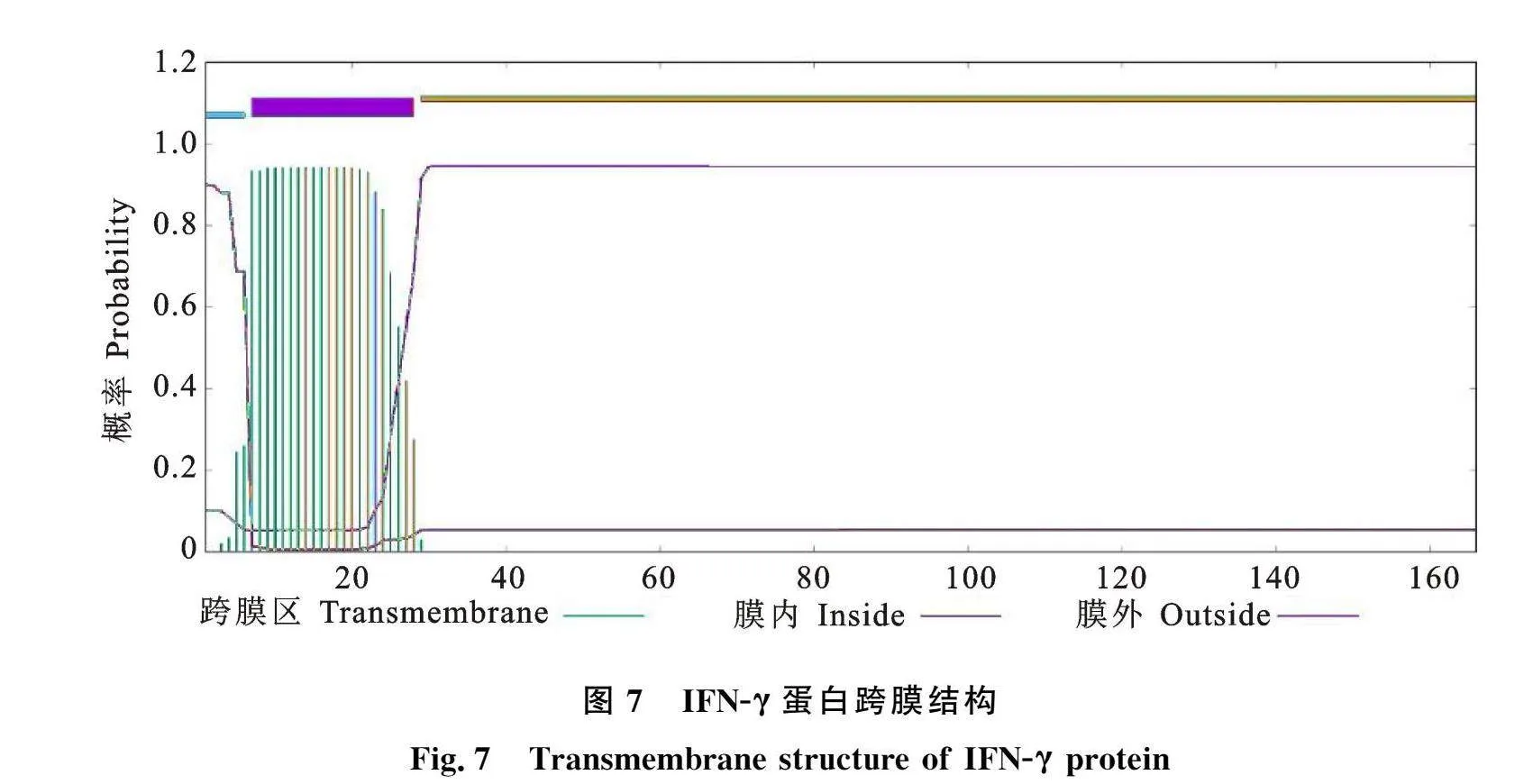
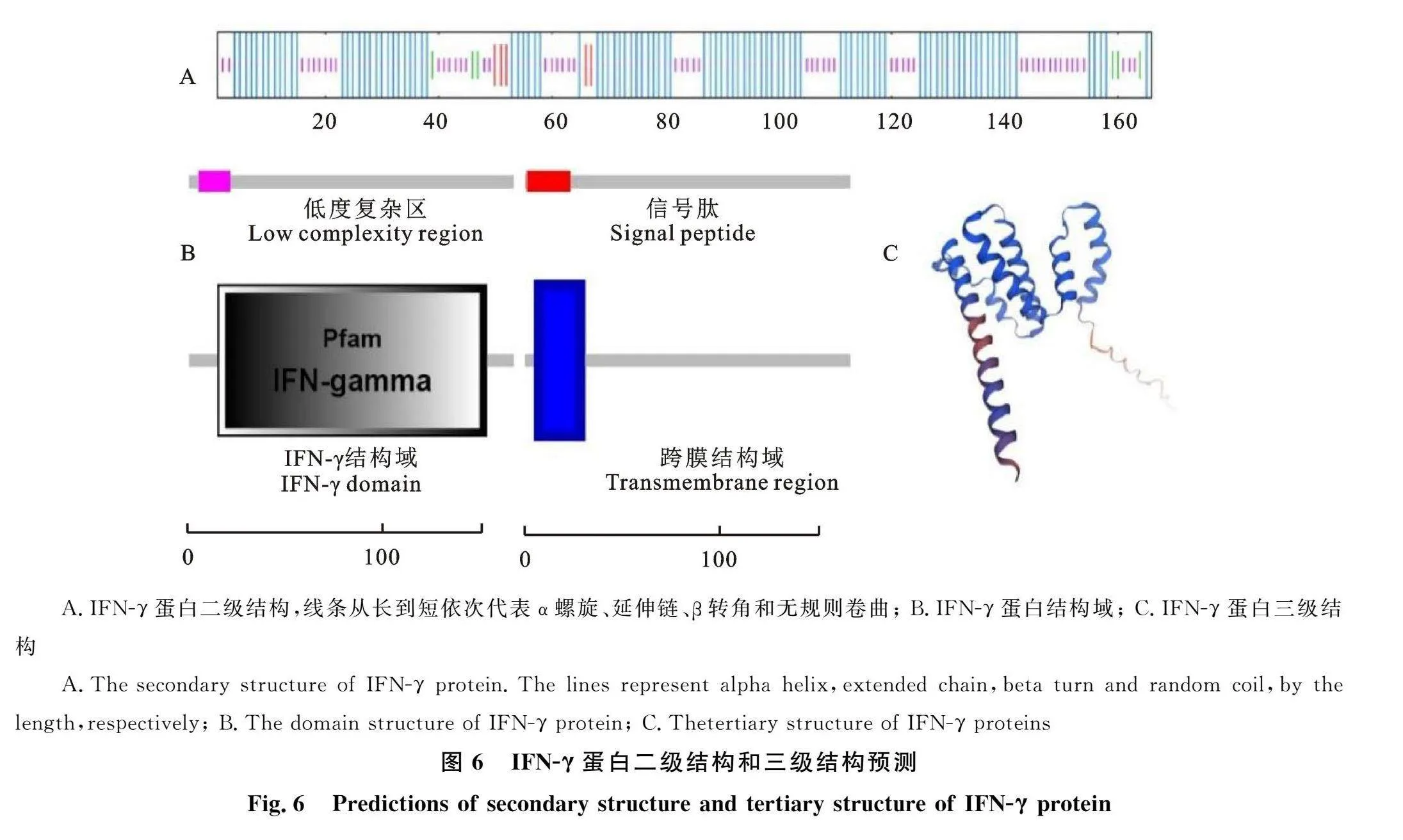
2.2.5 IFN-γ蛋白质结构预测分析 应用MEME在线工具预测羚牛IFN-γ蛋白超二级结构发现,羚牛与山羊、绵羊、家牛、水牛IFN-γ的超二级结构高度保守(图5),均存在4个相似的模体(motif)。在人与黑猩猩中均存在3个相似的模体。而在小鼠和鸡中模体差异较大,尤其是鸡,与羚牛没有相似的motif。蛋白二级结构预测结果显示羚牛IFN-γ蛋白二级结构主要由α螺旋构成,中间夹杂有无规则卷曲(33.13%)、少量延伸链(3.01%)与β转角(3.61%)(图6-A)。蛋白三级结构模拟结果如图6-C所示,该蛋白主要由α螺旋构成,与二级结构预测结果基本一致。随后对羚牛IFN-γ蛋白结构域进行分析发现,其含有1个低度复杂区(5~21 位氨基酸)、1个跨膜结构域(7~28 位氨基酸)、1个信号肽结构域(1~23 位氨基酸)以及1个IFN-γ结构域(15~152 位氨基酸)(图6-B)。由此可知,IFN-γ是分泌蛋白且存在跨膜结构,经过翻译后修饰过程分泌到细胞外发挥其生物学功能。进一步用TMHMM Server v.2.0对跨膜结构进行分析,发现蛋白存在一个跨膜结构,其1~6 位氨基酸为胞内区域," 7~28 位氨基酸为跨膜区域,28~166 位氨基酸为胞外区域,该区域即为IFN-γ成熟肽序列" (图7)。
2.3 重组质粒构建及测定
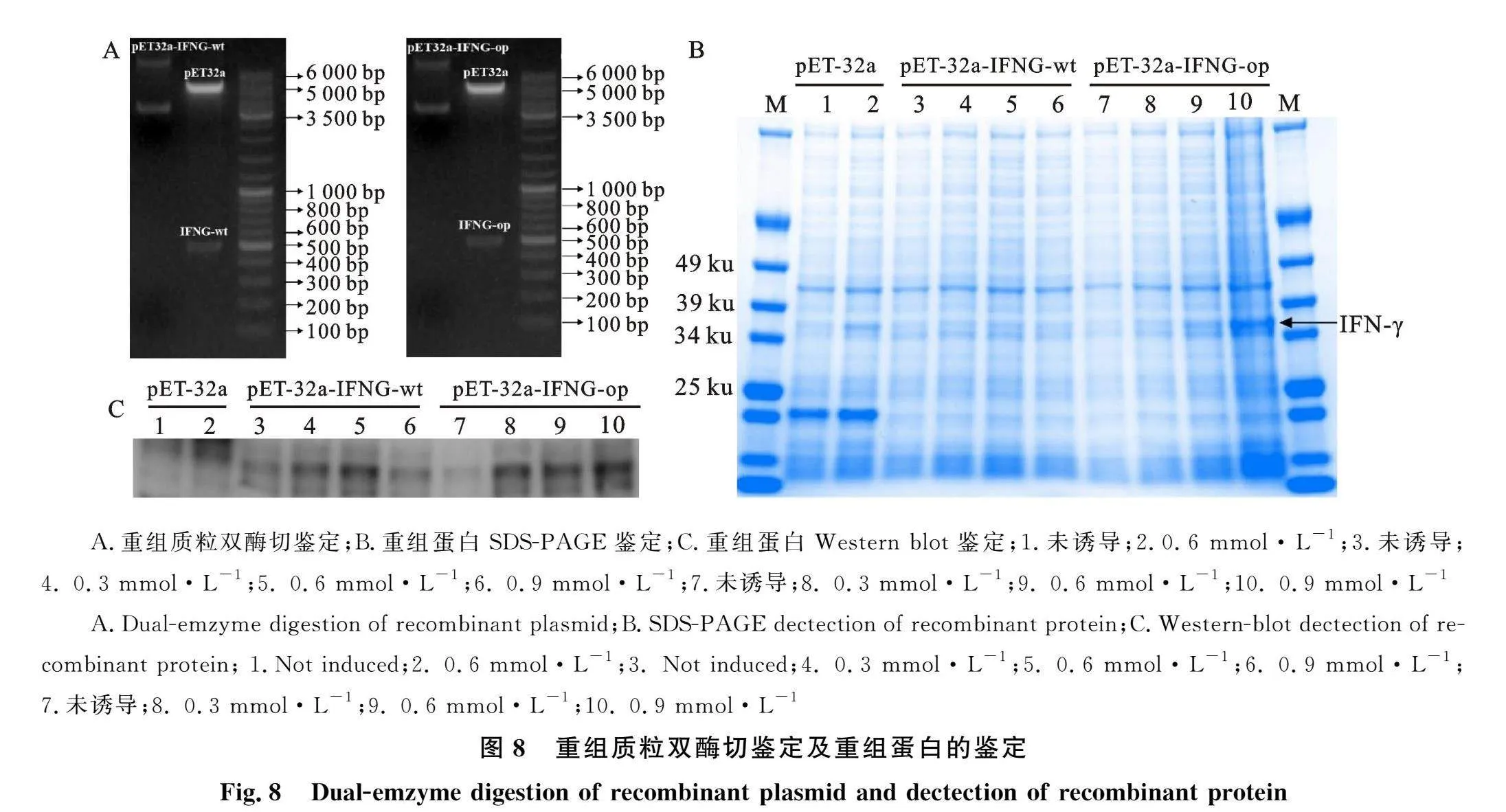
对测序得到的羚牛IFN-γ基因序列进行密码子优化,将优化前后的序列分别连接入pET-32a(+)载体,经过生物合成得到重组质粒。并根据重组质粒的测序结果,利用DNAMAN软件对重组质粒进行酶切位点分析发现,IFNG-wt和IFNG-op基因序列正确连入pET-32a(+)载体,经NcoⅠ和XhoⅠ双酶切可得到507 bp目的基因条带和5.8k bp的载体条带(图8-A),说明原核表达载体构建成功。
2.4 重组蛋白的鉴定
利用IPTG诱导重组蛋白表达,经SDS-PAGE分析发现,重组的融合蛋白在34 ku 处出现特异性条带(图8-B),与预测结果一致。Western blot鉴定结果表明,重组的融合蛋白与6×His多克隆抗体结合,在34 ku 处有特异性条带(图8-C),在原核表达系统中正确表达。此外,Western blot结果显示密码子未优化组蛋白表达量随着IPTG浓度的升高呈现出先增加后降低的趋势,在0.6 mmol·L-1处达到最高。而密码子优化组中IPTG浓度越高蛋白表达量越多,最佳诱导浓度为0.9 mmol·L-1。整体而言,IFNG-op蛋白表达量较IFNG-wt有所增加,说明密码子优化能够促进重组蛋白在大肠杆菌中的表达。
3 讨" 论
IFN-γ作为天然免疫佐剂,能够增强疫苗的免疫效果[17],在抗细菌感染等方面也具有广阔的应用前景[18]。然而天然IFN-γ含量极少,并且存在较强的种属特异性[19],使用其他物种的IFN-γ免疫制剂治疗羚牛的疾病可能会引发不良反应。因此利用基因工程技术研究与开发羚牛IFN-γ对羚牛保护工作的开展是十分必要的。
本研究成功克隆到羚牛IFN-γ cDNA序列,对该序列进行分析发现,其核苷酸和氨基酸序列比较保守,尤其与山羊、绵羊、家牛、水牛等反刍动物同源性较高。蛋白空间结构上,反刍动物IFN-γ蛋白以α螺旋为主,存在一个信号肽、跨膜区、低度复杂区以及IFN-γ结构域,4个motif高度保守。相反地,在人、黑猩猩、小鼠、鸡等物种中由于与羚牛存在种属变异,其IFN-γ蛋白结构存在较大差异,并且随着亲缘关系的疏远,蛋白结构差异越大,这与前人的研究一致[20]。根据蛋白B细胞抗原表位参数筛选得到6个抗原表位,与温贵兰等[20]在猪上的报道结果大致相同,为研究IFN-γ与B细胞相互作用提供了依据,也为后续开发和利用羚牛IFN-γ抗体提供参考。羚牛IFN-γ蛋白共发现13个磷酸化修饰位点,主要受细胞周期调控相关激酶修饰,推测IFN-γ可能受到这些位点的磷酸化并参与细胞增殖调控[21]。进一步对不同物种磷酸化位点变异进行分析,第19、21、108、109、147位的丝氨酸(S)在人、黑猩猩、小鼠、鸡等物种中均发生了突变,导致该处磷酸化位点丢失,而该位点在牛、山羊、绵羊、水牛、家牛上均有所体现,很有可能是反刍动物所特有的位点。综合以上结果,推测反刍动物IFN-γ蛋白翻译后修饰、跨膜转运、JAK-STAT信号转导及诱导抗原呈递等机制类似,因此可以将其他物种IFN-γ的研究方法应用于羚牛中,以期为羚牛IFN-γ的研究和保护提供启示与借鉴。
在分类学上,对羚牛的归属仍然存在争议。Li等[22]构建的线粒体基因组水平的系统进化树显示羚牛大概在1006万年前从绵羊和山羊的祖先中分离出来。任轶等[23]将羚牛Cyt b基因与山羊、绵羊、麝牛属动物进行序列分析并构建了系统发育进化树,发现羚牛与绵羊的亲缘关系最密切,其次是山羊、麝牛。而Zhou等[24]报道了羚牛完整线粒体基因组,根据其10个蛋白质编码基因和2个rRNA基因重建了13个牛科代表物种的系统发育进化树,发现羚牛与山羊属、岩羊属的亲缘关系比盘羊属更亲近。本研究通过NJ法构建了IFN-γ在羚牛与其他物种中的系统发育进化树,发现羚牛先与山羊聚类,再与绵羊分支合并。这一结果为与绵羊相比羚牛与山羊亲缘关系更近的观点提供了支撑依据。
本研究在对羚牛IFN-γ进行原核表达时,采用了pET-32a(+)载体,并以大肠杆菌为宿主进行诱导表达。由于大肠杆菌遗传背景明了清晰,且具有成本低廉、易于培养、表达稳定等优点[25],基因工程中广泛使用大肠杆菌等原核表达系统来表达外源蛋白[26]。李小凤等[27]采用大肠杆菌表达水牛IFN-γ发现重组目的蛋白以可溶性形式大量表达。Ma等[28]通过构建原核表达重组载体,正确表达出了山羊IFN-γ重组蛋白,并制备了针对山羊IFN-γ的单克隆抗体。考虑到真核细胞和原核细胞密码子偏好性不同,本研究对羚牛IFN-γ基因密码子进行了优化,探讨密码子优化前后重组蛋白表达量是否有差异。此外,研究显示诱导浓度对原核表达的影响也不可忽视[29]。为了进一步提高重组蛋白的表达量,本研究设置了不同IPTG诱导浓度以探索羚牛IFN-γ基因的最佳诱导浓度。结果表明,重组目的蛋白以可溶性形式正确表达,优化组蛋白表达量比未优化组高,并且在0.9 mmol·L-1 IPTG诱导下优化的IFN-γ蛋白表达量可达到最高水平。猜测密码子优化可能通过影响IFN-γ基因mRNA稳定性、翻译延伸速率等方式,有效提高了外源蛋白原核表达的效率[30]。
4 结" 论
本研究通过RT-PCR方法成功克隆到羚牛IFN-γ基因mRNA序列,全长501 bp,编码166个氨基酸。生物信息学分析发现IFN-γ序列及结构在反刍动物中高度保守,与绵羊相比IFN-γ核苷酸序列同源性达99%,存在4 个同义突变和1 个错义突变(K117R);羚牛IFN-γ蛋白是分泌蛋白,主要由α螺旋构成,含有一个跨膜结构,与绵羊、山羊、家牛、水牛等反刍动物具有4 个相似的motif,受到CDK5、DNAPK、p38MAPK、RSK等多种细胞周期调控相关激酶的磷酸化修饰,经多个抗原指数分析筛选到6 个B细胞抗原表位区域。构建的原核表达载体经IPTG诱导,IFN-γ重组蛋白以可溶性形式正确表达,密码子优化后重组蛋白最佳诱导浓度为 0.9 mmol·L-1。
参考文献 Reference:
[1] 李安宁,邱 菊,郑 燕,等.秦岭羚牛的保护生物学研究进展[J].西北农业学报,202 30(8):1113-1121.
[2]CUI X Y,TANG J F,ZHANG Q,et al.Spatio-temporal variations in takin (Budorcas tibetanus) habitats in the five mountains of Sichuan,China[J].Global Ecology and Conservation,2023,42:e02390[2023-1-26].https://doi.org/10.1016/j.gecco.2023.e02390.
[3]刘世修.中国羚牛的寄生虫名录[J].野生动物,1994(6):38-39.
[4]NAYLOR A D,RICHARDSON D,SELLAR M,et al.Clinical signs,antemortem diagnostics,and pathological findings associated with Mycobacterium Avium Subspecies Paratuberculosis infection in Mishmi takin ( Budorcas taxicolor taxicolor )[J].Journal of Zoo and Wildlife Medicine,2018,49(2):412-419.
[5]MERTOWSKA P,SMOLAK K,MERTOWSKI S,et al.Immunomodulatory role of interferons in viral and bacterial infections[J].International Journal of Molecular Sciences,2023,24(12):10115[2023-6-14].http://doi:10.3390/ijms241210115.
[6]庞立丽,段招军,罗迪贤,等.干扰素作用机制的研究进展[J].皮肤科学通报,202 38(6):485-49 2.
[7]DING G Y,ZHENG CH W,WANG B,et al.Transcriptome sequencing reveals the antiviral innate immunity by IFN-γ in Chinese sturgeon macrophages[J].Frontiers in Immunology,2022,13:854689[2022-3-17].http://doi:10.3389/fimmu.2022.854689.
[8]LACASSE C J,JANIKASHVilI N,LARMONIER C B,et al.Th-1 lymphocytes induce dendritic cell tumor killing activity by an IFN-γ-dependent mechanism[J].Journal of Immunology,201 187(12):6310-6317.
[9]JIANG Y R,YAO J W,YAO ZH X,et al.CD4 T cells in chronic myeloid leukemia present MHC class II-dependent and IFN-γ-dependent cytotoxic capacity[J].Medical Oncology,2023,40(9):253[2023-7-27].http://doi:10.1007/s12032-023-02123-5.
[10] MATSUSHITA H,HOSOI A,UEHA S,et al.Cytotoxic T lymphocytes block tumor growth both by lytic activity and IFNγ-dependent cell-cycle arrest [J].Cancer Immunology Research,2015,3(1):26-36.
[11]刘蒙达,王晓文,张皓博,等.γ干扰素体外释放试验在人和动物结核病诊断中的研究进展[J].中国兽医杂志,2023,59(3):91-97.
[12]成 功,任宏涛,陈嘉玥,等.陕西秦岭地区珍稀野生动物保护研究现状及保护对策[J].陕西林业科技,2020,48(6):74-79.
[13]管 晓,瞿桂英,唐 卓,等.卧龙国家级自然保护区羚牛种群结构研究[J].四川林业科技,202 42(2):33-39.
[14]陈 超,和晓阳,薛亚东.云南高黎贡山国家级自然保护区羚牛生境选择[J].林业资源管理,2019(4):151-158.
[15]KUMAR A,GAUTAM K B,SINGH B,et al.Sequencing and characterization of the complete mitochondrial genome of Mishmi takin ( Budorcas taxicolor taxicolor ) and comparison with the other Caprinae species[J].International Journal of Biological Macromolecules,2019,137:87-94.
[16]兰阿峰,杨" 曼,郭素芬,等.野生秦岭羚牛瘤胃产甲烷古菌多样性研究[J].安徽农业科学,2018,46(8):88-91.
[17]涂 浩,赵星灿,杨占娜,等.猪重组IL-2、IL-4和IFN-γ对口蹄疫合成肽疫苗的免疫增强作用研究[J].畜牧兽医学报,2015,46(8):1390-1399.
[18]LIU Y,ZHANG H Y,DONG SH SH,et al.Secretion of IFN-γ by transgenic mammary epithelial cells in vitro reduced mastitis infection risk in goats[J].Frontiers in Veterinary Science,2022,9:89863[2022-6-24].http://doi:10.3389/fvets.2022.898635.
[19]丰宗洋,陈书明.干扰素的研究及应用[J].畜牧与兽医,2012,44(S1):47-51.
[20]温贵兰,陈绍品,张升波,等.从江香猪γ干扰素基因克隆与序列分析[J].中国畜牧兽医,2018,45(6):1437-1446.
[21]KULKARNI A,SCULLY T J,O'DONNELL L A.The antiviral cytokine interferon-gamma restricts neural stem/progenitor cell proliferation through activation of STAT1 and modulation of retinoblastoma protein phosphorylation[J].Journal of Neuroscience Research,2017,95(8):1582-1601.
[22]LI A N,YANG Q M,LI R,et al.Chromosome-level genome assembly for takin (Budorcas taxicolor) provides insights into its taxonomic status and genetic diversity.[J].Molecular Ecology,2022,32(6):1323-1334.
[23]任 轶,冯 慧,冯成利,等.应用线粒体DNA序列探讨羚牛分类地位[J].基因组学与应用生物学,2012,31(5):481-484.
[24]ZHOU M,YU J J,LI B,et al.The complete mitochondrial genome of Budorcas taxicolor tibetana (Artiodactyla:Bovidae) and comparison with other Caprinae species:Insight into the phylogeny of the genus Budorcas[J].International Journal of Biological Macromolecules,2018,121:223-232.
[25]YIN J CH,LI G X,REN X F,et al.Select what you need:A comparative evaluation of the advantages and limitations of frequently used expression systems for foreign genes[J].Journal of Biotechnology,2006,127(3):335-347.
[26]徐菁昱,刘艳芬,陈绍红,等.山羊α-干扰素基因克隆、原核表达及其抗病毒活性研究[J].西北农业学报,2023,32(8):1151-1158.
[27]李小凤,谢芝勋,武晓倩,等.水牛γ干扰素的原核表达及其抗病毒活性[J].黑龙江畜牧兽医,2022(14):124-128,140.
[28]MA W T,LIU Q,NING M X,et al.Development and applications of a monoclonal antibody against caprine interferon-gamma[J].BMC Biotechnology,2019,19(1):102[2019-12-23].http://doi:10.1186/s12896-019-0596-5.
[29]杨领弟,李小梅,芦晓鸥,等.猴痘病毒B20R蛋白原核表达及其多克隆抗体的制备[J].南方农业学报,2024,55(1):217-225.
[30]汪梦竹,胡欣妍,杨宣叶,等.同义密码子使用模式对多肽链共翻译折叠的影响研究进展[J].微生物学通报,2023,50(7):3146-3158.
Cloning,Bioinformatics Analysis and ProkaryoticExpression of" IFN-γ Gene in Takin
LIU Li YAO Yuhang LIU Chenyang ZHANG Wentao
MA Junjie ZAN Linsen 2 and CHENG Gong 2
(1.College of Animal Science and Technology,Northwest Aamp;F University,Yangling" Shaanxi 712100,China;
2.National Beef Cattle Improvement Centre of Northwest Aamp;F University,Yangling" Shaanxi 712100,China)
Abstract The objective of this study was to explore the structure and function of the interferon γ (IFN-γ) gene in takin,with the aim of providing a theoretical basis for enhancing the immune regulation capacity of this species.In this study,the IFN-γ gene of takin was cloned via RT-PCR,a comprehensive analysis of its structure and function were conducted using variety of bioinformatics tools.The IFN-γ gene sequence was connected to the prokaryotic expression vector and transformed into E.coli to induce its expression.The results showed that the IFN-γ cDNA sequence of takin was 501 bp in length and encoded 166 amino acids.The prediction of the protein’s higher order structure showed that the secondary structure was dominated by α helix,with 13 phosphorylation modification sites,a signal peptide,a low-grade complex region,a transmembrane domain and an IFN-γ domain.The IFN-γ domain is located in the extracellular region.Sequence alignment analysis showed that the nucleotide sequence homology with sheep,goat,cattle,buffalo,human,chimpanzee,mouse and chicken was99.0%,98.8%,97.2%,96.2%,75.8%,75.4%,64.1%,and 54.1%,respectively.The amino acid sequence homology was 99.4%,99.4%,95.8%,95.8%,62.7%,62.7%,43.9%,and 33.5%,respectively.The result of the phylogenetic tree analysis also showed that takin was most closely related to goats and sheep.SDS-PAGE and Western-blot showed that the recombinant IFN-γ protein was abundantly expressed in soluble form with a molecular weight of about 34 ku.Through optimization strategies for prokaryotic expression,such as codon optimization and IPTG induction expression at different concentrations,it was found that codon optimization promoted the efficient expression of recombinant proteins,and the optimal induction concentration was determined to be 0.9 mmol·L-1.This study lays a foundational understanding for comprehensive functional exploration of IFN-γ gene in takin,as well as the potential application of interferon γ in takin.These findings provide novel insights into takin conservation efforts.
Key words Takin; IFN-γ; Gene cloning; Bioinformatics analysis; Prokaryoticexpression;IPTG induction
Received" 2024-01-26 Returned 2024-03-05
Foundation item Forestry Science and Technology Innovation Program" of" Shaanxi Province (No.SXLK2020-030 No.SXLK2021-0102).
First author LIU Li,female,undergraduate.Research area:conservation of animal genetic resources and molecular breeding.E-mail:liulixinong@163.com
Correspondingauthor CHENG Gong,male,Ph.D,associate research fellow.Research area:animal functional genomics and molecular breeding.E-mail:chenggong@nwafu.edu.cn
(责任编辑:顾玉兰 Responsible editor:GU Yulan)

